2型糖尿病前期患者血浆IRAK-M与TXNIP的关系
2022-08-30陈胜利贺艳婷周海燕刘惠莉白桂荣谢晓敏
陈胜利 ,贺艳婷 ,周海燕,刘惠莉,白桂荣,强 丹,谢晓敏
2型糖尿病及其慢性并发症的发生发展与氧化应激反应和氧自由基生成增加密切相关。由于活性氧(ROS)的过度产生超过了细胞的抗氧化能力,导致蛋白质修饰和脂质过氧化的诱导及随后的细胞功能障碍[1],过度产生的氧化应激产物又可以进一步刺激TOLL样受体,促进糖尿病发病及发展[2]。有研究指出,IRAK-M可通过阻止TOLL样受体信号途径IRAK1/IRAK4与MyD88分离,进而抑制NF-κB来实现对炎症信号的负向调控[3]。硫氧还蛋白(TRX)系统在对抗细胞氧化应激中发挥重要作用[4],TXNIP作为TRX的内源性负调控因子,不仅有阻断TRX的抗氧化能力,还参与其他信号通路[5]。本研究通过检测2型糖尿病前期患者血浆中IRAK-M、TXNIP的水平,探讨 TXNIP及IRAK-M与2型糖尿病早期慢性炎症的关系。
1 资料与方法
1.1 一般资料:选取2019年11月至2020年12月于宁夏医科大学第二附属医院体检的18~75岁人群作为研究对象,共计515例。2型糖尿病组(DM组)109例,男性75例,女性34例,年龄(52.56±10.26)岁;糖尿病前期组(PDM组)282例,男性196例,女性86例,年龄(52.48±12.12)岁;正常健康组(NC组)124例,男性82例,女性42例,年龄(47.02±12.12)岁。以2020年美国ADA诊断标准[6]为本次研究采用的2型糖尿病及糖尿病前期诊断标准。所有入组对象均自愿加入课题研究并签署知情同意书;无肝心肾及神经精神类疾病;均未服用交感或拟交感及糖皮质醇或其他影响血糖代谢类药物;T2DM组和PDM组均为新诊断患者,未经过饮食、运动和药物干预。
1.2 方法:对研究对象进行开放式问询,并将与本研究相关的数据记录至表格中,包括年龄、性别、血压及身高、体重,计算体质指数BMI。禁食8~12 h,于次日晨间抽取肘静脉血20 mL,检测并收集相关指标,如空腹血糖(FPG)、甘油三酯(TG)、胆固醇(TC)、高密度脂蛋白(HDL-C)与低密度脂蛋白(LDL-C);血清IRAK-M、TXNIP、空腹胰岛素(FINS)及糖化血红蛋白(HbA1C)置于-80℃冰箱备用,采用酶联免疫吸附法(ELISA)检测。胰岛素抵抗指数(HOMA-IR)=FPG×FIns/22.5;胰岛素分泌指数(HOMA-β)=20×FIns/(FPG-3.5)。
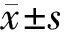
2 结果
2.1 3组患者临床指标比较:患者年龄、BMI、TG、LDL-C、FPG、HOMA-IR、HOMA-β、TXNIP、HbA1C、IRAK-M及FINS 3组比较,差异有统计学意义(P<0.05);T2DM组血清TXNIP分布水平明显较PDM组及NC组升高(P<0.05);T2DM组血清IRAK-M分布水平明显较PDM组及NC组降低(P<0.05);与此同时,随着TXNIP表达水平逐渐升高及IRAK-M降低,研究对象FPG、HOMA-IR、TXNIP及HbA1C明显升高,而HOMA-β显著性降低(P<0.05);TC、HDL-C在3组间比较,差异无统计学意义(P>0.05),见表1。
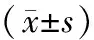
表1 3组患者临床指标比较
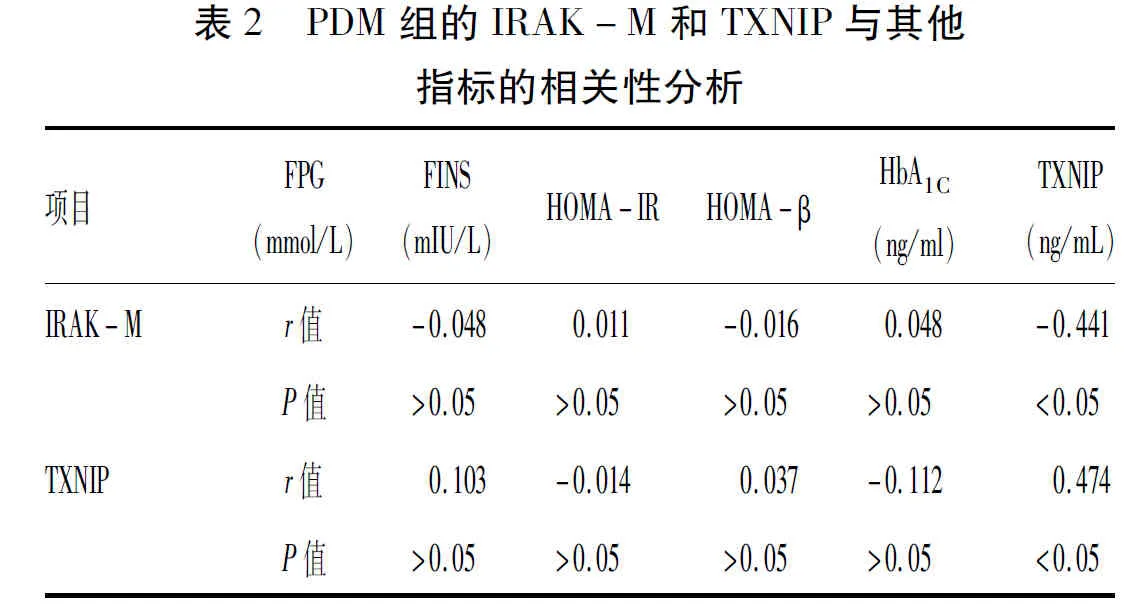
2.2 Pearson相关分析血浆IRAK-M、TXNIP与其他指标的相关性:PDM组IRAK-M与HbA1C、TXNIP水平呈负相关性(r=-0.441,-0.571;P<0.05);TXNIP与HbA1C吴正相关性(r=0.474,P<0.05),与IRAK-M呈负相关(-0.571,P<0.05),见表2。
2.3 IRAK-M和TXNIP对TDM的敏感性和特异性分析:对研究人群IRAK-M数据行糖尿病疾病状态的诊断性分析,结果显示IRAK-M曲线下面积为0.828,在最佳切点2.888上的敏感性和特异性分别为84.4%和70.4%;再次评价研究人群TXNIP对糖尿病疾病状态的诊断性价值分析显示,TXNIP ROC曲线下面积为0.880,在最佳切点5.353上的敏感性和特异性分别为78.9%和76.8%。
3 讨论
T2DM胰岛素抵抗和胰岛素分泌减损是导致病情发展的重要机制[7-8]。研究发现,氧化应激直接或者由其衍生的代谢产物介导的炎性反应在T2DM发生发展中起到了重要作用[9]。有研究提示,氧化应激过度反应会激发TOLL样受体参与炎症反应[4],TOLL样受体可能参与了糖尿病的发病过程[10]。TLRs是唤醒机体对各种病原体启动先天免疫反应的一个重要受体家族。当这些受体识别出侵入人体病原的相关分子模式后,便会拉响机体免疫警报,细胞内下游信号途径被触发激活,促炎细胞因子进入高表达阶段。然而,由TLRs刺激的过度免疫反应对宿主是有害的,甚至是致命的,因此这个过程必须由对抗过度免疫活动的保护机制严格调节。研究显示,IRAK-M对TOLL样受体信号途径具有负向调控能力,可能有益于T2DM患者[11],但在T2DM患者中IRAK-M表达显著减低[12]。因此,当T2DM患者IRAK-M表达降低时,没有足够强大的负向调控能力应对TOLL样受体介导的炎症反应,从而加速了T2DM患者糖异常代谢的病程。正是由于IRAK-M对TLRs信号通路的抑制作用,使得其在病原体清除后的炎症调控方面尤为重要。IRAK-M基因缺失或低表达都将导致炎症反应过度,从而诱发各种慢性代谢病[13-14]。本研究结果显示,PDM组患者IRAK-M表达显著下调,并且空腹血糖越高则IRAK-M表达越低。相关性分析显示,PDM组IRAK-M与HbA1C水平呈负相关性(P<0.05),提示当持续血糖紊乱造成HbA1C增高而导致IRAK-M表达下调,激活了氧化应激启动及慢性炎症反应。
糖尿病及其慢性并发症的发生发展与糖尿病患者强烈的氧化应激反应和氧自由基生成增加密切相关。活性氧是糖尿病器官组织损伤的常见机制[15],在身体的正常代谢反应中,氧能形成自由基。活性氧主要包括过氧化物、超氧化物、羟基自由基和单线态氧,它们与氧化应激密切相关。氧化应激对慢性炎症有重要影响,在胰岛素靶组织,如脂肪组织、肝脏、肌肉和胰岛中就可以观察到细胞因子浓度显著增加。有研究发现,在T2DM早期随着空腹血糖升高血浆TXNIP、NLRP3显著增加[5]。在本研究中PDM组血浆TXNIP水平明显高于NC组,且线性相关趋势分析提示糖代谢异常分组中的TXNIP与HbA1C呈正相关性,与IRAK-M水平呈负相关性(P<0.05)。因此,TXNIP有对抗细胞氧化应激的负向调控能力,当TXNIP表达失衡时TRX抗氧化能力被弱化,同时氧化应激产物的表达得以增加,T2DM前期患病倾向增加[2]。同时,本研究对IRAK-M及TXNIP进行T2DM诊断评价,ROC曲线分析显示曲线下面积均在0.8以上,提示二者在TDM早期诊断方面具有实用性。
综上所述,T2DM前期患者IRAK-M表达显著减少、TXNIP表达增高,这可能是慢性炎症状态启动的重要标志物。
