强脉冲光治疗睑板腺功能障碍后泪液细胞因子改变的临床观察
2022-08-30刘俊秀季乐阳朴俊峰安宁宇朱金燕
刘俊秀,季乐阳,杨 伟,朴俊峰,李 倩,安宁宇,朱金燕
干眼症(DED)是一种多因素引起的慢性眼表疾病,以泪膜稳态的失衡为特征。因为不能产生高质量或足够的泪液,伴有眼表炎性反应、组织损伤及神经异常,造成眼部多种不适症状和(或)视功能障碍,严重影响患者生活质量[1]。睑板腺功能障碍(MGD)的发病机制[2]被认为是一个慢性炎症、恶性循环的过程。MGD的治疗方法包括局部抗生素、抗炎药、人工泪液、热敷和睑板腺按摩[3]。近年来,强脉冲光(IPL)作为一种新的治疗方法被广泛应用于MGD的治疗。IPL治疗可改善干眼症状,改善异常泪膜成分,疗效显著[4-5]。为进一步了解IPL治疗如何干扰MGD的炎症循环过程,本文分析了MGD 患者行IPL治疗前后泪液细胞因子包括重组趋化因子(CXCL1)、趋化因子配体-11(CCL-11)、肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-17(IL-17)和基质金属蛋白酶组织抑制剂(TIMP-1)浓度的改变。
1 资料与方法
1.1 一般资料:2018年10月至2020年10月宁夏回族自治区医院眼科门诊收治睑板腺功能患者共64例64眼(女性48例,男性16例)。患者在IPL治疗期间视力和眼压保持稳定,年龄43~65岁,平均(54.13±8.74)岁。
1.1.1 纳入标准:患者年龄≥18岁;具有以下任何一种眼部不适症状超过1周者,即畏光、异物感、刺痛、视疲劳季视力下降;睑缘或睑板腺开口异常;上睑中央5条睑板腺分泌能力评分≥1或睑酯质量≥1分[6];Fitzpatrick皮肤类型为Ⅰ~Ⅳ。
1.1.2 排除标准:眼部或眼周皮肤有急性炎症或过敏;眼睑解剖结构异常,眼组织手术史;IPL治疗的光疗禁忌证;皮肤有注射药物或者假体植入物者,过去1年头颈部接受过放射治疗或者IPL治疗后8周内打算进行放射者。本研究纳入了MGD应是分期较高的眼,一旦两眼的MGD条件相符,则选择右眼。横断面研究遵循《赫尔辛基宣言》的原则,并得到医院伦理委员会的批准。所有患者均获得书面知情同意书。
1.2 研究方法
1.2.1 基线的确定:以第一次治疗前的各项参数作为基线。
1.2.2 IPL治疗:患者共接受3次IPL治疗(第六代M22 IPL强脉冲光干眼治疗仪),每次间隔3周。治疗均由同一位医生进行,根据Fitzpatric皮肤类型选择手具,脉冲强度10~16 J/cm,脉冲宽度6 ms。要求患者卸妆并清洁上下眼睑的治疗区域,治疗前5 min使用眼科盐酸丙哌卡因滴眼液,超声凝胶应用于眼睑皮肤面和中面部。治疗过程中,在结膜囊内放置金属眼盾保护角膜和巩膜,另一只眼睛带眼罩。上、下眼睑均进行IPL照射,下睑治疗时使用8 mm×15 mm大光斑适配器,从一侧发际线前颞区到另一侧颞区发际线前结束,光斑可重叠30%,有12~15个光斑;上睑治疗时使用4 mm×8 mm小光斑适配器,光斑重叠约30%,大约9个光斑。每只眼进行2遍IPL照射,以确保治疗区域的充分覆盖。IPL治疗后,用盐水棉签进行上下睑板腺按摩。随访期间指导患者使用透明质酸钠滴眼液。
1.2.3 临床评价:临床评估在基线和每次IPL治疗前进行,通过眼表疾病指数(OSDI)估计主观症状。将荧光素条应用于下结膜囊后,用钴蓝色光观察泪膜破裂时间(TBUT)。测定患者TBUT 3次,计算其平均值。采用睑板腺分泌功能总分(MGYSS)对睑板腺分泌功能进行评分,0分:清亮、透明的液体;1分:浑浊如液;2分:混浊颗粒状分泌物;3分:浓稠如牙膏状分泌物[6]。分泌物排除能力以眼睑中央5个腺体为检查对象进行评分记录。
1.2.4 泪液标本采集及细胞因子分析:在未进行任何治疗前采集样本,下睑结膜囊灌注60 μL磷酸盐缓冲盐水后采集标本。在采集泪液前,嘱患者转动眼球,收集泪液。样本保存在EP管中,在采集结束后立即储存在- 80 ℃保存,直到进一步分析。
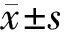
2 结果
2.1 IPL治疗后干眼症状变化情况:OSDI和MGYSS较基线降低(P<0.05);TBUT在治疗期间连续升高,与基线比较差异有统计学意义(P<0.05),见表1。
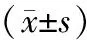
表1 64例MGD患者经IPL治疗后干眼症状变化情况
2.2 泪液细胞因子的变化:在这项研究中,使用了一种高敏感度的抗体芯片方法来定量MGD患者泪液中的细胞因子。与预处理前相比,CXCL1、CCL-11、IL-6、IL-17、TNF-α浓度明显降低,TIMP-1浓度明显升高。每次治疗后与基线比较,除TImp-1第1次治疗与基线比较差异无统计学意义外(P>0.05),其余差异均有统计学意义(P<0.05)。泪液细胞因子包括CCL-11、CXCL、IL-6、IL-17、TNF-α、和TIMP-1在每次IPL治疗后与基线的比值变化,见表2。
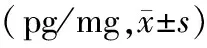
表2 64例患者IPL治疗后泪液细胞引起的浓度变化
3 讨论
MGD是一种日益普遍的眼表疾病,是患者就诊眼科的主要原因之一。目前使用的大多数治疗方法都是治标不治本,往往难以达到长期的治疗效果。近年来,IPL治疗被引入眼科领域,已有研究证实IPL治疗对改善睑板腺功能、减轻MGD症状有明显效果[7]。然而,IPL的确切机制仍未完全阐明。MGD的进展源于促炎细胞因子与眼表保护性免疫调节因子之间的失衡,泪液中炎性细胞因子的调节被认为是IPL治疗MGD的可能原因。
本研究结果显示,随着IPL的治疗,MGD患者泪液中CXCL1、CCL-11水平明显降低。CXCL1是属于CXC趋化因子家族的一种小肽,对多种免疫细胞尤其是中性粒细胞具有趋化引诱作用,并在调节免疫和炎症反应中发挥重要作用。CCL-11是一种趋化因子,最初涉及嗜酸性粒细胞选择性招募到炎症过敏反应部位。干燥综合征患者血清CCL-11水平的评估和CCL-11与疾病活动之间有一定的联系。本研究结果显示,CXCL1和CCL-11与治疗前基线相比显著降低。OSDI阐述了干眼症状包括疼痛、沙粒感、视力模糊等。因此,本文推测症状的缓解、特别是眼痛,可能与CXCL1的下降有关。CXCL1通过刺激外周炎症部位交感神经和前列腺素的释放来调节病理性疼痛。此外,CXCL1通过其趋化作用介导中性粒细胞迁移,间接驱动外周痛觉致敏[8]。IL-6被认为是DED的生物标志物,IL-6在眼表干燥后分泌。多项研究发现,MGD患者IL-6水平升高[9],本研究同样证实了这一点;随着IPL的治疗,患者的IL-6水平下降明显。TNF-α是细胞黏附和趋化的主要介质,主要负责炎症期间细胞迁移的调控,其他主要效应还包括触发产生炎症脂质介质、诱导活性氧自由基和致炎性酶分子的产生和释放。Pflugfelder将SS病人结膜上皮TNF-α的表达与正常人对比,TNF-α的RNA转录产物在SS病人结膜上皮明显增高[9]。
除此之外,在我们的研究中还发现了IL-17的变化。随着IPL的治疗,IL-17在不断下降,与基线比较,每次治疗后的浓度变化差异均有统计学意义(P<0.05)。IL-17是T细胞诱导的炎症反应的早期启动因子,是Th17细胞的主要效应因子,可以通过促进释放前炎性细胞因子来扩大炎症反应。朱峰等研究[10]发现,IL-17具有强烈的促炎作用,可以诱导促炎细胞因子,如IL-6、IL-8、趋化因子和基质金属蛋白酶(MMP-9)的表达,引起组织细胞浸润和组织破坏。并发现干眼症的BUT与结膜中IL-17的表达呈明显相关性。本研究同样证实了IL-17变化与患者临床症状改变的相关性。这些细胞因子的降低与TBUT、MGYSS和OSDI的改善也有相似的相关性,表明IPL治疗能够显著降低炎症,这是MGD的核心机制。其原因可能是IPL选择性封闭了位于眼睑边缘的浅表血管,阻止了细胞因子的持续分泌。本研究观察到TIMP-1显著升高。TMIP-1是一种天然的MMP-9胶原酶抑制剂,近年来已成为几种人类病理的决定性因素。在干眼症的体外和体内模型中均发现MMP-9的表达。Sjogren综合征患者唾液中MMP-9和TIMP-1的增加与腺管组织的破坏密切相关[10]。根据我们和以往的研究,推测TIMP-1参与了MGD的疾病过程,这一假设还需要进一步的研究来证实。
