心脏、肺和膈肌超声联合预测重症机械通气患者撤机的价值
2022-08-30赵浩天王华伟赵鹤龄刘元琳
赵浩天 王华伟 龙 玲 赵鹤龄 刘元琳 李 丽
机械通气是呼吸困难患者的有效救治手段。然而,撤机失败在机械通气患者中发生率较高[1],可导致再次气管插管、机械通气时间延长、呼吸道损伤等多种并发症[2]。撤机失败有多种原因,膈肌是主要的吸气肌肉,承载70%~80%的吸气做功,然而长期机械通气、蛋白质负平衡等协同作用下膈肌可发生萎缩[3],称为呼吸机相关性膈肌功能障碍,导致撤机后患者不能维持足够肺通气量;另一重要原因为心功能障碍。撤机是由机械通气转为自主呼吸的过程,由于胸腔内压力发生变化引起体循环回心血量增加,在心功能障碍基础上诱发液体过负荷,产生撤机相关性肺水肿(weaning-induced pulmonary oedema,WIPO)[1],导致呼吸困难。既往超声评估撤机的研究[2-3]多集中于单一膈肌功能或心功能。本研究旨在探讨自主呼吸试验(spontaneous breathing trial,SBT)开始和 15 min 时心脏、肺和膈肌超声各参数联合应用在撤机中的预测效能。
资料与方法
一、研究对象
选取2019年7月至2021年5月于我院重症医学科接受机械通气治疗>48 h的患者112例,年龄31~97岁。根据撤机后48 h呼吸状况[4]将其分为撤机成功组64例和撤机失败组48例,撤机成功组中,男40 例,女24 例,平均(60.2±15.8)岁;撤机失败组中,男33 例,女15 例,平均(65.7±15.1)岁。排除标准:①年龄<18岁;②存在中枢神经系统相关性膈肌功能障碍或膈神经损伤;③曾接受肺叶手术、胸廓畸形或肋骨骨折等。本研究经我院医学伦理委员会批准(2019 第130 号),患者或家属均知情同意。
二、仪器与方法
1.仪器:使用Philips CX 50 彩色多普勒超声诊断仪,相控阵或凸阵探头,频率1.0~5.0 MHz。
2.左心功能检测:于SBT 开始时(0 min)在心尖四腔心切面应用Simpson 法测量左室射血分数(LVEF)、左室短轴缩短率(LVFS)、二尖瓣舒张早期血流峰值速度(E)、二尖瓣环室间隔和左室侧壁舒张期组织运动峰值速度平均值(e’),并计算E/e’。
3.肺超声水肿评分(A-LUES)检测:分别于SBT 0 min、15 min 时对患者胸部进行扫查。将单侧胸前区细分为3个区域:胸骨中线与锁骨中线之间,乳头水平上方为1 区、下方为2 区;锁骨中线与腋中线之间为3区,双侧合计6个区,根据各区征象进行评分[5]:0分,扫查切面内均为A线;1分,1~2条B线;2分,≥3条离散型 B 线;3 分,B 线融合且占视野范围<1/2;4 分,B 线融合且占视野范围≥1/2 甚至全部视野;5 分,肺实变合并无或少量胸腔积液;6 分,肺实变合并中或大量胸腔积液。计算 SBT 0 min 与 15 min 时 A-LUES(A-LUES0min和A-LUES15min)及二者差值(ΔA-LUES)。
4.膈肌功能检测:于SBT 15 min 时将相控阵探头置于患者右侧锁骨中线于腋前线之间肋缘下,取横切位,取样线与膈顶垂直,在M模式下观察膈肌运动并测量吸气末至呼气末位置,测量其垂直距离即膈肌移动度(DE),斜率为膈肌收缩速度(DCV)。
以上各超声参数均重复测量3次取平均值。
三、统计学处理
应用SPSS 21.0统计软件,符合正态分布的计量资料以表示,组间比较采用t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用非参数检验。计数资料以例数或百分比表示,采用χ2检验。各超声参数两两联合或三者联合采用二元Logistic 回归预测概率法。绘制受试者工作特征(ROC)曲线分析各超声参数单独及联合应用在撤机中的预测价值。P<0.05为差异有统计学意义。
结 果
一、两组一般资料比较
两组年龄、性别、急性生理与慢性健康评分(APACHEⅡ评分)、心率、血压、二氧化碳分压、氧合指数、乳酸水平比较差异均无统计学意义;撤机失败组机械通气时间、呼吸频率均较撤机成功组高,差异均有统计学意义(均P<0.05)。见表1。
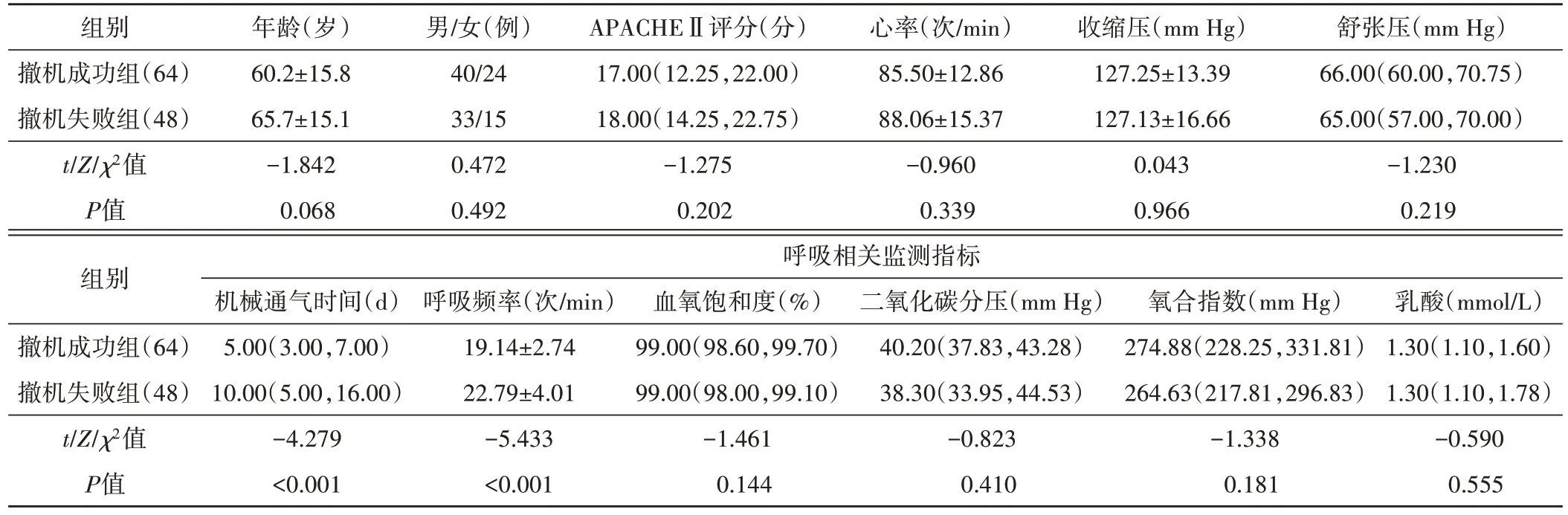
表1 两组一般资料比较
二、两组各超声参数比较
撤机失败组LVEF、DE、e’均低于撤机成功组,E/e’、A-LUES15min、ΔA-LUES 均高于撤机成功组,差异均有统计学意义(均P<0.05);两组 DCV、A-LUES0min、LVFS、E 比较差异均无统计学意义。见图1~3和表2。
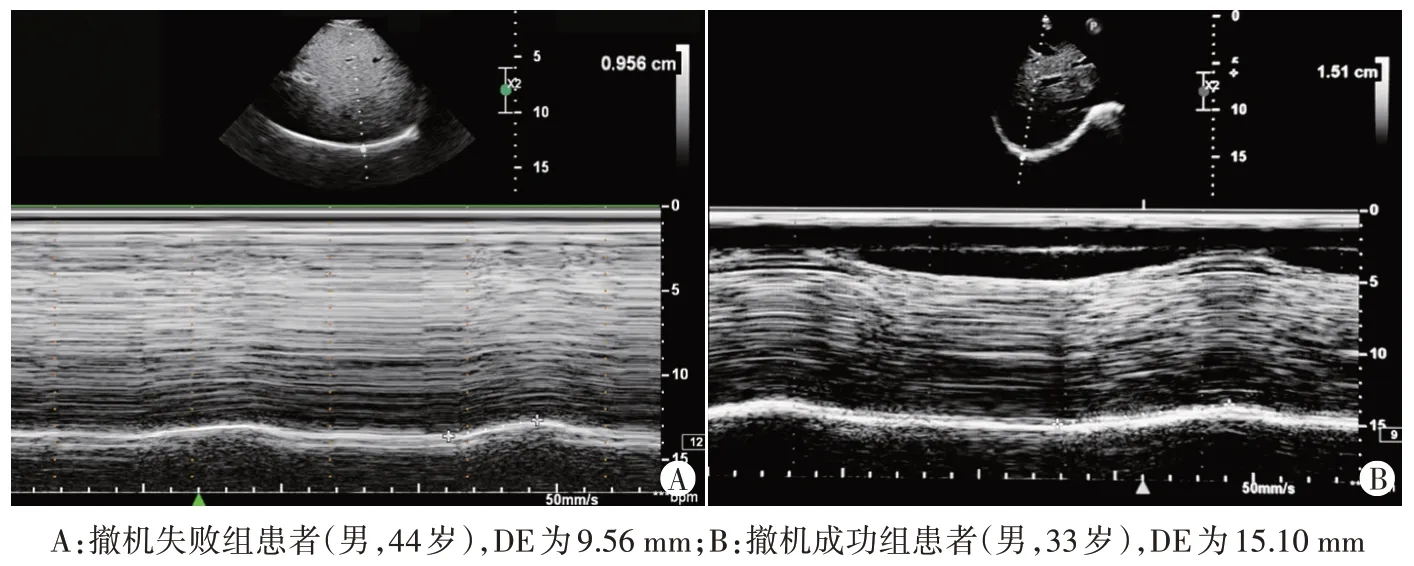
图1 两组患者膈肌超声图像

图2 两组患者心脏超声图像
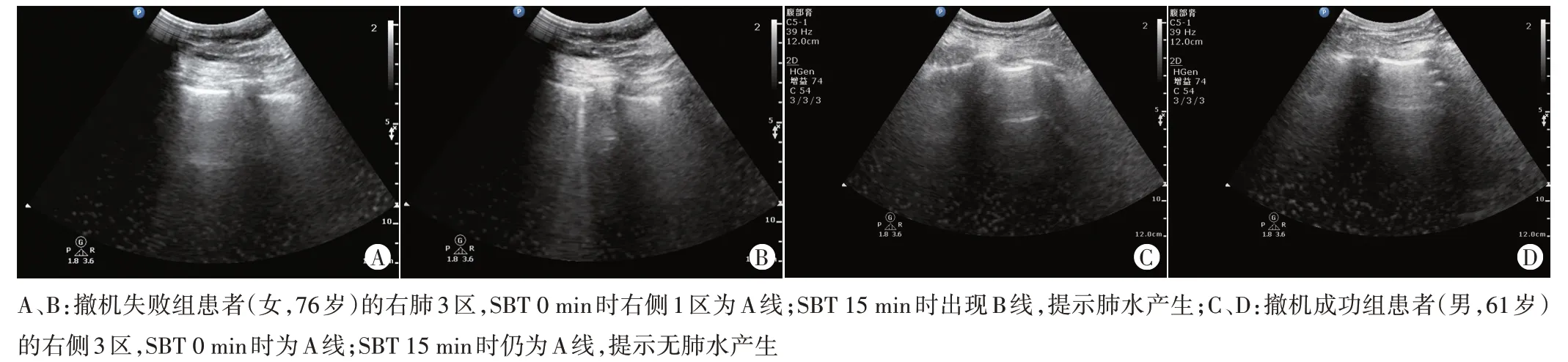
图3 两组患者肺超声图像
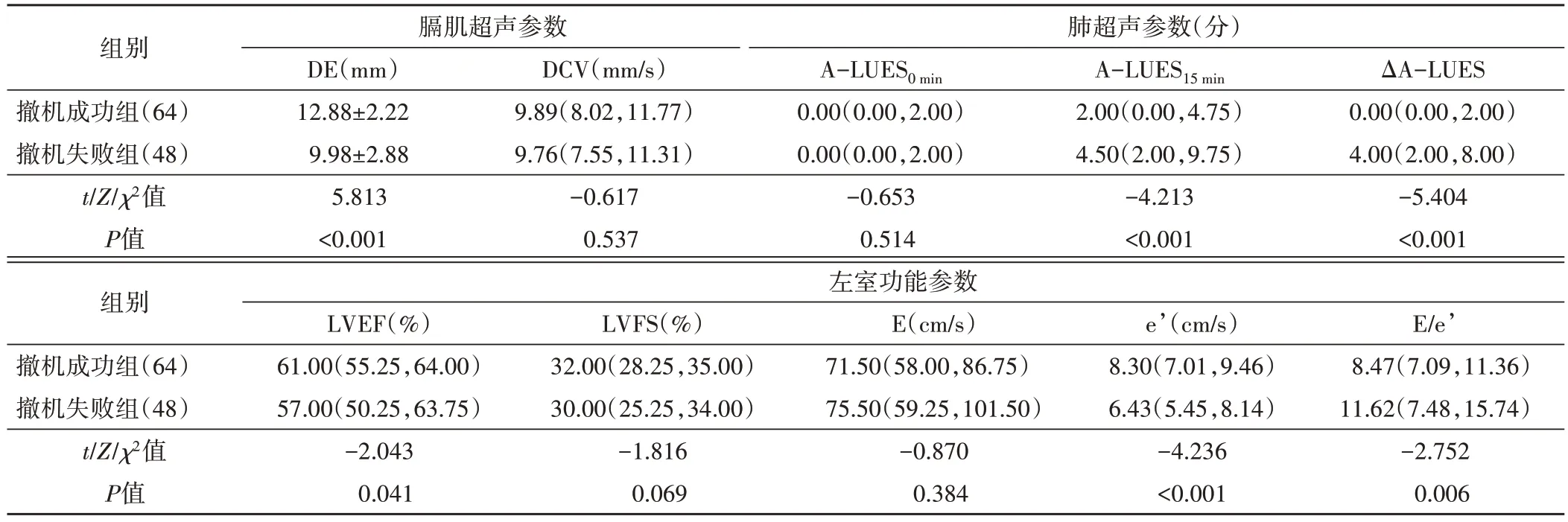
表2 两组各超声参数比较
三、ROC曲线分析
ROC曲线分析显示,当LVEF、E/e’、DE和ΔA-LUES的截断值分别为51.50%、6.48 cm/s、10.36、10.35 mm、1.50 分时,预测撤机失败的敏感性分别为93.75%、62.50%、85.94% 和 77.08%,特异性分别为 27.08%、75.00%、56.25%和67.19%,AUC 分别为0.613、0.652、0.786 和 0.793;ΔA-LUES 联 合 DE、DE 联 合 E/e’、ΔA-LUES 联合 E/e’,以及 DE、ΔA-LUES 和 E/e’三者联合预测撤机失败的曲线下面积(AUC)分别为0.909、0.852、0.793 和 0.914;其中三者联合的 AUC 最大。见表3和图4。
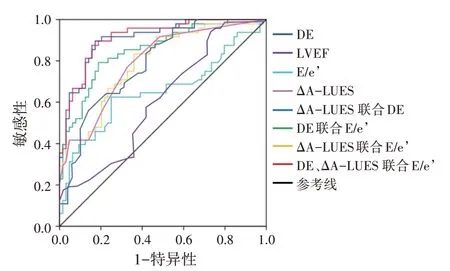
图4 各超声参数单独及联合应用预测重症机械通气患者撤机失败的ROC曲线图

表3 各超声参数单独及联合应用预测重症机械通气患者撤机失败的效能
讨 论
机械通气患者发生撤机失败是急危重症病房内常见问题。导致撤机失败的原因包括心、肺、膈肌功能。撤机通过解除胸腔内压的限制,促进体循环静脉回流,若心功能较差则无法耐受过多的回心血量,继而产生WIPO 导致撤机失败[6]。肺超声征象的变化可用于直观评估肺水肿的产生,对WIPO 有良好的评估价值[7],其中胸前区肺超声征象由A 线转变为B 线、B 线数量增多等特征性变化可作为血管外肺水增加的影像学依据[8]。本研究将胸前区划分为6 个区域进行研究发现,两组A-LUES0min比较差异无统计学意义;撤机失败组A-LUES15min和ΔA-LUES 均明显高于撤机成功组(均P<0.05),表明撤机失败组在SBT 15 min 时可经肺超声发现B 线增多,而撤机成功组肺超声征象变化不明显,提示撤机后血管外肺水增多是撤机失败的原因之一。本研究发现当ΔA-LUES 为1.50 分时,预测撤机失败的AUC为0.793。既往研究[7,9]同样选取胸前区位置进行超声检查,因胸前区B 线与肺水肿的产生高度相关。Bouhemad 等[7]对 18 例高龄撤机失败患者研究发现,胸前区肺超声参数预测撤机失败的AUC 为 0.81。Ferre 等[9]研究发现,撤机后患者胸前区B 线数量较撤机前增加≥6 条,预测WIPO 发生的AUC为0.91。上述研究均表明肺超声可用于评估WIPO 导致的撤机失败。本研究较以往研究[7,9]报道诊断效能低,分析原因:既往研究对撤机失败的病例选择集中在WIPO 因素,而本研究纳入病例还包括心功能和膈肌因素,因此单一肺超声参数的诊断效能较低。
撤机失败的另一重要影响因素为心功能。本研究结果显示,撤机失败组LVEF 低于撤机成功组,E/e’高于撤机成功组,差异均有统计学意义(均P<0.05)。当LVEF、E/e’的截断值分别为51.50%、10.36,预测撤机失败的AUC 分别为0.613、0.652。表明撤机失败患者左心功能较撤机成功患者差。E/e’代表左室充盈压,既往研究[6]证实E/e’与心源性撤机失败相关,预测价值高于LVEF。本研究也发现LVEF 预测撤机失败的敏感性、特异性及AUC 均最低,故后期各参数联合将其排除。本研究结果发现,E/e’和ΔA-LUES 联合预测撤机失败的敏感性为83.33%,特异性为64.06%,AUC 为0.793,预测价值为中等,考虑撤机失败的原因不仅与心、肺功能有关,还与膈肌功能因素相关[10-12]。本研究撤机失败组DE明显低于撤机成功组(P<0.05),当其截断值为10.35 mm 时预测撤机失败的AUC 为0.786,也证实了该结论。DE 联合ΔA-LUES、DE 联合E/e’,以及DE、ΔA-LUES、E/e’三者联合应用的AUC分别为0.909、0.852、0.914,均高于单独DE 指标;且三者联合应用的诊断的AUC 更大。表明联合心脏、肺及膈肌超声参数预测撤机失败价值更高。
本研究的局限性:①仅对右侧膈肌进行超声检查,未排除双侧膈肌功能是否平衡;②未监测腹内压,不除外腹内高压、肥胖等因素对膈肌收缩产生影响;③未对右心功能进行监测,未排除肺源性心肌病对撤机成败的潜在影响。
综上所述,心脏、肺和膈肌超声联合应用对重症机械通气患者撤机有较高的预测价值。
