怀玉山三叶青两个栽培种块根内生菌、根际微生物群落分布及其化感物质的比较分析
2022-08-30夏瑾华刘彩艳刘佳仪刘金玲刘乐彭雅婷尹明华
夏瑾华刘彩艳刘佳仪刘金玲刘乐彭雅婷尹明华
(1. 上饶师范学院生命科学学院,江西 上饶 334001;2. 上饶农业技术创新研究院,江西 上饶 334001;3. 上饶市三叶青保育与利用技术创新中心,江西 上饶 334001;4. 上饶市药食同源植物资源保护与利用重点实验室,江西 上饶 334001)
三叶青为葡萄科崖爬藤属多年生蔓生藤本植物,学名三叶崖爬藤,俗名金线吊葫芦、蛇附子、石抱子、石猴子、石老鼠等,主要分布于浙江、江西、福建、湖南、湖北、广东、广西等省(自治区),为我国特有珍稀药用植物[1]。 三叶青毒副作用小,是西药无法代替的天然“植物抗生素”,一般以块根或全草入药,可抗病毒、抗炎、镇痛、解热、保肝[2]。 在临床上,三叶青还可用来治疗各类炎症,如病毒性脑膜炎、乙型脑炎、病毒性肺炎、黄疸性肝炎等[3];三叶青块根对小儿高烧和癌症也有显著疗效,对各类肿瘤如肺癌、肝癌、胃癌、肠癌、宫颈癌等具有抑制癌细胞增殖和促进癌细胞凋亡的作用[4]。
研究表明,植物根系和根际微生物之间的相互作用对于植物的生长和品质形成至关重要[5]。植物根系通过分泌酚酸等化感物质差异性地调节根际土壤微生物群落,促进致病菌的增殖同时使有益菌衰减[6]。 三叶青在石质土壤和非石质土壤中种植两年,发现两种土壤的细菌群落显著不同,且与三叶青块根尺寸相关。 与非石质土壤中的微生物群相比,石质土壤具有更大的细菌多样性、共生网络复杂性,以及更多的Actinobacteria(放线菌门)、Rokubacteria(己科河菌门)、Rhizobiales(根瘤菌)、Desulfarculaceae(脱硫藻科)和Chthonobacteriae(红细菌)细菌类群。 此外,块茎表层土壤中细菌类群的潜在功能与宿主的基因调控途径密切相关,如植物激素生物合成、光合作用和生物胁迫抗性,对块茎的起始和发育至关重要[7]。 周武等[8]从三叶青块根的氯仿抽提物中分离出4-羟基-3-甲氧基苯甲酸、对羟基苯甲酸及十六烯酸甲酯和十八烯酸乙酯的混合物,生物活性测定表明三叶青块根的主要化感物质为4-羟基-3-甲氧基苯甲酸和对羟基苯甲酸。 还有研究表明,内生菌可通过物质循环、能量转换与宿主相互作用进而影响药用植物内环境氧化还原状态、酸碱度等特性,促进氨基酸、核酸、碳水化合物等养分的转换与储存,加快宿主药用植物对养分的吸收及代谢,从而提高中药材品质[9]。 王蕾臻[10]从三叶青块根中分离获得了多个内生菌,其中内生真菌TH15 可显著促进三叶青块根的生长和发育。 目前关于三叶青栽培种之间块根内生菌、根际微生物群落分布及其化感物质的比较分析未见报道。 本试验以怀玉山三叶青两个栽培种‘怀玉1 号’和‘怀玉2 号’为研究对象,利用Illumina 高通量测序和LC-MS 技术分析其根际微生物和块根内生菌的群落分布和化感物质的差异,整体把握两者根际微生物和块根内生菌资源状况,寻找可以提高怀玉山三叶青有效成分含量的根际微生物和块根内生菌资源,对提高怀玉山三叶青药材品质和缓解化感自毒作用具有重要的现实意义。
1 材料与方法
1.1 试验材料
怀玉山三叶青两个栽培种怀玉1 号和怀玉2号大棚高地栽培的3年生块根。
1.2 试验方法
1.2.1 两个栽培种块根内生菌和根际微生物的测序 DNA 提取:两个栽培种块根和根际土壤均各取100 g,3 次重复。 采用PowerSoilTMDNA Isolation Kit 试剂盒提取DNA,并用1%琼脂糖凝胶电泳进行检测。
PCR 扩增:使用正向引物341F(5′-CCTAYGGGRBGCASCAG-3′) 和 反 向 引 物806R (5′-GGACTACNNGGGTATCTAAT-3′)[11,12]扩增细菌16S rRNA 基因的V3-V4 高变区。 扩增体系(20 μL):5×FastPfu缓冲液4 μL,dNTPs(2.5 mmol/L)2 μL,引物(5 μmol/L)0.8 μL,FastPfu聚合酶0.4 μL,DNA 模板2.5 μL,加ddH2O 至20 μL。 PCR反应条件:95℃3 min;95℃30 s,55℃30 s,72℃30 s,27 个循环;72℃10 min,4℃保存。 每个样本3 个重复,将同一样本的PCR 产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA 凝胶回收试剂盒(AXYGEN 公司)回收PCR 产物,并用2%琼脂糖凝胶电泳进行检测。
荧光定量:将PCR 产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega 公司)进行定量检测。
Miseq 文库构建:通过PCR 将Illumina 官方接头序列添加至目标区域外端;使用凝胶回收试剂盒切胶回收PCR 产物;Tris-HCl 缓冲液洗脱后采用2%琼脂糖凝胶电泳进行检测;氢氧化钠变性,产生单链DNA 片段。 文库构建试剂盒为TruSeqTMDNA Sample Prep Kit。
Miseq 测序:DNA 片段的一端与引物碱基互补,固定在芯片上;以DNA 片段为模板,芯片上固定的碱基序列为引物,在芯片上PCR 合成目标待测DNA 片段;变性、退火后,芯片上DNA 片段的另一端随机与附近的另外一个引物互补,也被固定住,形成“桥”(bridge); PCR 扩增,产生DNA簇;DNA 扩增子线性化成为单链;加入改造过的DNA 聚合酶和带有4 种荧光标记的dNTP,每次循环只合成一个碱基;用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;将荧光基团和终止基团化学切割,恢复3′端粘性,继续聚合第二个核苷酸;统计每轮收集到的荧光信号结果,获知模板DNA 片段的序列。
生物信息分析:Miseq 测序得到的PE reads首先根据overlap 关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU 聚类分析和物种分类学分析,基于OTU 聚类分析结果,对OTU 进行多样性指数分析以及测序深度检测;基于分类学信息,在各个分类水平上进行群落结构的统计分析。 在上述分析的基础上,对多样本的群落组成和系统发育信息进行多元分析和差异显著性检验等。
1.2.2 两个栽培种块根化感物质的测定 样品处理:精确称取1000 mg 样品(两个栽培种块根的根际土壤)至装有一颗直径6 mm 的研磨珠的2 mL 离心管中;加入1000 μL 含0.02 mg/mL 内标(L-2-氯苯丙氨酸) 的提取液[甲醇∶水=4∶1(V∶V)];冷冻组织研磨仪研磨6 min(-10℃,50 Hz);低温超声提取30 min(5℃,40 kHz);样品于-20℃静置30 min;13000× g 离心15 min(4℃),移取上清液,氮气吹干;加入100 μL 复溶液(乙腈∶水=1∶1)复溶;涡旋混匀30 s,低温超声萃取5 min(5℃,40 kHz);13000× g 离心10 min(4℃),移取上清液至带内插管的进样小瓶中上机分析;另外,每个样本分别移取20 μL 上清液,混合后作为质控样本。
LC-MS 检测:本次LC-MS 分析的仪器平台为赛默飞公司的超高效液相色谱串联傅里叶变换质谱UHPLC -Q Exactive HF-X 系统。 色谱条件:色谱柱为ACQUITY UPLC HSS T3(100 mm ×2.1 mm i.d.,1.8 μm; Waters,Milford,USA);流动相A 为95%水+5%乙腈(含0.1%甲酸),流动相B 为47.5%乙腈+47.5%异丙醇+5%水(含0.1%甲酸),进样量为2 μL,柱温为40℃。 质谱条件:样品经电喷雾电离,分别采用正、负离子扫描模式采集质谱信号。 扫描范围:70~1050 m/z;鞘气流速:50 arb;辅助气流速:1350 arb;加热温度:425℃;毛细管温度:325℃;喷雾电压(正模式):3500 V;喷雾电压(负模式):-3500 V;SLens 电压:50 V;碰撞能:20、40、60 eV;分辨率(Full MS):60000;分辨率(MS2):7500。
代谢产物鉴定:将原始数据导入代谢组学处理软件Progenesis QI(Waters Corporation,Milford,USA)进行基线过滤、峰识别、积分、保留时间校正、峰对齐等,最终得到含保留时间、质荷比和峰强度等信息的数据矩阵。 其后采用该软件进行特征峰搜库鉴定,将MS 和MS/MS 质谱信息与代谢数据库进行匹配,MS 质量误差设置为小于10 mg/kg,同时根据二级质谱匹配得分鉴定代谢物。主要数据库为http:/ /www.hmdb.ca/、https:/ /metlin.scripps.edu/等主流公共数据库以及自建的数据库。
2 结果与分析
2.1 怀玉山三叶青两个栽培种块根内生菌和根际微生物的测序信息
由表1 可知,两个样品有效序列数为287798,有效碱基数为65272 031,序列平均长度为226 bp。
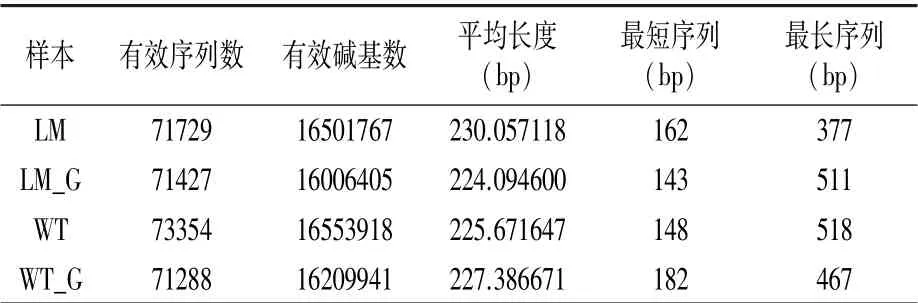
表1 怀玉山三叶青两个栽培种块根内生菌、根际微生物的测序信息统计
2.2 怀玉山三叶青两个栽培种块根内生菌和根际微生物的OTU 分析
2.2.1 分类学分析 由图1 可知,怀玉2 号块根(LM_G)的物种数量为111,怀玉1 号块根(WT_G)的物种数量为91;怀玉1 号根际土壤(WT)的物种数量为402,怀玉2 号根际土壤(LM)的物种数量为492。 表明怀玉1 号块根内生菌和根际微生物的物种数量均少于怀玉2 号。
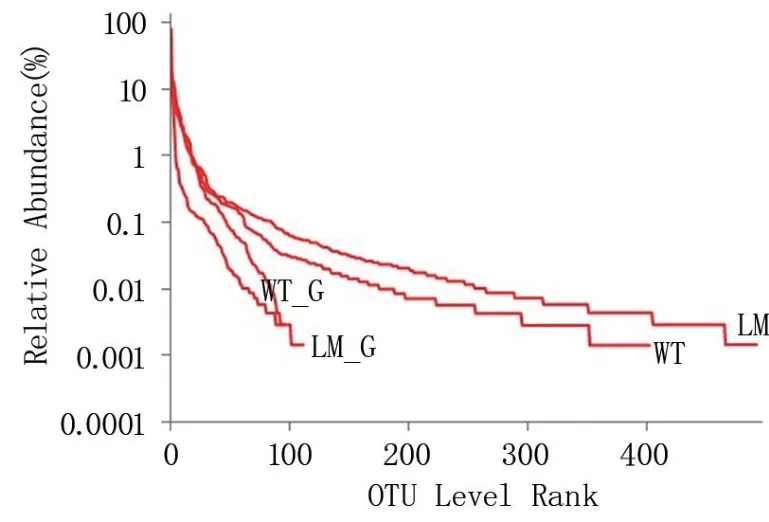
图1 怀玉山三叶青两个栽培种块根内生菌和 根际微生物OTU 分析的Rank-Abundance 曲线
2.2.2 Pan/Core 物种分析 由图2 可知,怀玉山三叶青两个栽培种块根内生菌和根际微生物序列Core OTU 随着样本数目的增加逐渐减少;Pan OTU 随着样本数目的增加逐渐增加。
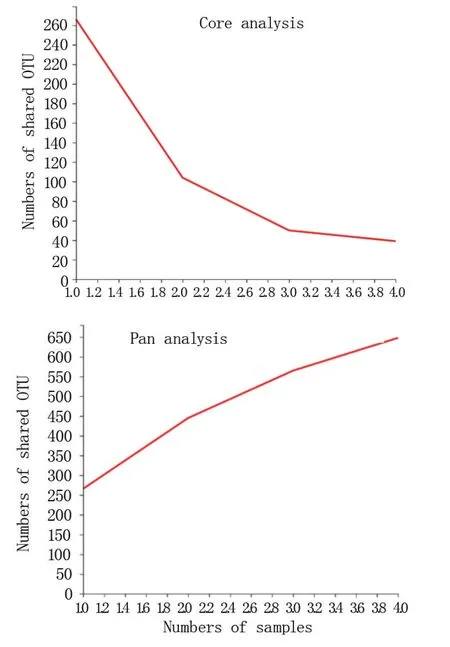
图2 怀玉山三叶青两个栽培种块根内生菌和 根际微生物的Pan/Core OTU 分析
2.3 怀玉山三叶青两个栽培种块根内生菌和根际微生物的Alpha 多样性分析
2.3.1 Alpha 多样性指数 从表2 可知,怀玉1号块根(WT_G)的Ace 指数和Chao 1 指数最高,其次是怀玉2 号根际土壤(LM),怀玉2 号块根(LM_G)和怀玉1 号根际土壤(WT)较低,表明怀玉1 号块根(WT_G)和怀玉2 号根际土壤(LM)的物种数较多。 怀玉1 号根际土壤(WT)的覆盖度最高。 对于Shannon 指数,怀玉1 号块根(WT_G)和怀玉2 号根际土壤(LM)较高,而怀玉2 号块根(LM_G)和怀玉1 号根际土壤(WT)较低,表明怀玉1 号块根(WT_G)和怀玉2 号根际土壤(LM)的物种多样性较高。 对于Simpson 指数,怀玉2 号块根(LM_G)最高,怀玉1 号块根(WT_G)最低,表明怀玉1 号块根(WT_G)的物种多样性最高。
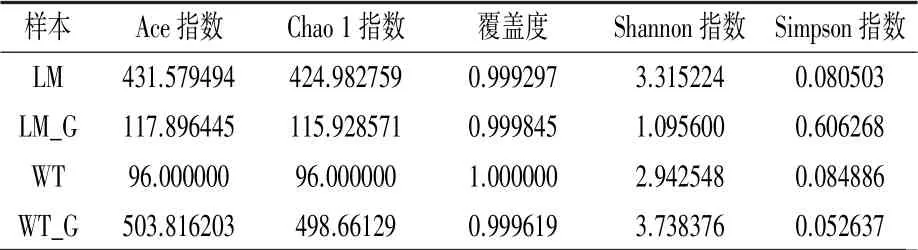
表2 怀玉山三叶青两个栽培种块根内生菌、根际微生物的Alpha 多样性指数
2.3.2 稀释曲线 由图3 可知,怀玉1 号块根(WT_G)、怀玉2 号根际土壤(LM)、怀玉2 号块根(LM_G)和怀玉1 号根际土壤(WT)的稀释曲线随取样量的增加均趋向平坦,说明测序数据量合理。
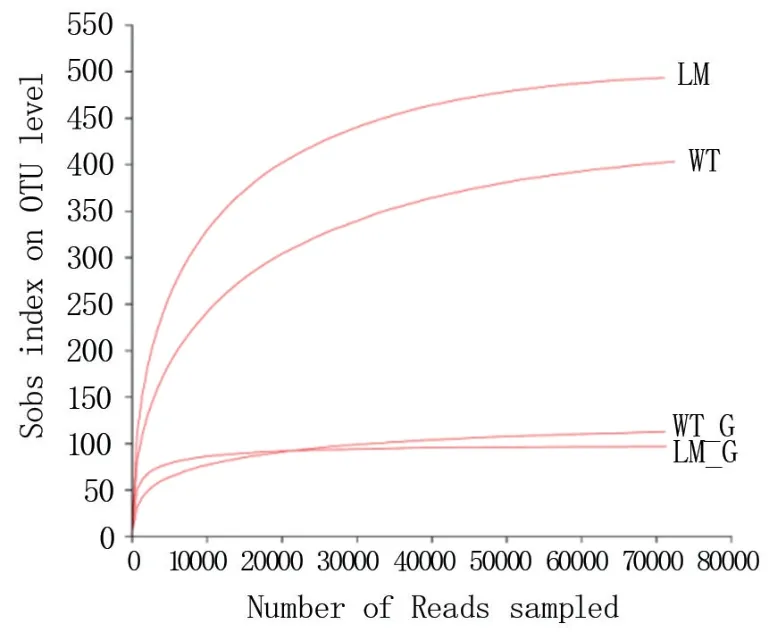
图3 怀玉山三叶青两个栽培种块根内生菌和根际微生物的稀释曲线
2.4 怀玉山三叶青两个栽培种块根内生菌和根际微生物的群落组成
怀玉山三叶青两个栽培种块根内生菌和根际微生物群落主要为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、罗兹菌门(Rozellomycota)、被孢霉门(Mortierellomycota,图4)。 在怀玉2 号根际土壤(LM)中,子囊菌门(Ascomycota)占比64.87%,unclassified_k_Fungi 占比18.66%,担子菌门(Basidiomycota)占比7.54%,罗兹菌门(Rozellomycota)占比0.93%,被孢霉门(Mortierellomycota)占比7.94%,others 占比0.06%;在怀玉1 号根际土壤(WT)中,子囊菌门(Ascomycota)占比63.18%,unclassified_k_Fungi 占比2.32%,担子菌门(Basidiomycota)占比22.20%,罗兹菌门(Rozellomycota)占比2.83%,被孢霉门(Mortierellomycota)占比9.41%,others 占比0.05%;在怀玉2 号块根(LM_G) 中,子囊菌门(Ascomycota) 占比96.88%,担子菌门(Basidiomycota)占比3.08%,罗兹菌门(Rozellomycota) 占比0.01%,被孢霉门(Mortierellomycota) 占 比 0. 03%,others 占 比0.01%;在怀玉1 号块根(WT_G)中,子囊菌门(Ascomycota)占比83.36%,unclassified_k_Fungi占比0. 07%,担 子菌 门(Basidiomycota) 占 比15.43%,罗兹菌门(Rozellomycota)占比0.02%,被孢霉门(Mortierellomycota)占比7.94%,others 占比0.04%。表明怀玉2 号根际土壤(LM)和怀玉1号根际土壤(WT)的优势群落均为子囊菌门(Ascomycota),且两者的子囊菌门(Ascomycota)数量相差不大,怀玉1 号根际土壤(WT)的担子菌门(Basidiomycota) 数量高于怀玉2 号根际土壤(LM);怀玉2 号块根(LM_G)和怀玉1 号块根(WT_G)的优势群落也均为子囊菌门(Ascomycota),其次为担子菌门(Basidiomycota),怀玉1 号块根(WT_G)的担子菌门(Basidiomycota)数量高于怀玉2 号块根(LM_G),子囊菌门(Ascomycota)数量低于怀玉2 号块根(LM_G)。
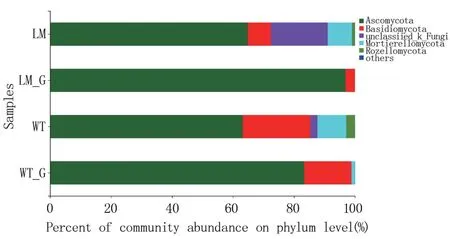
图4 怀玉山三叶青两个栽培种块根内生菌和根际微生物的群落组成分析
2.5 怀玉山三叶青两个栽培种块根内生菌和根际微生物的样本层级聚类分析
由图5 可知,怀玉2 号根际土壤(LM)和怀玉1 号根际土壤(WT)聚为一个层级;怀玉2 号块根(LM_G)和怀玉1 号块根(WT_G)聚为另一个层级。
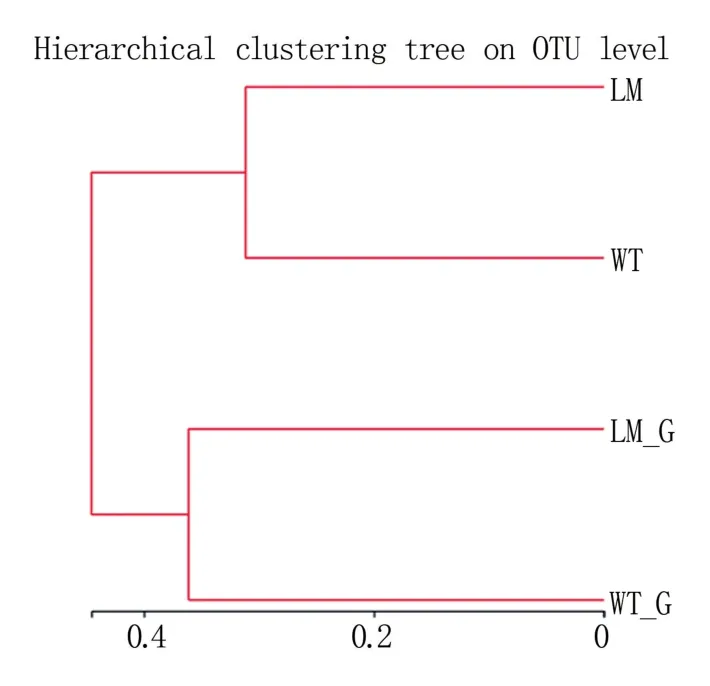
图5 怀玉山三叶青两个栽培种块根内生菌和 根际微生物的样本层级聚类分析
2.6 怀玉山三叶青两个栽培种块根内生菌和根际微生物的样本距离热图
由图6 可知,怀玉2 号根际土壤(LM)和怀玉2 号块根(LM_G),怀玉1 号根际土壤(WT)和怀玉1 号块根(WT_G)的距离最远,颜色梯度代表的数值为1。 怀玉2 号根际土壤(LM)和怀玉1号根际土壤(WT),怀玉2 号块根(LM_G)和怀玉1 号块根(WT_G)的距离最近,颜色梯度代表的数值为0.6。

图6 怀玉山三叶青两个栽培种块根内生菌和根际微生物的样本距离热图
2.7 怀玉山三叶青两个栽培种块根内生菌和根际微生物的PCA 分析
由图7 可知,怀玉2 号根际土壤(LM)和怀玉1 号根际土壤(WT)两样本点接近,表明两样本物种组成相似。 怀玉2 号块根(LM_G)和怀玉1 号块根(WT_G)两样本点较远,表明两样本物种组成不同。
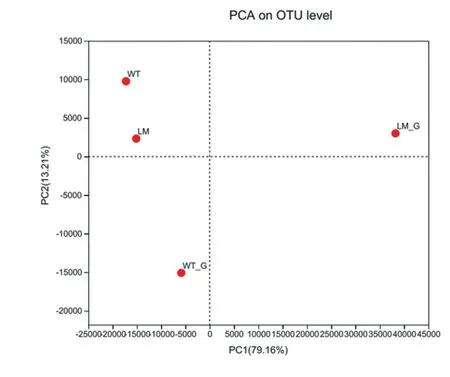
图7 怀玉山三叶青两个栽培种块根内生菌和 根际微生物的PCA 分析
2.8 怀玉山三叶青两个栽培种块根内生菌和根际微生物的多物种差异检验
怀玉山三叶青两个栽培种块根内生菌和根际微生物的多物种差异检验见图8。 怀玉2 号根际土壤(LM)和怀玉1 号根际土壤(WT)子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、unclassified_k_Fungi、被孢霉门(Mortierellomycota)、罗兹菌门(Rozellomycota)、球囊菌门(Glomeromycota)、 壶 菌 门( Chytridiomycota)、 捕 虫 霉 门(Zoopagomycota)均具有显著性差异,而Monoblepharomycota 的数量无显著性差异。 怀玉2 号块根(LM_G)和怀玉1 号块根(WT_G)子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、unclassified_k_Fungi、球囊菌门(Glomeromycota)、罗兹菌门(Rozellomycota)、壶菌门(Chytridiomycota)的数量均具有显著性差异。
2.9 怀玉山三叶青两个栽培种块根内生菌和根际微生物的KEGG 功能丰度
由图9 可知,怀玉2 号块根(LM_G)和怀玉1号块根(WT_G)内生菌、怀玉2 号根际土壤(LM)和怀玉1 号根际土壤(WT)微生物KEGG 功能丰度较高的酶类主要有:EC3.6.1.3(腺苷三磷酸酶,adenosinetriphosphatase)、EC5.3.1.4(L-阿拉伯糖异构酶,L-arabinose isomerase)、EC3.2.1.3(葡聚糖1,4-α-葡萄糖苷酶,glucan 1,4-alpha-glucosidase)、EC2.7.7.6(DNA 定向RNA 聚合酶,DNAdirected RNA polymerase)、EC3.2.1.18(外显α 唾液酸酶,exo-alpha-sialidase)、EC5.2.1.8(肽基脯氨酰异构酶,peptidylprolyl isomerase)、EC2.7.7.7(DNA 定向DNA 聚合酶,DNA-directed DNA polymerase)、EC2.3.1.48(组蛋白乙酰转移酶,histone acetyltransferase)、EC3.6.3.14[H(+)-传输双扇区ATP 酶,H(+)-transporting two-sector ATPase]、EC3.4.25.1(蛋白酶体内肽酶复合物,proteasome endopeptidase complex)、EC3.1.3.16(蛋白质丝氨酸/苏氨酸磷酸酶,protein-serine/threonine phosphatase)、EC1.14.14.1(非特异性单加氧酶,unspecific monooxygenase)等。
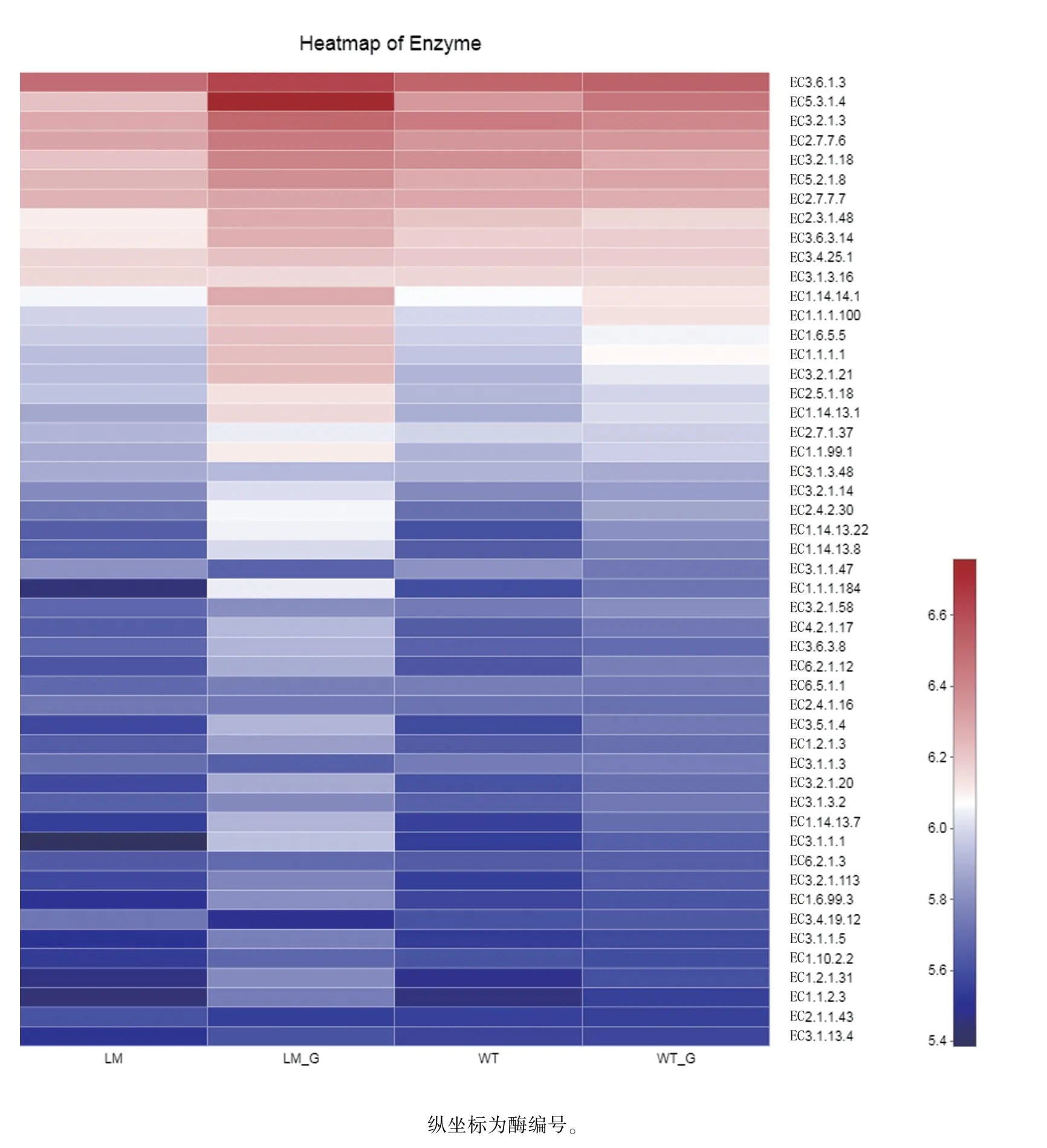
图9 怀玉山三叶青两个栽培种块根内生菌和根际微生物的KEGG 功能丰度统计
2.10 怀玉山三叶青两个栽培种块根内生菌和根际微生物的FUNGuild 功能分类
由图10 可知,怀玉2 号块根(LM_G)和怀玉1 号块根(WT_G)内生菌、怀玉2 号根际土壤(LM)和怀玉1 号根际土壤(WT)微生物的分类主要有:未定义腐生真菌(Undefined Saprotroph)、内生凋落物腐生菌土壤腐生菌未定义腐生真菌(Endophyte-Litter Saprotroph-Soil Saprotroph-Undefined Saprotroph)、动物病原内生真菌寄生虫植物病原木腐生物(Animal Pathogen-Endophyte-Fungal Parasite-Plant Pathogen-Wood Saprotroph)、动物病原未定义腐生真菌(Animal Pathogen-Undefined Saprotroph)、动物病原体内生真菌地衣寄生虫植物病原体土壤腐生真菌木材腐生真菌(Animal Pathogen-Endophyte-Lichen Parasite-Plant Pathogen-Soil Saprotroph-Wood Saprotroph)、真菌寄生虫未定义腐生物(Fungal Parasite-Undefined Saprotroph)、动物病原体粪腐菌内生真菌植物腐生木(Animal Pathogen-Dung Saprotroph-Endophyte-Epiphyte -Plant Saprotroph-Wood)、动物病原体内生真菌地衣寄生虫植物病原体木材腐生真菌(Animal Pathogen-Endophyte-Lichen Parasite-Plant Pathogen-Wood Saprotroph)、 动 物 病 原(Animal Pathogen)、植物病原(Plant Pathogen)、内生菌根植物病原菌未定义腐生真菌(Endomycorrhizal-Plant Pathogen-Undefined Saprotroph)、土壤腐生真菌(Soil Saprotroph)、内生凋落物腐生真菌木材腐生真菌(Endophyte-Litter Saprotroph-Wood Saprotroph)等。

图10 怀玉山三叶青两个栽培种块根内生菌和根际微生物的FUNGuild 功能分类统计
2.11 怀玉山三叶青两个栽培种根际土壤化感物质分析
图11显示,在该检测条件下,峰形良好,分布相对均匀。
图11 怀玉山三叶青两个栽培种根际土壤 代谢物LC-MS 总离子色谱图
通过LC-MS 技术对怀玉山三叶青两个栽培种根际土壤进行检测,共鉴定出6 种酚酸类化感物质(表3)。 怀玉1 号根际土壤(WT)的龙胆酸、香草醛酸和水杨酸含量高于怀玉2 号根际土壤(LM),而丁香酸、没食子酸和阿魏酸含量低于怀玉2 号根际土壤(LM)。

表3 怀玉山三叶青两个栽培种根际土壤化感物质的比较分析
3 讨论与结论
研究表明,根际微生物-植物-环境之间互作关系较为敏感,根际土壤微生物的多样性、生理活性及微生物间的相互作用决定植物的品质和产量[13]。 高通量测序具有成本低、通量高等优点,在微生物生态学研究中得到了广泛应用。 本试验通过Miseq 测序平台研究了怀玉山三叶青两个栽培种根际土壤微生物的群落结构组成,为后续怀玉山三叶青化感效应研究奠定了基础。 唐彬彬等[14]发现,在真菌群落中,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、 壶菌门(Chytridiomycota)和接合菌门(Zygomycota)在三七根际土壤群落中属于优势菌群。 苏小惠等[11]发现,5 个苎麻品种根际土壤真菌中子囊菌门、接合菌门和担子菌门为优势门。 杨潇湘等[12]发现大豆和油菜根际土壤在门水平的优势类群相同,如子囊菌门、接合菌门、担子菌门和壶菌门等的丰度都较高,但在属水平上两种样品之间具有显著差异。本试验中,怀玉2 号根际土壤(LM)和怀玉1 号根际土壤(WT)的优势群落均为子囊菌门(Ascomycota),其次为担子菌门(Basidiomycota),与上述结果一致。 Tan[15]、吴照祥[16]等发现,三七根际有益真菌被孢霉门(Mortierellomycota)的丰富度随三七种植年限的增加而减少,可能使得真菌属水平上种群失衡引起一些病原真菌如子囊菌门和担子菌门的种群丰富度增加,从而导致三七发生连作障碍。 本试验中,怀玉2 号块根(LM_G)子囊菌门的数量显著多于怀玉1 号块根(WT_G),怀玉2 号块根(LM_G)担子菌门(Basidiomycota)的数量显著低于怀玉1 号块根(WT_G),怀玉2号根际土壤(LM)有益真菌被孢霉门(Mortierellomycota) 的数量显著低于怀玉1 号根际土壤(WT)。 怀玉山三叶青两个栽培种的块根内生菌和根际土壤微生物的病原真菌和有益真菌群落在同一栽培种内分布较为一致。
植物内生菌菌群结构组成随物种及其基因型、生长环境不同而异[17]。 内生菌以植物为宿主载体,二者相互作用形成微生态系统,间接影响植物的品质和产量[18]。 蔡媛等[19]利用MiSeq 高通量技术,发现湖南、安徽、江西、湖北、贵州5 个产地15 组多花黄精内生菌数量和种类丰富,其内生真菌的优势菌群为子囊菌门下一未知鉴定菌属,其次为赤壳属、炭疽属、间座壳属、镰刀菌属等。 杨立昌等[20]基于高通量测序,探明金钗石斛种子的内生真菌序列归为14 个OTUs,隶属于子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和接合菌门(Zygomycota ),其中子囊菌门为优势门。 雷锋杰等[21]发现,人参根部相对丰度最高的内生真菌类群为子囊菌门(Ascomycota),占各人参样品的80%以上,是人参内生真菌中最主要的真菌类群,其次是担子菌门(Basidiomycota),其相对丰度比例较高。 本试验结果与上述结果一致。
三叶青已被证实具有化感自毒作用,主要化感物质为4-羟基-3-甲氧基苯甲酸和对羟基苯甲酸[8]。 本试验用GC-MS 技术检测出6 种化感物质,其中怀玉1 号根际土壤(WT)的龙胆酸、香草醛酸和水杨酸含量高于怀玉2 号根际土壤(LM),而丁香酸、没食子酸和阿魏酸含量低于怀玉2 号根际土壤(LM)。 说明怀玉山三叶青两个栽培种怀玉1 号和怀玉2 号造成化感自毒和连作障碍的物质有所差异。
