色素上皮衍生因子对视网膜X 射线损伤的保护作用
2022-08-29丁伯洋李文艳刘芬菊陈新建俞家华
朱 冉 丁伯洋 李文艳 李 婕 刘芬菊 陈新建 俞家华
1(苏州大学苏州医学院放射医学与防护学院 苏州 215123)
2(放射医学与辐射防护国家重点实验室 苏州 215123)
3(苏州大学电子信息学院 苏州 215006)
色素上皮衍生因子(Pigment epithelium-derived factor,PEDF)是由418 个氨基酸组成的分泌型糖蛋白,分子量为50 kDa,属于丝氨酸蛋白酶抑制蛋白超家族成员,因首次在视网膜色素上皮(Retinal pigment epithelium,RPE)细胞中被发现而得名,其在心、脑、肝、肾、肺、骨等组织广泛表达,具有多种活性功能,如营养神经、抗血管生成、抗氧化、抗炎症与抗肿瘤功能[1-4]。在动物模型中发现敲除PEDF可加重诱导性和遗传性的视网膜变性[5],体内外实验也表明外源性给予PEDF可以有效保护RPE细胞和感光细胞[6-7],说明眼部的PEDF 对于维持视网膜的正常功能、抵御外界损伤因素具有重要作用。
放射性视网膜病变常见于葡萄膜黑色素瘤与鼻咽癌放疗后,是导致患者视力损伤和眼球萎缩的重要原因,主要的病理学改变是血管内皮细胞损伤、黄斑水肿、视网膜变性坏死,目前尚无特异性疗法,临床主要治疗手段是采用糖皮质激素抗炎与抗血管生成因子,但对于视力损伤的疗效并不理想[8-9]。本研究旨在研究PEDF 对视网膜辐射损伤的作用,我们选用了人RPE 细胞ARPE-19,在抑制PEDF功能后检测了X射线对ARPE-19细胞的损伤作用,接着分析了PEDF 上第44~77 位的34 个氨基酸片段(PEDF-34)对视网膜X 射线损伤的保护作用。本实验结果能为临床防治放射性视网膜病变提供新的实验依据。
1 材料与方法
1.1 主要试剂
杜氏改良Eagle:F12 培养基(DMEM:F12)(美国Hyclone);胎 牛 血 清(FBS)(以 色 列BI);Atglistatin(ATG)(美 国Selleck);溴 烯 醇 内 酯(Bromoenol lactone,BEL)(美国Sigma);CCK-8 试剂盒与苏木素伊红(HE)染色试剂盒(上海碧云天生物技术有限公司);Lipofectamine RNAiMAX Reagent(美国Invitrogen);PEDF siRNA(siRNA1:正义 链5'-GCGAACAGAAUCCAUCAUUTT-3',反 义链 5'-AAUGAUGGAUUCUGUUCGCTT-3';siRNA2: 正 义 链 5'-GCAGUGGGUAACAAAGUUUTT-3',反 义 链5'-AAACUUUGUUACCCACUGCTT-3';siRNA3:正义链5'-CCGGAAGCAUGAGUAUCAUTT-3',反 义 链5'-AUGAUACUCAUGCUUCCGGTT-3';阴 性 对 照siRNA: 正 义 链 5'-UUCUCCGAACGUGUCACGUTT-3',反 义 链5'-ACGUGACACGUUCGGAGAATT-3')由上海吉玛制药技术有限公司合成;RNA小量抽提试剂盒与逆转录试剂盒(日本Takara);Talent荧光定量检测试剂盒(北京天根生化科技有限公司);PCR 引物(PEDF:正 向5'-TTCAAAGTCCCCGTGAACAAG-3',反 向5'-GAGAGCCCGGTGAATGATGG-3';GAPDH:正向 5'-CTGGGCTACACTGAGCACC-3',反 向 5'-AAGTGGTCGTTGAGGGCAATG-3')由上海生工生物工程有限公司合成;PEDF ELISA试剂盒(武汉菲恩生物科技有限公司);PEDF-34由南京晨胎生物科技有限公司合成;眼球固定液(武汉塞维尔生物科技有限公司);TUNEL细胞凋亡检测试剂盒(江苏凯基生物技术有限公司)。
1.2 细胞培养与照射
ARPE-19 细胞购自北京中生奥邦生物科技有限公司,采用含10% FBS、100 U/mL 青霉素与100 μg/mL 链霉素的DMEM:F12 培养基于37 ℃、5%CO2、饱和湿度的培养箱中培养,每2~3 d传代一次。细胞照射采用RS-2000 Pro 型X 射线辐照仪(美国Rad Source),管电压为160 kV,管电流为25 mA、剂量率为1.1 Gy/min,剂量率采用指型电离室标定。
1.3 CCK-8细胞活力测定
取对数生长期的ARPE-19 细胞,以4 000 个细胞/孔接种于96 孔板中,待X 射线处理48 h 后每孔加入10 μL CCK-8溶液并孵育2 h,采用Synergy 2酶标仪(美国BioTek)测定450 nm的吸光度,以空白对照组的吸光度定为100%细胞活力。
1.4 siRNA转染
取对数生长期的ARPE-19细胞,以20 000个细胞/孔接种于6 孔板中,过夜培养贴壁,采用Lipofectamine RNAiMAX Reagent 转 染 siRNA(25 pmol/每孔),继续培养2 d后进行后续实验。
1.5 RNA提取与逆转录
细胞总RNA 采用RNA 小量抽提试剂盒提取,用逆转录试剂盒合成cDNA,反应体系:5 倍的反应缓冲液2 μL(含dNTP、Mg2+)、逆转录酶混合物0.5 μL(含RNA 酶抑制剂)、Oligo dT 引物25 pmol、总RNA 500 ng、用纯水补足体积到10 μL。反应条件:先37 ℃、15 min,后85 ℃、5 s。
1.6 荧光定量PCR
荧光定量PCR反应体系:上述逆转录反应体系2 μL、2 倍的Talent qPCR PreMix 10 μL、正向引物6 pmol、反 向 引 物6 pmol、50 倍ROX 参 考 染 色0.4 μL、用纯水补足体积到20 μL。采用ViiA7荧光定量PCR 仪(美国Life Technologies)进行扩增分析,反应条件:预变性95 ℃3 min、PCR 40个循环,每循环95 ℃5 s、60 ℃15 s。相对定量分析采用2-ΔΔCt法,以GAPDH 为内参对照,阴性对照siRNA 转染组表达为1。
1.7 ELISA测定PEDF浓度
ARPE-19 细胞siRNA 转染2 d 后换液,继续培养4 h 取上层培养基,4 ℃1 000×g离心20 min,采用PEDF ELISA试剂盒进行浓度测定,PEDF标准品倍稀释后与样本分别加入ELISA微孔板,37 ℃孵育90 min,用洗涤液洗板2次,每孔加入生物素标记抗体工作液,37 ℃孵育60 min,洗板3次,加入辣根过氧化物酶-链霉亲和素偶联物工作液,37 ℃孵育30 min,洗板5 次,加入显色液,37 ℃孵育15 min,加入终止液后采用酶标仪测定450 nm的吸光度。将标准浓度与相应吸光度绘制标准曲线并计算样本PEDF浓度。
1.8 PEDF蛋白结构可视化
PEDF 蛋白结构文件下载于Molecular Modeling Database(PDB ID:1IMV),采用PyMol 2.3.5软件进行蛋白三维结构的可视化。
1.9 小鼠视网膜辐射损伤模型
6~8周龄SPF级雄性C57BL/6J小鼠购自上海斯莱克实验动物有限公司,将PEDF-34溶于医用生理盐水,终浓度为2 nmol/L。小鼠随机分为三组:空白对照组、20 Gy照射组和20 Gy照射与PEDF-34处理组。照射前使用1%戊巴比妥钠腹腔注射麻醉小鼠,采用小动物放射治疗模拟定位机X-RAD SmART(美国Precision)设左右两野对穿照射小鼠眼部,圆形准直器直径5 mm,管电压225 kV,管电流13 mA,每野各照射10 Gy X 射线,采用仪器内置平板探测器进行剂量测定。照射结束后于SPF 动物房饲养,PEDF-34处理组每天在小鼠眼球滴加PEDF-34溶液2 μL,其余两组滴加生理盐水,滴加处理4周后继续饲养,于照射8 周后取眼球固定,石蜡包埋切片,进行HE染色与TUNEL染色。本动物实验经苏州大学实验动物伦理委员会批准。
1.10 统计学分析
使用SPSS 19.0 软件进行统计学分析,数据以均数±标准差(Mean±SD)表示,样本均数比较采用单因素方差分析,p<0.05 表示组间差异有统计学意义。
2 结果
2.1 抑制PEDF 功能对APRE-19 细胞辐射损伤的作用
作为一种分泌型糖蛋白,PEDF 通过与相应的受体结合发挥生物学作用,PEDF 受体抑制剂ATG或BEL 可阻断其受体的信号传导,从而发挥抑制PEDF的功能[10-11]。图1显示4 Gy X射线轻微降低了ARPE-19 细胞的活力,但没有统计学差异,预处理10 μmol/L ATG 或1 μmol/L BEL 2 h,再处理X 射线可显著降低细胞活力,与各自单纯药物处理组相比有统计学差异,提示抑制PEDF 功能可以增强X 射线对ARPE-19细胞的损伤作用。
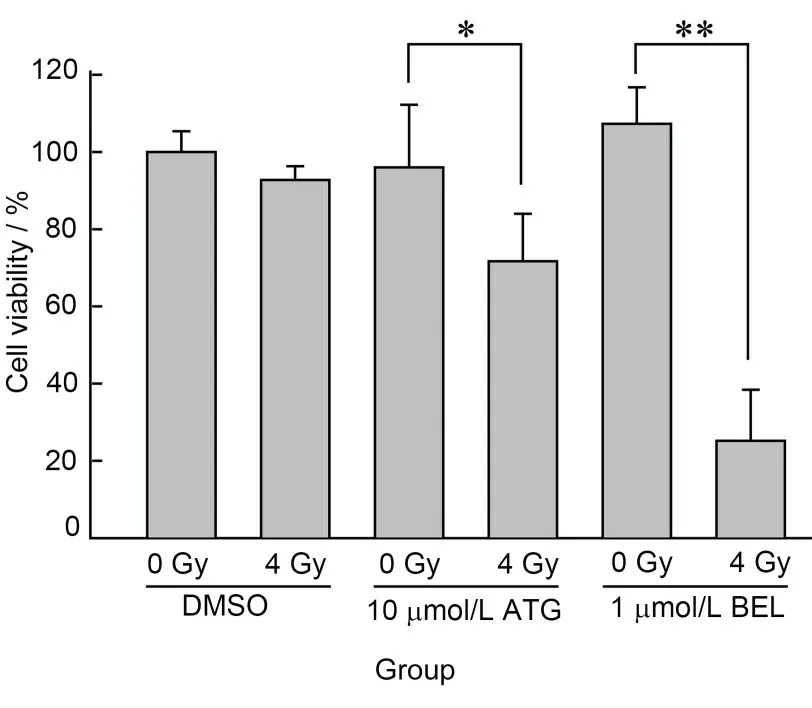
图1 PEDF受体抑制剂联合X射线处理对ARPE-19细胞活力的作用;*p<0.05,**p<0.01Fig.1 Effects of PEDF receptor inhibitors and X-ray on the cell viability of ARPE-19 cells;*p<0.05,**p<0.01
2.2 降低PEDF 表达对APRE-19 细胞辐射损伤的作用
为降低ARPE-19 细胞中PEDF 的表达,我们针对PEDF基因序列设计了三对siRNA,转染2 d后提取细胞总RNA进行逆转录荧光定量PCR分析。图2(a)显示三对siRNA 均可降低PEDF 的mRNA 表达水平,其中siRNA-1 效果最佳,用于后续实验。ELISA证实转染siRNA-1能够显著降低细胞培养基中的PEDF 浓度(图2(b)),说明ARPE-19 细胞分泌PEDF 受到了抑制。siRNA-1 转染ARPE-19 细胞2 d后处理4 Gy X射线,结果表明,siRNA-1转染组的细胞活力显著低于阴性对照siRNA转染组(图2(c))。
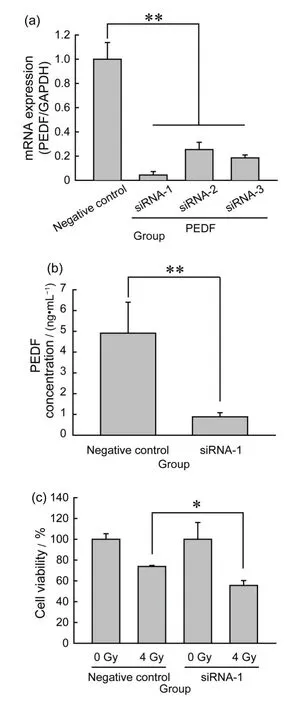
图2 降低PEDF表达对ARPE-19细胞辐射损伤的作用:(a)三对siRNA转染对PEDF mRNA水平的作用;(b)ELISA检测siRNA-1转染后培养基中PEDF的浓度;(c)siRNA-1转染联合X射线对ARPE-19细胞活力的作用;*p<0.05,**p<0.01Fig.2 Effects of PEDF downregulation on the radiationinduced damage of ARPE-19 cells:(a)effects of three siRNA duplexes transfection on the PEDF mRNA levels;(b)PEDF concentration in the medium measured by ELISA after transfection of siRNA-1;(c)effects of siRNA-1 transfection and X-ray on the cell viability of ARPE-19 cells;*p<0.05,**p<0.01
2.3 PEDF-34对APRE-19细胞辐射损伤的作用
PEDF中保守的丝氨酸蛋白酶抑制蛋白结构域中包括10 个α 螺旋和3 个β 折叠,PEDF-34 是PEDF上从第44 位天冬氨酸(Aspartic acid,D)到第77 位的天冬氨酰(Asparagine,N)的含34 个氨基酸的多肽,覆盖了1 个α 螺旋。图3(a)用红色显示了其在PEDF 蛋白结构中的位置和氨基酸序列。PEDF-34可通过滴眼直接进入眼球后方,在视网膜处达到足够的浓度,无需损伤性玻璃体注射,无需特殊溶剂载带,具有神经保护和抗血管生成作用[12-13]。图3(b)显示10 pmol/L PEDF-34预处理2 h的细胞活力显著高于单纯照射组,说明PEDF-34预处理对X射线引起的ARPE-19细胞损伤具有一定的保护作用。
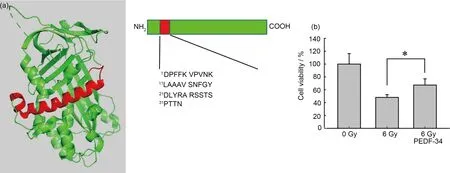
图3 PEDF-34对ARPE-19细胞辐射损伤的保护作用:(a)PEDF的蛋白结构及PEDF-34的氨基酸序列;(b)PEDF-34预处理后X射线照射引起的ARPE-19细胞活力变化;*p<0.05(彩色见网络版)Fig.3 Protective effects of PEDF-34 on ARPE-19 cells:(a)the protein structure of PEDF and the amino acid sequence of PEDF-34;(b)pretreatment of PEDF-34 altered the cell viability of ARPE-19 cells damaged by X-ray;*p<0.05(color online)
2.4 小鼠视网膜辐射损伤模型的构建与组织学观察
为了研究PEDF-34 在体内对视网膜辐射损伤的作用,采用小动物放射治疗模拟定位机对C57BL/6J 小鼠眼部设置左右照射野,分别照射10 Gy。图4(a)显示了两个照射野在矢状面、水平面、冠状面CT图像上的投影,可见两眼均在照射野范围内。照射后每天用含2 nmol/L PEDF-34的生理盐水滴眼处理4 周,继续饲养4 周后取眼球进行HE 染色;图4(b)显示20 Gy处理组的RPE细胞层增厚和结构异常与感光层的分界略有不清,内核层与外核层结构略有异常,而PEDF-34 处理组保持了正常的视网膜结构,提示PEDF-34对X射线诱导的视网膜损伤具有一定的保护作用。
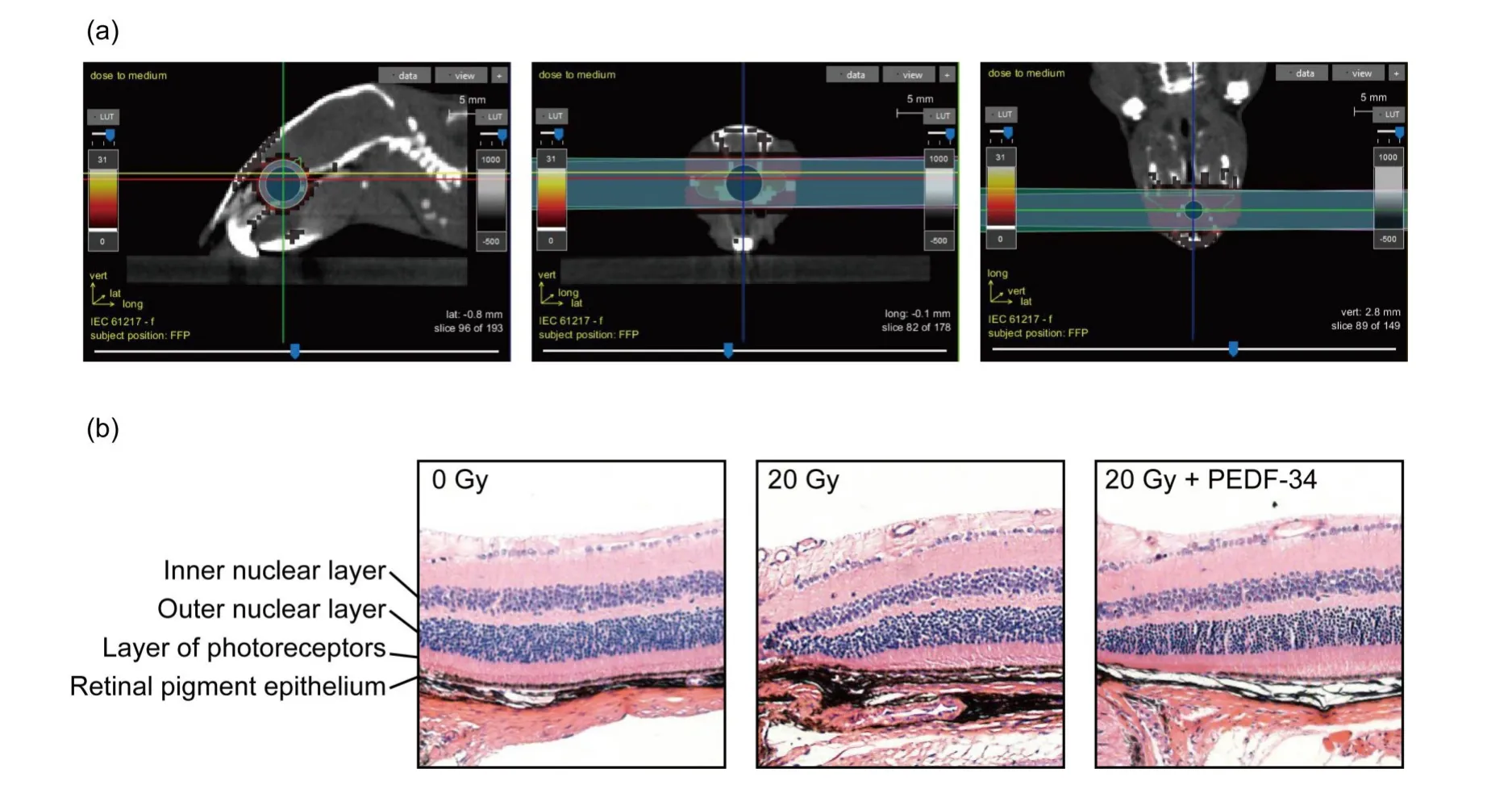
图4 PEDF-34滴眼处理对小鼠视网膜辐射损伤模型的作用:(a)左右照射野在矢状面、水平面、冠状面的投影;(b)小鼠视网膜HE染色Fig.4 Effects of PEDF-34 eye drops on radiation-induced retinal injury in mouse model:(a)median sagittal section,transverse section,and coronal section of the left and right irradiation fields;(b)HE staining of the mouse retina
2.5 PEDF-34处理对视网膜细胞凋亡的作用
TUNEL 染色显示20 Gy 照射组的小鼠视网膜外核层中存在凋亡细胞,而在空白对照组与PEDF-34 处理组中未观察到凋亡细胞(图5)。外核层主要由感光细胞胞体组成的,说明20 Gy 照射可以诱导感光细胞发生凋亡,PEDF-34 处理可抑制感光细胞发生凋亡。
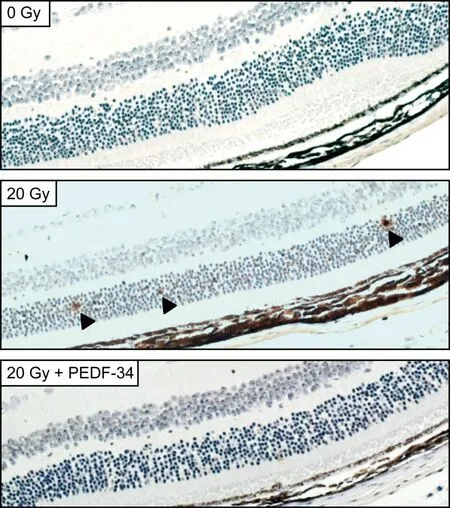
图5 TUNEL染色检测PEDF-34滴眼处理对小鼠视网膜细胞凋亡的作用Fig.5 Effects of PEDF-34 eye drops on retinal cell apoptosis detected by TUNEL staining
3 讨论
在眼部和头颈部肿瘤放射治疗中,如眼球正常组织受到过量电离辐射照射,会诱导氧化应激损伤、炎症反应、血管内皮损伤,从而导致视网膜细胞变性坏死、血供障碍,进而引发病理性血管生成,最终导致视觉障碍[14]。在视网膜中,PEDF主要由RPE细胞分泌,具有保护感光细胞、抗氧化、抗炎、抗血管生成作用,本研究在体内外实验中初步研究了PEDF 对视网膜辐射损伤的保护作用,在ARPE-19细胞中发现处理PEDF 受体抑制剂或降低PEDF 表达可加重X射线诱导的细胞损伤,在小鼠模型中发现眼部局部处理含PEDF-34 的生理盐水能缓解视网膜损伤,提示PEDF 及其多肽片段对于放射性视网膜病变具有一定的保护作用。
研究表明,PEDF 能维持RPE 细胞[6]、脉络膜内皮细胞[15]、神经节细胞[16]、感光细胞[17]等多种视网膜细胞的正常功能,外源性给予PEDF 可防治糖尿病视网膜病变[3]、光诱导的视网膜损伤[18]。本研究发现,PEDF 的功能缺失使体外培养的RPE 细胞更易受到辐射损伤,而给予PEDF-34 可提高辐射抵抗性。RPE 细胞具有吞噬光感受器外段、促进视网膜代谢、保持离子与电生理稳态的功能,对于保持视网膜正常功能和血-视网膜屏障完整性具有重要意义。在小鼠模型中,20 Gy X射线照射8周后,RPE细胞层出现了结构异常,可能使视网膜支持能力受损、血-视网膜屏障破坏,是电离辐射诱导小鼠视网膜损伤的病理基础。PEDF-34 滴眼是无损的眼部药物输送方法,可以使眼球后部达到有效的浓度[13],组织学观察发现,PEDF-34 滴眼可以减轻RPE 细胞层的病理改变,并减少视网膜感光细胞的凋亡。
目前对于PEDF保护RPE细胞对抗电离辐射的分子机制尚不明确,有研究证实,PEDF具有抗凋亡功能,可降低视网膜细胞损伤时多种凋亡相关基因的表达与活化[6]。在过氧化氢诱导的氧化应激中,PEDF 可 激 活ERK1/2 与PI3K/Akt 通 路、抑 制p38/MAPK 信号、维持线粒体功能,从而降低活性氧对细胞的损伤[19]。此外,PEDF还可抑制视网膜病变过程中肿瘤坏死因子α、转化生长因子β与单核细胞趋化蛋白等炎症因子的表达,减轻炎症反应[20]。PEDF与其多肽片段的视网膜辐射损伤保护能力可能与其抗凋亡、抗氧化、抗炎的功能有关。有研究表明,氧化应激损伤引起RPE细胞的死亡方式较为复杂,坏死与铁死亡可能都参与了RPE 细胞的损伤过程[21-22],这两种死亡方式是否参与PEDF对RPE细胞的防护作用需要进一步的研究明确。
4 结论
PEDF 受体抑制剂处理或降低PEDF 表达可增强X 射线对APRE-19 细胞的损伤作用,给予PEDF-34 多肽片段对X 射线引起的ARPE-19 细胞损伤具有保护作用。小鼠实验表明,20 Gy X射线照射后视网膜色素上皮细胞层出现结构异常,外核层含有凋亡细胞,PEDF-34 多肽片段滴眼处理组能够保持视网膜的正常结构且无凋亡细胞。本实验结果揭示了PEDF 对X 射线诱导RPE 细胞损伤的保护作用,证实了PEDF-34 多肽片段对视网膜X 射线损伤有一定的防治功能,为研发治疗放射性视网膜病变的方法提供了新的思路。PEDF 其他活性多肽片段是否也具有同样的效果及其内在分子机制仍需进一步的验证与研究。
作者贡献说明 朱冉是本研究工作的主要执行者,负责体外细胞实验与小鼠模型实验,并完成论文初稿写作;丁伯洋协助体外细胞实验,负责细胞活力的测定;李文艳负责蛋白与多肽的结构分析;李婕负责组织学实验;刘芬菊参与实验设计与论文撰写;陈新建指导小鼠视网膜损伤模型的构建与鉴定;俞家华负责实验设计,结果分析,论文撰写与修改。全体作者均已阅读并同意最终的文本。
