水的pH值盲样检测方法及影响因素浅析
2022-08-27柳玉连甘鑫钰
岳 曼,柳玉连,程 润,甘鑫钰
(中山公用水务投资有限公司,广东 中山 528403)
pH值定义是水相溶液中氢离子活度的负对数值,pH值可以通过比色法、指示剂滴定法和电极法来测定,前者测量精度不高,滴定法较繁琐,准确定量时一般用电极法测定。目前市场上购买的多为复合电极,进一步简化实验流程,减少实验结果影响因素,水的颜色、浊度、胶体物质、氧化剂及还原剂均不干扰测定。pH作为水质评价的重要指标,其检测的准确性是水质检测化验室考核的重要内容,但pH测定无法应用留样复测、加标回收等质控手段,而对pH计准确度的依赖性强,整个检测过程看似简单,实则需注重的细节较多。例如pH计的校准方法、样品的测定方式和时间等均会对检测结果产生影响,本文根据复合电极pH值测定结果的影响因素来分别进行验证。
1 实验器材及试剂
PHS-3C pH计(无自动温度补偿功能),雷磁;E-201-C型电极(新、旧各一支,旧电极使用时间为6个月),雷磁;温度计;Direct-Pure UP超纯水机,乐枫;JB-2磁力搅拌器,雷磁。
实验用水:市场购买屈臣氏纯净水;实验室超纯水机制超纯水。
标准缓冲溶液Ⅰ:pH=4.00(25 ℃):取邻苯二甲酸氢钾(雷磁袋装pH缓冲剂),将袋中试剂全部倒入烧杯中,并用实验用水润洗试剂袋2~3次并将液体一并倒入容量瓶定容至 250 mL;标准缓冲溶液Ⅱ:pH=6.86(25 ℃):取混合磷酸盐(雷磁袋装pH缓冲剂),按照标准缓冲溶液Ⅰ的配制方法完全溶于实验用水并定容至250 mL;标准缓冲溶液Ⅲ:pH=9.18(25 ℃):取硼砂(雷磁袋装pH缓冲剂),按照标准缓冲溶液Ⅰ的配制方法完全溶于实验用水并定容至250 mL,在聚乙烯瓶中密封保存。
质控样:生态环境部标准样品研究所GSB 07-3159-2014,QC1:批次202191,稀释10倍后浓度为4.11±0.06;QC2:批次202193,稀释10倍后浓度为9.06±0.08。
盲样:根据作业指导书用实验用水稀释10倍后得到S1,S2。
2 实验步骤和结果
2.1 实验用水的选择
一般pH测定缓冲溶液需要用无CO2的纯水,但超纯水的生产及煮沸冷却等过程均难以避免会有CO2溶于水中,从而改变水的pH值,有文章说明25 ℃时,电导率小于2 μs/cm的水即可用于实验[1],本文用新制备的超纯水煮沸10 min后加盖冷却,临用现配,新制备的超纯水,购买的屈臣氏纯净水作对比,探讨不同的实验室用水对实验结果的影响,从而选择一种或多种可以用于pH检测的实验用水。具体操作方法为:分别配制标准缓冲溶液Ⅰ和标准缓冲溶液Ⅱ,用配制的缓冲溶液校准pH计后,再分别测定用Ⅰ、Ⅱ和配制的缓冲溶液的值。三种纯水的电导率结果见表1。

表1 三种纯水电导率
校准流程为将几种校准溶液至于同一个环境下,使温度均接近室温后,用温度计测量并记录溶液的温度,将酸度计的温度补偿旋钮调至该温度上,将电极上端的硅胶软塞拔出,使电极内外的气压平衡[2],待内部气泡消失后,将电极前端玻璃球完全浸入标准缓冲溶液Ⅱ,缓慢水平搅拌,防止产生气泡引入二氧化碳,读数稳定后调节pH显示值与标准缓冲溶液一致;蒸馏水冲洗电极并用滤纸边缘吸去电极表面水分,用吸管吸取待测溶液润洗玻璃电极,再用相同方法校准仪器pH显示值至标准缓冲溶液的浓度Ⅰ;再分别测定标准缓冲溶液Ⅰ和Ⅱ的值,仪器示值与标准缓冲溶液的差值应≤0.05个pH单位[3],否则需要重复校准,直至合格。碱性校准和上述方法一致,对应的校准溶液为标准缓冲溶液Ⅱ和Ⅲ。校准后回测各缓冲溶液的结果见表2。

表2 不同实验室用水对pH值的影响
从表2的结果中可以看出,三种水配制的缓冲溶液测定值与实际值相差均小于0.05,说明本实验室超纯水机现制超纯水和屈臣氏纯净水均可以直接用来测定pH值用。
2.2 pH计的校准
2.2.1 校准点的影响
(1)HJ 1147-2020《水质 pH值的测定 电极法》规定两种标准缓冲溶液pH值相差约3个pH单位,样品pH值尽量在两种标准缓冲溶液pH值范围之间,且越接近被测pH值越好;若超出范围,样品pH值至少与其中一个标准缓冲溶液pH值之差不超过2个pH单位。但PHS-3C说明书中规定的二点标定法选取的标准缓冲溶液示例为:4.00pH和9.18pH[4],无中性点,且两个pH值相差远大于3,为验证校准点的选择对检测结果的影响,本实验用标准缓冲溶液Ⅰ和标准缓冲溶液Ⅲ反复校准pH计,然后回测标准缓冲溶液Ⅱ,以及QC1和QC2,测定结果见表3。

表3 两点校准检测结果
从表3结果可看出,用标准缓冲溶液Ⅰ和标准缓冲溶液Ⅲ校准pH计,与三点校准结果类似,满足测定标准缓冲溶液范围内的样品的要求。
(2)旧电极对校准的影响:为还原日常实际检测情况,本实验换回使用半年的旧电极重复2.3.1(1)中的实验[5],结果见表4。

表4 旧电极两点校准检测结果
从表4结果可看出用标准缓冲溶液Ⅰ和Ⅲ校准仪器后,测定标准缓冲溶液Ⅱ,结果超出误差允许范围,但QC1和QC2的测定值均在不确定度允许范围内,本实验认为QC1和QC2分别在标准缓冲溶液Ⅰ和Ⅲ的值附近,此次校准可看做是单点校正,而在4.00 pH、6.86 pH、9.18 pH范围内的线性并非一条直线,对于旧电极来说,若只校准4.00 pH和9.18 pH,最终会影响实验结果的准确性,因此说明书中只用标准缓冲溶液Ⅰ和Ⅲ校准pH计的方法不可行,各实验室需根据自身仪器的实际情况进行选择。
2.2.2 校准频次的影响
电极在测量前必须用已知pH值的标准缓冲溶液进行校准,关于校准频率说法不一,每天要校准一次或48小时校准一次,或每三个月校准一次[6],验证实验如下:用同一台pH计,分别用新、旧电极校准,校准pH计后关机,24 h后开机分别测定三个标准缓冲溶液,结果见表5。

表5 新、旧电极校准24 h后测定标准缓冲溶液的结果
由表5结果可看出,新电极校准24小时后开机测定几个标准缓冲溶液的值都在误差允许范围内,旧电极的测定值则全部超出误差允许范围,由此可见pH计的校准周期与电极状态有关,实验室需根据自身情况选择。
2.2.3 温度的影响
校准溶液温度为22 ℃[1,7],模仿日常检测可能样品温度与校正溶液不一致的情况,将几个不同的样品放于冰箱冷藏后,在其恢复至室温的过程中进行测定,结果见表6,可看出当样品低于标准缓冲溶液温度≤4 ℃时,检测结果均在误差允许范围内,但不同pH值的样品受温度影响不同,对于实验室检测时仍然建议待测样品和标准缓冲溶液温度接近时再检测。

表6 温度对检测结果的影响
2.2.4 搅拌方式的影响
实验过程中若引入气泡可能会使空气中的CO2溶于样品中使pH测定值偏小,本实验分别用手动轻轻搅拌和搅拌子搅拌的方式测定2.1中的三种缓冲溶液pH值的方法来验证操作方式对实验结果的影响,搅拌子转速调为中间速度,检测结果见表7。

表7 不同搅拌方式对实验结果的影响
由表7结果可看出,正常测定时间内搅拌子搅拌时长和手动搅拌对检测结果的影响无异。
2.3 实际盲样考核验证
用pH试纸粗测S1和S2的pH范围,分别在4~5和7~8之间,因此本实验选用标准缓冲溶液Ⅱ和Ⅰ校准后测样品S1,标准缓冲溶液Ⅱ和Ⅲ校准后测样品S2。
2.3.1 S1的测定
用标准缓冲溶液Ⅰ和Ⅱ校准pH计后,将电极浸入稀释后的QC1中,缓慢水平搅拌,待读数稳定在1分钟变化小于0.05个pH单位即读数,结果在不确定度范围内,即认为pH计在此值附近的测量较准确;用纯水清洗电极并用滤纸擦干后用S1润洗并测定,稳定后读数;
2.3.2 S2的测定
用标准缓冲溶液Ⅱ和Ⅲ校准pH计,用2.4.1(1)同样的方法测定QC2和S2,读数见表8。
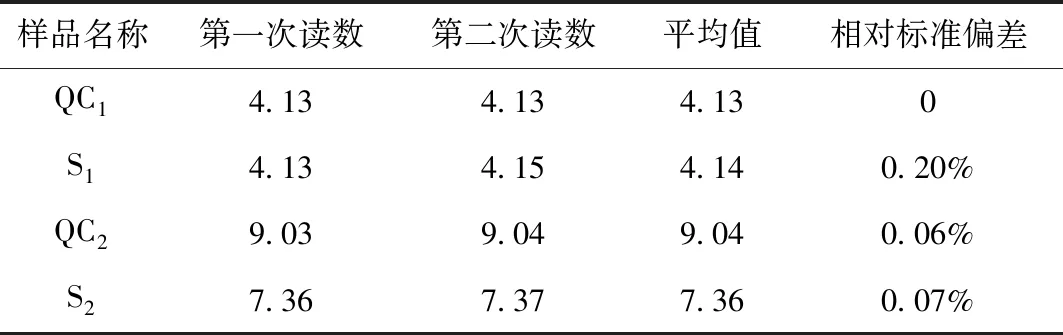
表8 pH校准后测定样品的结果
由表8结果可看出,两个质控样的结果均在不确定度范围内,且各样品的相对偏差均<1%,说明仪器的精度和准确度均满足实验要求,最终盲样考核得到满意的结果。
3 结 论
(1)与超纯水煮沸10 min后加盖冷却,且现用现配对比,本实验室自制超纯水和市场购买屈臣氏纯净水也可用来直接测定pH值用;
(2)随着电极使用时间的增长,电极的响应时间等的变化,pH计的校准周期也需随之缩短,实验室要根据自身实验情况确定仪器的校准周期;
(3)标准方法和仪器说明书中关于校准点的选择规定有不同,新电极可以选择用标准缓冲溶液Ⅰ和Ⅲ来校准仪器,旧电极则需要缩短各缓冲溶液之间的pH差值,且越接近待测样品最好;
(4)温度对pH值的测定结果有影响,最好将样品放于室温与标准缓冲溶液校准温度一致时检测;
(5)检测过程中选择用磁力搅拌器搅拌样品不会因引入CO2对实验结果造成影响。
