SHH/Twist1对低氧诱导肺动脉高压中内皮间质转化过程的作用机制研究
2022-08-27刘蕾马德宾史亮孙文武
刘蕾 马德宾 史亮 孙文武
肺动脉高压(pulmonary arterial hypertension,PAH)是以肺动脉平均压渐进性升高为特征,导致患者右心衰竭及死亡的慢性疾病[1-2]。内皮功能障碍是PAH血管重塑的根源,尚无有效药物可以逆转广泛血管重构及随后引起的肺血管阻力(pulmonary vascular resistance,PVR)升高[3]。内皮-间质转化(endothelial-mesenchymal transition,EndMT)导致肺动脉增厚,对PAH中的肺动脉重塑起了很大作用,但其具体机制仍然有待进一步探讨[4-5]。研究发现缺氧环境肺动脉内皮细胞中存在Sonic Hedgehog(SHH)通路水平上调[6],而其主要效应因子glioma-associated oncogene-1(Gli1)能够促进Twist-related protein 1(Twist1)的表达,后者转录激活是促进内皮向间充质转化的关键因子[7]。因此,本课题计划利用低氧诱导的肺动脉内皮细胞模型探讨SHH/Gli是否通过调控Twist1水平影响EndMT过程,为PAH临床治疗探索新的靶点和思路。
资料与方法
一、 材料
内皮细胞专用培养基购自中乔新舟(中国),Cyclopamine购自源叶生物(中国),脂质体3000购自invitrogen(美国),结晶紫购自Amresco(美国),Transwell小室购自Corning(美国),BeyoRT II M-MLV反转录酶购自碧云天(上海),TRIpure购自BioTek(北京),2×Taq PCR MasterMix购自Solarbio(北京),Twist siRNA及对照由金拓思(武汉)合成,兔抗SHH抗体购自abclonal(中国),兔抗Gli1抗体购自Affinity(中国),兔抗Twist1抗体、兔抗 β-actin抗体及羊抗兔IgG-HRP购自万类生物(中国),引物委托金斯瑞(南京)合成,其他试剂为国产分析纯。
二、 大鼠肺动脉内皮细胞原代分离培养
200~300 g雄性SD大鼠麻醉后取出心肺组织,显微镜下剥离各级肺动脉及周围结缔组织,将肺动脉剪开,在含PBS的10 cm的培养皿中,反复清洗血管内的血液,用无菌刀片将组织片切成1~2 mm2大小的动脉片,移入直径为35 mm的培养皿中,以其内膜面贴于培养皿,置细胞培养箱干涸2 h后,加入3 mL专用培养基于37℃,5%CO2的培养箱内培养。72 h后细胞可达一定密度,将动脉片去除,换液一次。每2 d换液一次,每次按照新鲜培养基1 ∶1进行换液,继续培养7 d,细胞融合成单层。密度达到90%,用胰蛋白酶消化,进行传代培养。
三、 细胞处理及分组
将分离得到的大鼠肺动脉内皮细胞胰酶消化计数后重新接种细胞培养板,随机分为正常对照组、模型组、模型+SHH抑制剂组、模型+siNC、模型+Twist siRNA组;待细胞融合超过50%后,模型组细胞按照实验分组,分别加入干预药物或转染试剂,其中模型+SHH抑制剂组细胞,更换含有5 μM Cyclopamine的培养基,模型+siNC及模型+Twist siRNA组分别将siNC/Twist siRNA与脂质体混合后逐滴加入各细胞培养孔中,瞬时转染细胞,37℃、5%CO2培养过夜后,将细胞置于3% O2条件下培养3~7 d,建立PAH诱导干预模型,正常对照组细胞保持正常培养条件,显微镜下观察细胞形态学变化。
四、 CCK8检测细胞增殖能力
细胞接种于96孔培养板中,每孔细胞量为3×103个,每组设计5个复孔,按照实验分组进行细胞处理后,分别培养24 h、48 h、72 h,每孔加入10μl CCK-8,37 ℃,5%CO2的培养箱内培养2 h,在酶标仪上测定其在450 nm处OD值,进行数据分析。
五、 Transwell细胞迁移实验
将Transwell小室放入24孔板中,下室加入含10% FBS的培养液800 μl;胰酶消化各组细胞,取细胞悬液200 μl加入Transwell上室,细胞数均为3×104个/孔,置于37 ℃、5%CO2、饱和湿度条件下的细胞培养箱中培养24 h,PBS清洗2次,4%多聚甲醛室温下固定20 min,0.5%结晶紫染液染色5 min后清洗,在倒置显微镜下(200×)对迁移至微孔膜下层的细胞计数,每个样本选取5个视野计数细胞个数,取均数。
六、 实时荧光定量PCR检测mRNA表达
收集各组细胞样品,分别加入1 mL TRIpure 裂解液,Trizol法提取总RNA,检测浓度并调整使之均一化,参照反转录酶操作说明进行反应合成cDNA,以β-actin为内参基因,扩增VE-cadherin、Vimentin基因,2-△△ CT方法分析检测结果。引物信息如下,VE-cadherin引物序列:上游5′-CGACGCTTCTACCACTTC-3′,下游5′-TGTTCCCTTGTTTGGTTATT-3′,扩增产物为160 bp;Vimentin引物序列:上游5′-CGCCAGATGCGTGAAATG-3′,下游5′-GAGGAAGTGACTCCAGGTTAG-3′,扩增产物为274 bp;β-actin引物序列:上游5′-GGAGATTACTGCCCTGGCTCCTAGC-3′,下游5′-GGCCGGACTCATCGTACTCCTGCTT-3′,扩增产物为155 bp。
七、 Western blot检测蛋白表达
收集各组细胞样本,参照试剂盒说明裂解抽提蛋白,BCA法测定蛋白浓度并调平后,取20 μl蛋白样本进行SDS-PAGE电泳,转移至PVDF膜,洗膜后加入一抗(Twist1 1 ∶500,SHH 1 ∶400,Gli1 1 ∶1000)4℃孵育过夜,TBST缓冲液重复洗膜4次,加入HRP标记的二抗于37℃孵育45 min(1 ∶5000稀释),TBST再次洗膜6次,加入ECL发光液静止反应约5 min,暗室中曝光,以β-actin为内参,进行图像采集及灰度分析,分别对Twist1、SHH、Gli1抗体表达进行半定量分析。
八、 统计分析
结 果
一、 各组细胞形态学观察
经低氧条件培养7 d后,对照组细胞多呈鹅卵石镶嵌状排列,多角形或梭形,大小均匀,相互融合;模型组细胞呈梭形生长,细胞间界限分明,细胞增殖较快; SHH抑制剂处理组及Twist1 沉默组,细胞形态及数量介于前两组之间(见图1)。

图1 光镜下观察低氧处理7d后各组细胞形态变化(×100镜下观察)
二、 各组细胞增殖能力变化
CCK8结果显示(见图2),与对照组比较,24 h后模型组细胞增殖能力有所升高,但无显著差异,48 h及72 h时间点显著升高(P<0.05);与模型组比较,48 h及72 h时间点SHH抑制剂处理组及Twist1 沉默组细胞增殖能力显著下调(P<0.05)。
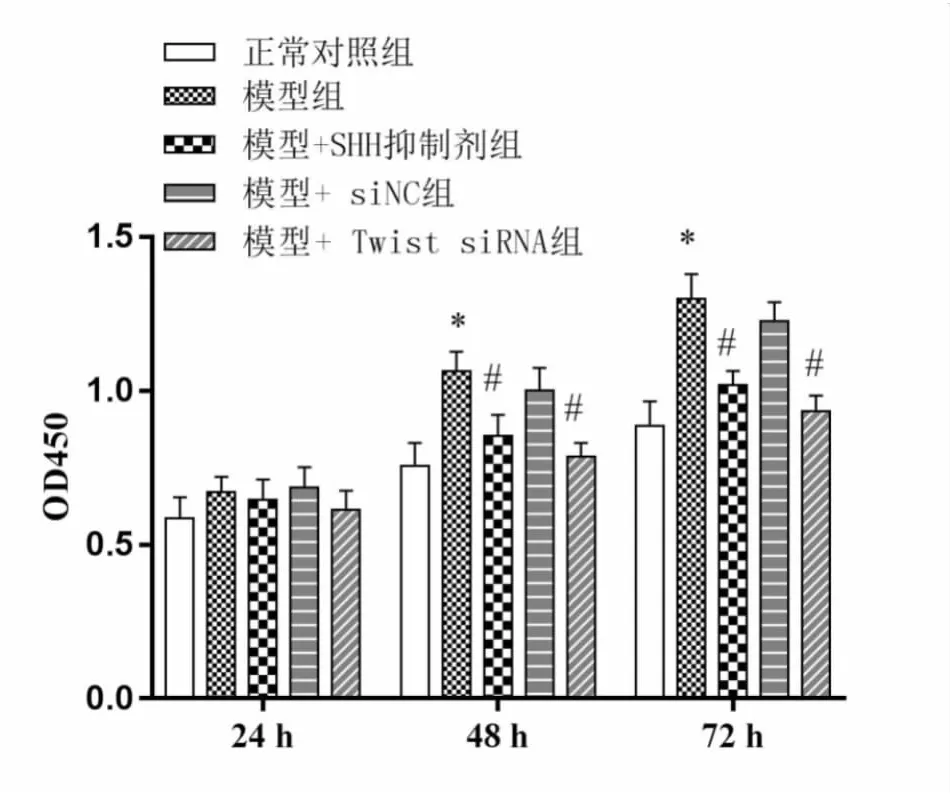
图2 CCK8检测细胞增殖情况(*P<0.05,vs正常对照组;#P<0.05,vs模型组)
三、 各组细胞迁移能力变化
Transwell检测结果显示(见图3),与对照组比较,模型组细胞迁移能力显著增强(P<0.05),与模型组比较,SHH抑制剂处理组及Twist1 沉默组细胞迁移能力有所降低(P<0.05)。
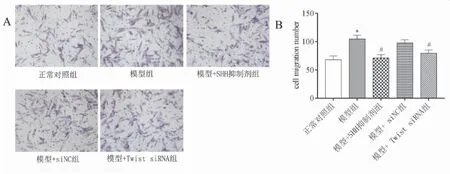
图3 Transwell检测细胞迁移能力变化(A:结晶紫染色,×200镜下观察;B:各组细胞迁移个数比较,*P<0.05,vs正常对照组;#P<0.05,vs模型组)
四、各组细胞VE-cadherin及Vimentin mRNA表达情况
实时定量PCR结果显示(见图4),与对照组比较,模型组中VE-cadherin表达显著降低,Vimentin水平显著上调(P<0.05);与模型组比较,SHH抑制剂处理组及Twist1 沉默组VE-cadherin指标表达均显著上调,Vimentin水平显著降低(P<0.05)。
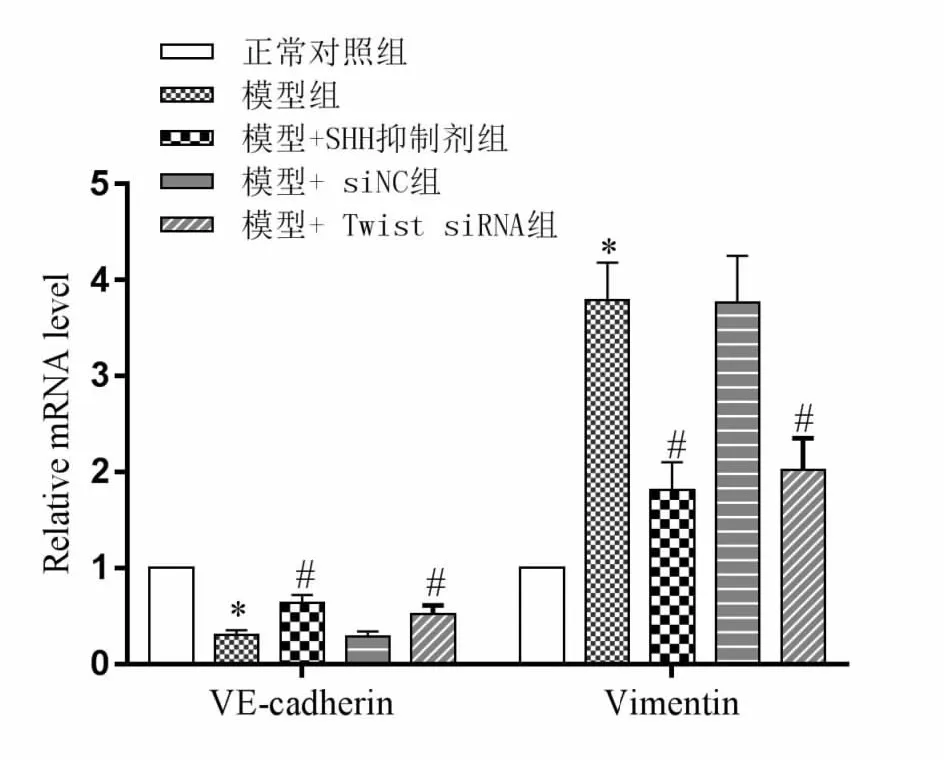
图4 实时定量PCR检测VE-cadherin及Vimentin mRNA表达情况
五、 各组细胞SHH、Gil1以及Twist1蛋白表达情况
Westernblot检测结果显示(见图5),与对照组比较,模型组中SHH、Gil1以及Twist1蛋白水平均显著上调(P<0.05);与模型组比较,SHH抑制剂处理组及Twist1 沉默组中SHH、Gil1及Twist1水平明显降低(P<0.05)。
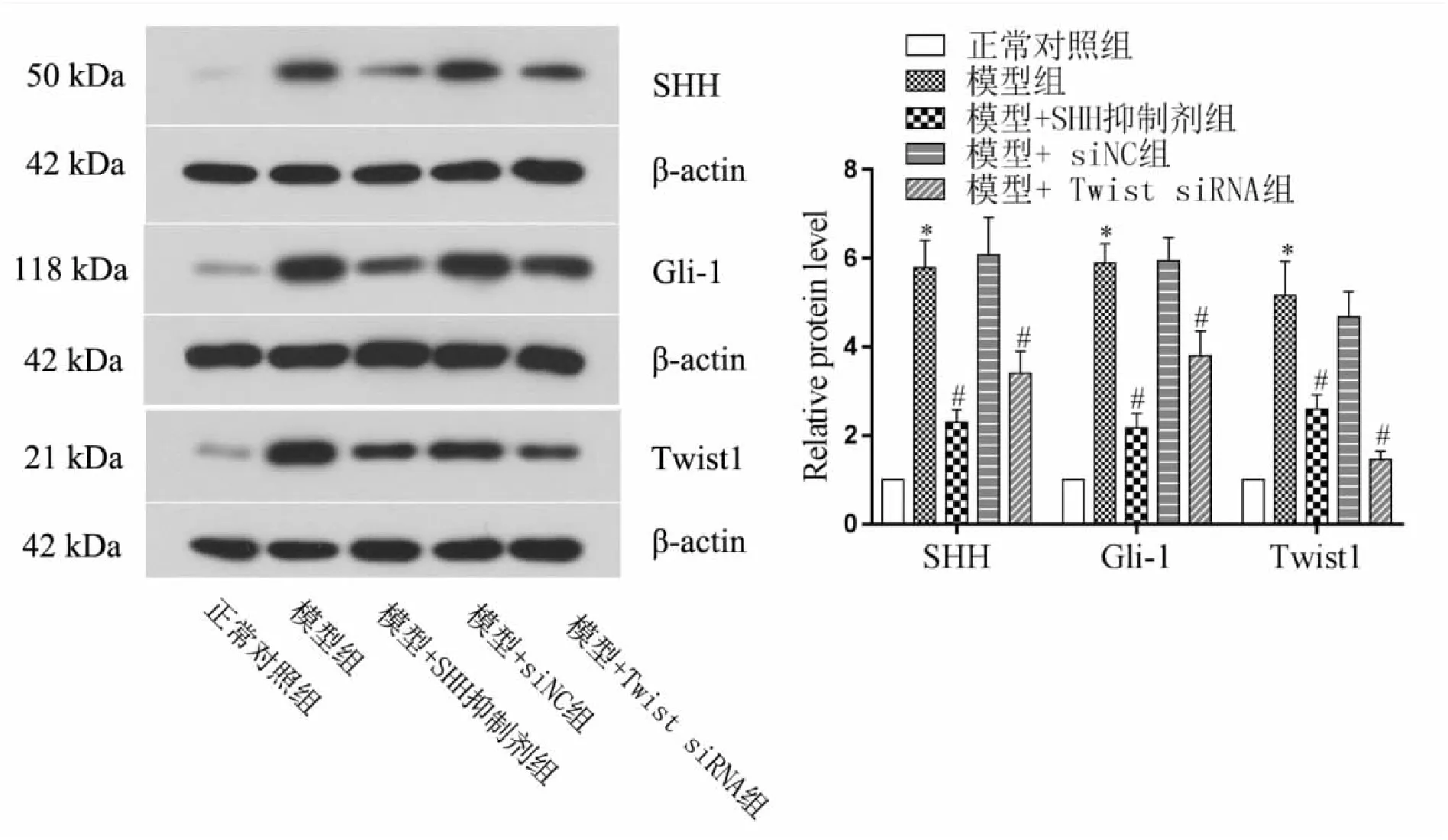
图5 Westernblot检测SHH、Gil1以及Twist1蛋白水平变化情况(*P<0.05,vs正常对照组;#P<0.05,vs模型组)
讨 论
肺动脉高压(PAH)的是一种肺小动脉原发性病变,特征在于肺动脉的一系列结构变化,如内膜增生、中膜肥厚、外膜纤维化等[8]。最近多项研究表明,内皮间质转化(EndMT)在PAH患者和动物模型中均有发生[5, 9]。EndMT指在缺氧、炎症等刺激因素持续影响下,内皮细胞向间质细胞转变的过程,EndMT过程中,内皮细胞失去极性及细胞间接触,并经历细胞骨架重塑,是内皮功能障碍的一个复杂事件,被认为是上皮-间充质转变(epithelial-mesen-chymal transition,EMT)的一种特殊形式,与肺动脉高压的发生和进展密切相关[3]。Hh信号通路在胚胎发育中起关键作用,研究发现,Hh通路能够通过非配体依赖途径,调控缺氧诱导的肿瘤细胞 EMT 及侵袭过程。Gli-1是Hh信号传导的主要效应因子,可降低E-cadherin的水平,增加Vimentin的水平,这提示Hh信号对于EMT的发生非常重要[10]。SHH是Hedgehog的同源基因,研究发现,在PAH患者肺组织中存在SHH表达上调[6]。越来越多的研究表明SHH信号通路通过调节EMT变化在肿瘤细胞中发挥影响作用,Perez等也指出EndMT与EMT过程共享许多分子调控机制[11-12]。在本研究中,我们通过体外实验,首次验证了SHH/Gli通路在缺氧诱导PAH的EndMT中的重要影响,SHH/Gli1上调,通过调控Twist1水平介导肺动脉内皮细胞EndMT过程,抑制SHH活性或干扰Twist1均能抑制内皮细胞向间质转化,可能对缓解PAH进展中内皮功能障碍具有一定的调控作用。
为了建立PAH细胞模型,我们分离培养了大鼠原代肺动脉内皮细胞,并给予低氧环境诱导。CCK-8及Transwell检测结果显示与正常细胞比较,缺氧诱导后肺动脉内皮细胞增殖、迁移能力显著增加;细胞形态观察也显示,缺氧诱导环境下内皮细胞形态向间质表型转化。PAH中的EndMT细胞具有显著增殖活性,是炎症应激与内皮功能障碍之间复杂相互作用的关键环节[13]。EndMT在肺动脉重构中起着关键作用,在此过程中内皮细胞获得间充质样细胞的迁移能力,并入侵到肺动脉中膜[14]。也有研究指出SHH在氧化应激反应中发生上调,并与细胞增殖和动脉重塑有关[15-17]。而本研究中发现,经SHH抑制剂或Twist1 干扰处理后,模型组细胞增殖能力、迁移显著降低(P<0.05),且细胞形态变化发生逆转。上述结果提示,在缺氧诱导的细胞PAH中存在SHH通路和Twist1的激活,并可能与EndMT过程转变有关。
EndMT发展过程中内皮细胞失去内皮细胞表型及表面标记,而获得间充质或平滑肌细胞表型,内皮细胞在形态上发生变化,内皮细胞基因和蛋白水平变化主要表现在原有的内皮标记物(VE-cadherin,CD31)减少,由VE-cadherin介导的细胞粘附丧失,间充质标记物(Vimentin)的表达水平增加,转录因子Twist1表达增加[5]。本研究中的实验结果也验证了这些表型的变化,实时荧光定量PCR检测结果显示,与对照组比较,模型组细胞内皮细胞标志VE-cadherin表达显著降低,间充质细胞标记Vimentin水平显著上调(P<0.05)。EndMT受到多种信号通路调控,我们的目标着重关注SHH/Gil1信号通路在缺氧诱导的PAH中发挥的作用。蛋白水平检测结果提示低氧诱导能够显著上调肺动脉内皮细胞中SHH、Gil1以及Twist1的表达水平(P<0.05)。SHH抑制剂作用及Twist1 沉默干预处理后,Western blot检测结果验证了模型组细胞中SHH/Gil1通路受到抑制以及Twist1蛋白水平下调,此外抑制Twist1表达后SHH/Gil1也受到抑制,提示Twist1可能对SHH通路存在反馈调节。与模型组比较,SHH抑制剂及Twist1 沉默干预后模型组细胞中VE-cadherin指标基因表达水平显著上调,Vimentin水平显著降低(P<0.05);上述结果提示,抑制SHH通路可能通过影响Twist1水平调节低氧环境下肺动脉内皮细胞的EndMT转化。
综上所述,缺氧环境诱导SHH/Gli通路激活促进肺动脉内皮细胞增殖,加速细胞内皮向间质转化,促进PAH病理进展,这可能与该通路介导Twist1水平升高有关,抑制SHH通路活性可以改善PAH过程中EndMT转化进程,从而缓解缺氧性肺动脉高压。目前,已开发的防治策略难以根治PAH,主要原因是PAH发生机制尚未明晰。本文为肺血管ECs异常增殖及间充质转化在PAH进展中具体调节机制研究提供了新的视角及实验证据,有助于为PAH临床治疗探索有效的干预措施及靶点,提供理论依据及实验支持。
