碱化椰壳活性炭对水中氨氮的吸附性能研究
2022-08-26唐艳萍
曹 昊,唐 悦,唐艳萍,田 娟
(江苏师范大学地理测绘与城乡规划学院,221000,江苏,徐州)
0 引言
氨氮广泛存在于工业废水和生活污水中,是水体富营养化的主要因子。当氨氮排入水体时,易引起水中藻类及其他微生物大量繁殖,水中溶解氧降低,导致水体富营养化。通常采取活性污泥法、吸附法、空气吹脱法等处理废水中的氨氮。活性炭作为吸附剂,吸附性能好且性价比高,多用于废水处理中。由于活性炭的氨氮去除率有限,因此需要经过一定的改性处理。活性炭的改性方法主要有表面氧化改性、表面还原改性、负载金属改性和酸碱改性等[1-3],改性处理后可改变活性炭表面以及微孔结构,提高其表面官能团数量,提高氨氮的吸附率。
本文以椰壳(颗粒)活性炭为研究对象,分别经过不同浓度的氢氧化钠溶液改性,分析改性后活性炭的表征特性以及孔隙结构,同时研究温度条件对活性炭吸附效果的影响,并对其进行动力学分析,从而为吸附法去除废水中的氨氮提供理论依据。
1 材料与方法
1.1 实验试剂、仪器与分析方法
试剂:椰壳(颗粒)活性炭;氢氧化钠、氯化铵、四水合酒石酸钾钠、碘化钾、碘化汞、氢氧化钠,均为分析纯。
仪器:UV-1800紫外-可见分光光度计;HZQ-F1000振荡箱;Micromeritics3020型比表面积及孔径分布测定仪。
分析方法:根据《水质 氨氮的测定 纳氏试剂分光光度法》(HJ 535—2009)进行氨氮测定。
1.2 碱性改性活性炭的制备
所选活性炭均为椰子壳活性炭,外观呈黑色,颗粒状。取2个250 mL锥形瓶各加入15 g 椰壳(颗粒)活性炭,再分别加入浓度为1 mol/L的氢氧化钠溶液和2 mol/L的氢氧化钠溶液,固液比为1:10,室温条件下浸泡 24 h ,过滤后的活性炭用蒸馏水洗涤,直至pH值呈中性,最后在105 ℃的恒温干燥箱中干燥数小时备用。
1.3 活性炭比表面积和孔隙结构测定
利用Micromeritics3020型比表面积及孔径分布测定仪对未改性活性炭和不同浓度氢氧化钠改性的活性炭进行比表面积、孔隙度测试,得到测定活性炭的比表面积(BET法)、总孔容、微孔体积、吸附平均孔径(BJH法)、解析平均孔径(BJH法)及平均孔径等孔隙特征。
1.4 氨氮的吸附
1.4.1 温度的影响
1)等温吸附实验。依次称取5 g改性活性炭置于11个250 mL锥形瓶中,分别加入0 mg/L、30 mg/L 、40 mg/L、50 mg/L、60 mg/L、80 mg/L、100 mg/L、130 mg/L、150 mg/L、180 mg/L、200 mg/L 的NH4Cl溶液50 mL。在15 ℃、25 ℃和35 ℃的恒温振荡箱中振荡24 h,过滤。取10 mL滤液,用纳氏试剂分光光度法测定氨氮浓度。利用Langmuir和Freundlich等温吸附模型线对吸附实验进行拟合。
2)吸附模型。Langmuir等温吸附模型:
(1)
式中:qm为活性炭最大吸附量,KL为Langmuir模型吸附平衡常数,ρ0、ρe为吸附质的初始浓度和平衡浓度。
Freundlich等温吸附模型:
qe=KFρe1/n
(2)
式中:KF为Freundlich模型吸附平衡常数,n为用来表示吸附强度的模型参数。
1.4.2 吸附动力学 在11个250 mL锥形瓶中分别加入5 g改性活性炭,加入50 mL浓度为20 mg/L的氯化铵溶液,放入温度为25 ℃的恒温振荡箱,振速为180 r/min,分别在0.5 h、1 h、1.5 h、2 h、2.5 h、3 h、4 h、5 h、6 h、10 h和24 h时取出锥形瓶,过滤,用纳氏试剂分光光度法测定滤液中的氨氮浓度。用准一级动力学模型、准二级动力学模型以及颗粒内扩散模型对实验进行拟合。
准一级动力学方程表示为:
Qt=Qe[1-eK1Pt]
(3)
准二级动力学方程表示为:
(4)
颗粒内扩散议程表示为:
Qt=K3Pt1/2+c
(5)
式中:Qt为t时刻的吸附量(mg/g);t为吸附时间(min);Qe为平衡时刻的吸附量(mg/g);K1P为准一级动力学方程的吸附速率常数(min-1);K2P为准二级动力学方程的吸附速率常数(g/mg·min);K3P为颗粒内扩散速率常数(mg/g·min1/2);c为经验常数,与边界层厚度相关,c值越大边界层效应越大。
2 结果与分析
2.1 活性炭的表征与分析
由表1可以看出,经过1 mol/L氢氧化钠改性的活性炭,比表面积最大,为646.039 8 m2/g,微孔体积和吸附平均孔径最小,分别为0.241 9 m3/g、1.807 3 nm。
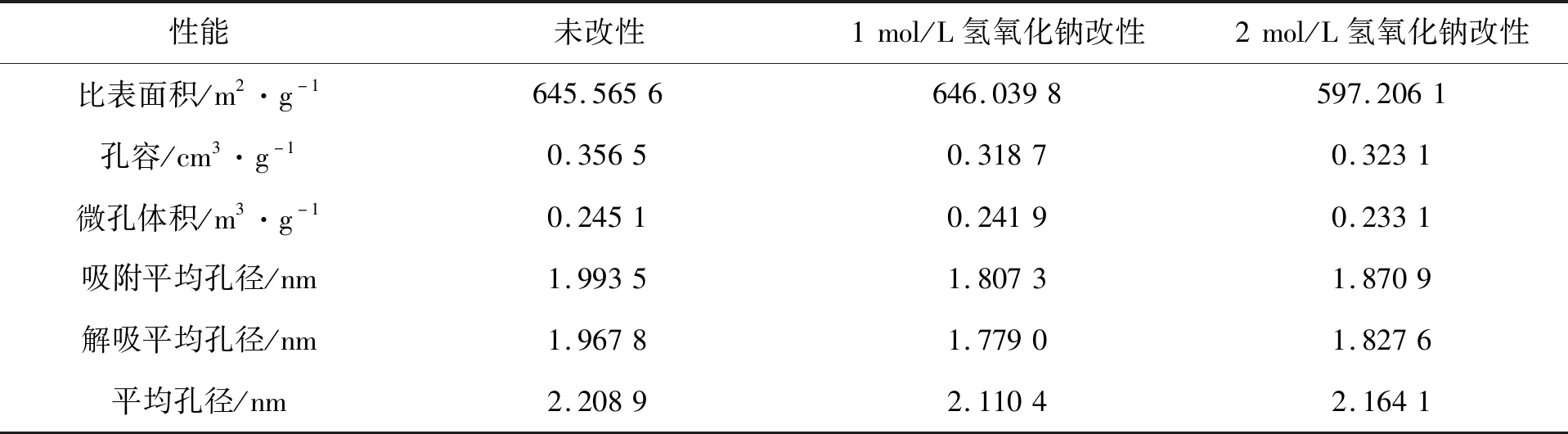
表1 活性炭的表征分析
未改性活性炭与2 mol/L 氢氧化钠改性活性炭的比表面积均小于1 mol/L 氢氧化钠改性活性炭,根据王彤彤[4]研究表明活性炭的比表面积大小是影响其对吸附质去除效率的关键因素,活性炭比表面积越大,可提供更多的吸附点位,对氨氮的吸附性能越强,同时碱液的还原作用使含氧官能团数目显著降低,对于非极性的氨氮的吸附效果显著提升[5]。因此,选择1 mol/L 氢氧化钠改性活性炭进行氨氮吸附实验。
2.2 温度的影响
2.2.1 温度对吸附的影响 不同温度条件下,改性活性炭对氨氮的等温吸附曲线如图1所示。由图1可以看出,35 ℃时活性炭对氨氮的吸附量最大,最大吸附量为2.464 9 mg/g,25 ℃次之,为1.920 1 mg/g,15 ℃最小,为1.372 1 mg/g,表明温度的升高有利于活性炭对氨氮的吸附。这一结论与郜玉楠[6]的研究结果一致。这可能由于碱化改性活性炭吸附氨氮为吸热过程,随着温度升高,碱化改性活性炭能更有效地与氨氮进行离子交换,因此氨氮的去除效率提高。

图1 温度对活性炭吸附氨氮的影响
2.2.2 等温吸附 本文采用1 mol/L氢氧化钠改性的活性炭在15 ℃、25 ℃和35 ℃条件下,进行水中氨氮的吸附实验,等温吸附拟合的结果如表2所示。

表2 活性炭吸附氨氮等温模型拟合参数
从表2可以看出,不同温度下,Freundlich模型拟合得到的相关系数大于Langmuir模型,由此可知,可以用Freundlich等温吸附模型来拟合改性活性炭对氨氮吸附的实验研究。
另外,从Langmuir模型拟合的结果可以得到,35 ℃条件下,活性炭吸附量最大,最大吸附量qm为2.464 9 mg/g,吸附平衡常数KL值也最大,表示吸附能力最强。Freundlich模型的拟合中,35 ℃条件下,用来表征吸附强度的模型参数n值最大,表明吸附性能最好。实验表明,随着温度的增加,改性活性炭对氨氮的吸附效果越好。
2.3 吸附动力学分析
本文在活性炭吸附氨氮的实验研究中,分别采用准一级动力学模型、准二级动力学模型和颗粒内扩散模型3种模型,模拟25 ℃条件下浓度为1 mol/L的氢氧化钠改性活性炭吸附氨氮的动力学过程,拟合结果如图2所示。

图2 吸附动力学曲线
由图2可知,该活性炭对氨氮的吸附量随着时间的增加而增大,最大的吸附量为1.914 mg/g。6 h之前,吸附速率随着时间迅速增加,在第6小时达到最大,为0.546 7 g/mg·min,6 h后吸附速率下降,低于0.432 0 g/mg·min,之后逐渐减缓,在10 h之后趋于平缓。这一结论与姜侠[7]的研究结果相似。这是由于在实验初期,氨氮通过外部扩散很快被吸附在改性活性炭表面,随着时间的增加,氨氮在改性活性炭内部空隙中扩散,吸附速率随着氨氮的浓度增加而增加,实验的末期,吸附速率下降,改性活性炭吸附氨氮达到吸附饱和。
从表3可以得到,准二级动力学吸附模型与实验数据最为接近,拟合相关系数R2= 0.999 4,优于准一级动力学吸附及颗粒内扩散模型,这说明模型能够很好地拟合改性活性炭对氨氮的吸附过程。李子强[8]等研究改性活性炭吸附Cr(Ⅵ)的吸附过程同样符合准二级动力学方程,说明该吸附过程是发生在不均匀表面的化学吸附[9],且碱化活性炭对于水中氨氮的吸附为单分子层吸附[10]。

表3 吸附动力学各级参数
3 结论
1)经过1 mol/L 氢氧化钠改性的活性炭比表面积最大,为646.039 8 m2/g,对氨氮吸附实验效果最佳。
2)实验温度为35 ℃时,活性炭吸附速率以及饱和吸附量最大,最大吸附量为2.464 9 mg/g,升温有利于吸附的进行。
3)Freundlich等温吸附模型可以很好地拟合改性活性炭对氨氮的等温吸附过程,准二级动力学方程可以用来拟合活性炭对氨氮的吸附动力学过程。
4)改性活性炭吸附氨氮的动力学实验研究表明,6 h以前吸附速率随时间增大而增大,最大为0.546 7 g/(mg·min) ,后逐渐减缓,10 h后趋于平缓。
