杨桃根多糖醇沉工艺优化研究*
2022-08-26廖彭莹陈敏玉孙雪芹
廖彭莹,陈敏玉,孙雪芹
(广西中医药大学药学院,广西 南宁 530200)
杨桃根系酢浆草科植物杨桃(AverrhoacarambolaL.)的根,在我国主要分布于福建、台湾、云南、广西、广东等地[1],其味酸、涩,性平,具有祛风除湿、行气止痛、涩精止带的功效[2]。研究表明杨桃根具有多种药理活性,如杨桃根醇提取物对CCl4诱导的肝纤维化大鼠肝脏细胞具有保护作用[3],具有降低血压的作用[4],可以缓解氧化应激对肾组织造成的损伤,起到改善糖尿病小鼠肾损伤的作用[5],能够调节糖尿病小鼠的糖代谢酶活性,降低血糖,提高糖耐量和糖尿病小鼠肝脏的抗氧化能力[6]。
多糖类成分近年来备受关注,许多植物多糖已被证实具有多种生物活性,如香菇多糖自1968年提取出来就受到研究人员的持续关注,并已开发成多种相关产品[7],花椒叶多糖具有抗菌活性[8],芦笋皮多糖具有免疫调节活性[9]等。杨桃根多糖具有抗氧化、降糖降血脂活性[10-13],课题组在前期研究中采用单因素实验法和正交实验法优化了杨桃根多糖的热水提取工艺[10],但关于杨桃根多糖的醇沉工艺未见相关研究。多糖是极性物质,不溶于醇等有机溶剂,常采用水提醇沉工艺进行制备[11-12]。水提醇沉工艺简便易行,不需要额外设备,成本较低[14]。研究人员曾采用单因素实验法优化了荔枝核多糖、人参多糖和大蒜多糖的醇沉工艺,减少了有效成分损耗,多糖质量分数和产量均有所提高[14-16]。
本研究采用单因素结合响应面试验优化了杨桃根多糖的醇沉工艺,为杨桃根活性多糖的深入研究提供了科学依据。
1 材料与方法
1.1 材料与试剂
杨桃根于2018年3月采于广西南宁,经广西中医药大学朱意麟实验师鉴定为酢浆草科五敛子属植物杨桃(AverrhoacarambolaL.)的根部,粉碎过40目筛后备用;浓硫酸(98%)、盐酸、苯酚、D-(+)-葡萄糖,国药集团化学试剂有限公司;所有化学试剂均为分析纯;水为纯化水。
1.2 仪器与设备
BS2204S型电子分析天平,北京赛多利斯仪器系统有限公司;8453紫外可见分光光度计,美国安捷伦科技公司;SHB-III型循环水式多用真空泵,武汉亨泰达仪器设备有限公司;数显恒温水浴锅,金坛市医疗仪器厂;KQ-500DA型超声波清洗机昆山市超声仪器有限公司;EPED-E2-20TS型超纯水仪,南京易普达科技发展有限公司。
1.3 方 法
1.3.1 多糖提取与含量测定
称取杨桃根粗粉500 g,按优化工艺[10]进行提取,将所得药液浓缩至一定体积,于4 ℃下加入95%乙醇,静置一定时间后,抽滤,所得沉淀用乙醚、丙酮洗涤,减压干燥,得到多糖。精密称取多糖用超纯水溶解,配制成一定浓度溶液,按照文献[10]方法操作,测定吸光值,按下式计算溶液中多糖含量。采用苯酚-硫酸法测定样品溶液中多糖含量[10]。
多糖含量%=[(C × V ×D)/M]×100%
(1)
式中,C为样品溶液中多糖的浓度,mg/mL;V为样品溶液的体积,mL;D为稀释倍数;M为杨桃根多糖质量,mg。
1.3.2 醇沉工艺优化
准确称取500 g杨桃根粗粉,按“2.1”项下操作进行提取,将提取液分成若干等份,每份50 mL,考察醇沉浓度、醇沉时间和提取液浓度对多糖含量的影响,即设置醇沉浓度分别为40%、50%、60%、70%和80%,静置12 h;醇沉浓度为60%,设置醇沉时间分别为4、8、12、16和20 h;醇沉浓度为60%,醇沉时间为12 h,设置提取液浓度分别为5.00、3.33、2.50、2.00和1.67 g/mL。在单因素实验基础上,进一步采用采用Design Expert 8.0.6软件设计三因素三水平响应面试验,进行醇沉工艺优化,并进行验证实验。
2 结果与分析
2.1 单因素试验
单因素实验结果见图1所示。由图1(A)可知,醇沉浓度为40%~60%时,多糖含量与醇沉浓度呈正相关,在60%时含量最高,可达53.59%。肖琼等研究表明[17],醇沉过程中存在临界乙醇量值,当乙醇总量低于该值时,醇溶物的量与乙醇用量成正比,高于该值时,增加趋势减缓直至不再增加。综合考虑乙醇用量及多糖含量,选择60%乙醇为响应面试验醇沉浓度的中心点。
由图1(B)可知,醇沉时间为4~12 h时,多糖含量与醇沉时间呈正相关,在12 h时含量最高,可达36.58%,醇沉时间超过12 h,随着醇沉时间增加,含量呈下降趋势。可能的原因是随着醇沉时间增加,蛋白质、淀粉等大分子沉降颗粒之间互相作用、互相交联,形成更大颗粒,沉降速度加快[18]。随着醇沉时间增加,沉淀越多,但多糖含量减少,选择12 h作为响应面试验醇沉时间的中心点。
由图1(C)可知,提取液浓度在1.67~5.00 g/mL范围内,多糖含量与提取液浓度呈正相关,在2.50 g/mL时含量最高,可达30.49%,而提取液浓度超过2.50 g/mL后,随着提取液浓度增大,含量呈下降趋势。这可能是由于提取液浓度过高时,药液黏稠度增大,乙醇与药液难以充分接触,易溶于乙醇的大分子杂质易沉淀,导致沉淀中多糖含量减少[19],故选择2.50 g/mL作为响应面试验提取液浓度的中心点。
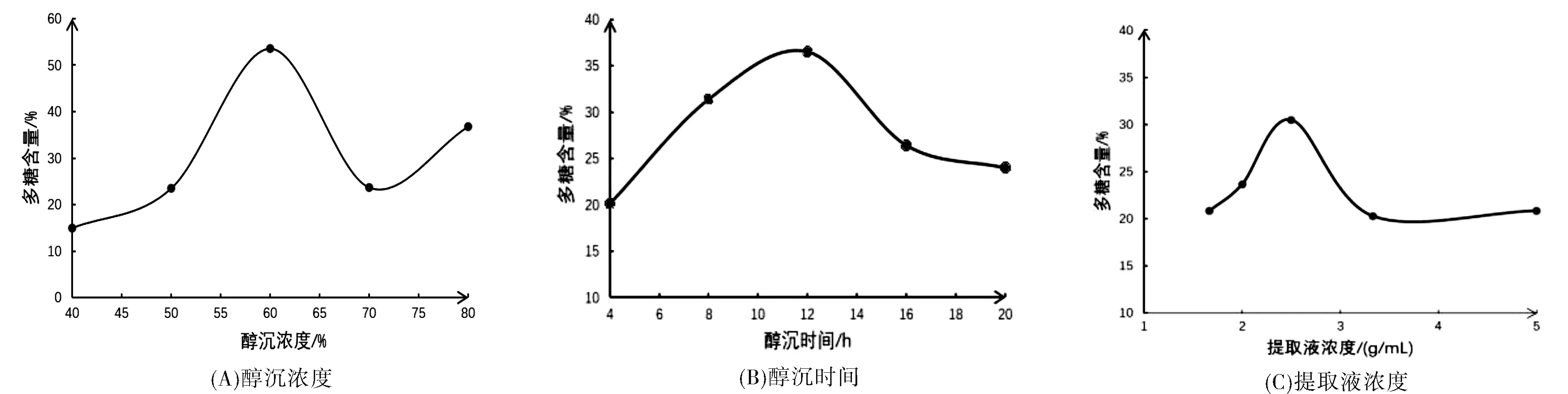
图1 单因素试验结果
2.2 响应面试验
根据单因素试验结果,以醇沉浓度(A)、醇沉时间(B)和提取液浓度(C)为因素,以多糖含量(Y)为响应值,采用Design Expert 8.0.6软件设计三因素三水平响应面试验,进行醇沉工艺优化。因素与水平见表1所示,试验方案与结果见表2所示。
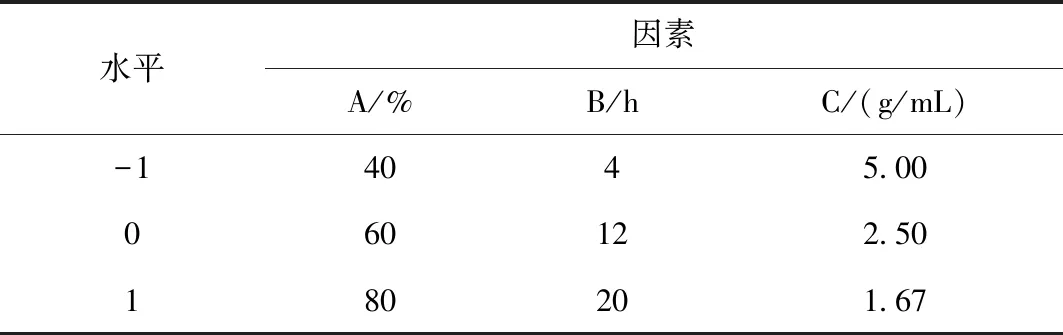
表1 响应面试验因素与水平表
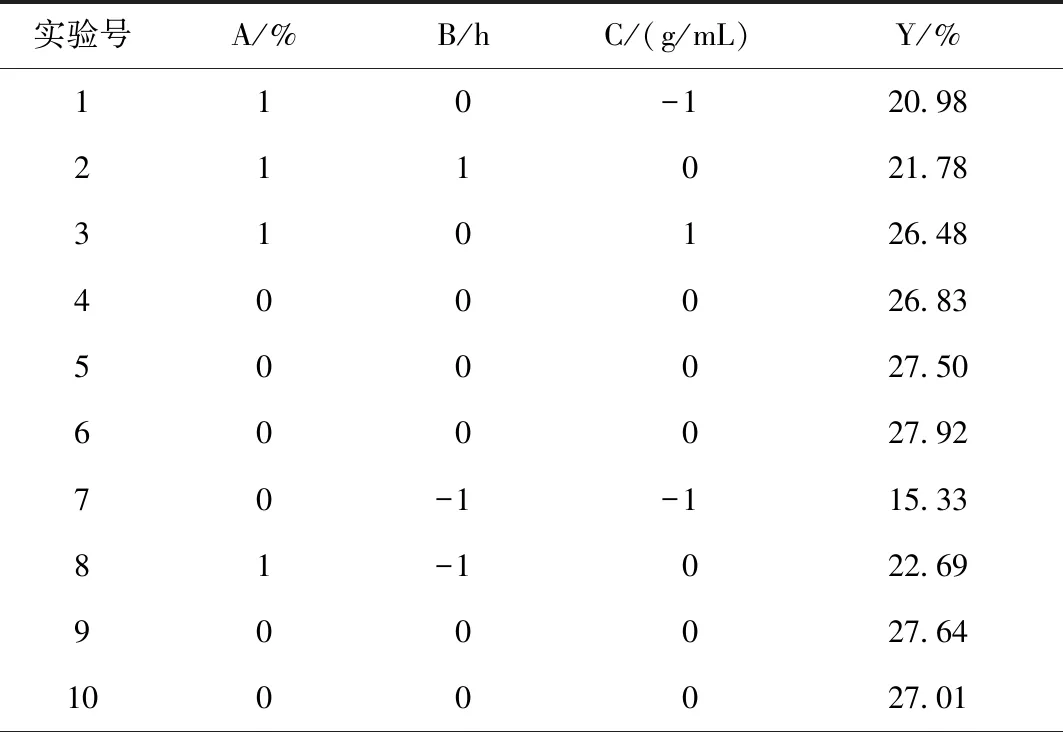
表2 响应面试验设计及其结果

续表2
对表2中的数据进行回归分析,得到二元多次回归方程:
Y=27.38+2.04A+0.68B+1.10C-1.00AB+1.97AC
-1.95BC-2.50A2-4.94B2-2.94C2
(2)
对其进行方差分析,结果见表3所示。
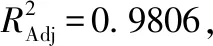
为进一步评价A、B、C之间的交互作用对多糖含量的影响并确定各因素的最佳水平范围,绘制了等高线图和响应面图,结果见图2所示。由图2可知,当醇沉浓度一定时,随着醇沉时间延长,多糖含量先增加后减小;当醇沉时间一定时,随着醇沉浓度增加,多糖含量呈先增加后减小趋势。响应曲面坡度相对较平,表明醇沉浓度和醇沉时间的交互作用对多糖含量的影响较弱。当醇沉浓度固定时,随着提取液浓度增大,多糖含量呈现先增加后减小的趋势;当提取液浓度固定时,随着醇沉浓度增加,多糖含量呈先增加后减小趋势。响应曲面坡度相对陡峭,表明醇沉浓度和提取液浓度的交互作用对多糖含量影响较大。当醇沉时间固定时,随着提取液浓度增加,多糖含量先增加后减小;当提取液浓度固定时,随着醇沉时间延长,多糖含量呈先增加后减小趋势。响应曲面坡度相对陡峭,表明醇沉时间和提取液浓度的交互作用对多糖含量的影响较大。根据试验模型得到醇沉工艺最优条件为:醇沉浓度68.95%,醇沉时间12.57 h,提取液浓度2.23 g/mL,预测多糖含量为28.06%。结合实际,将醇沉工艺优化为醇沉浓度69.00%,醇沉时间 13 h,提取液浓度为2.22 g/mL。
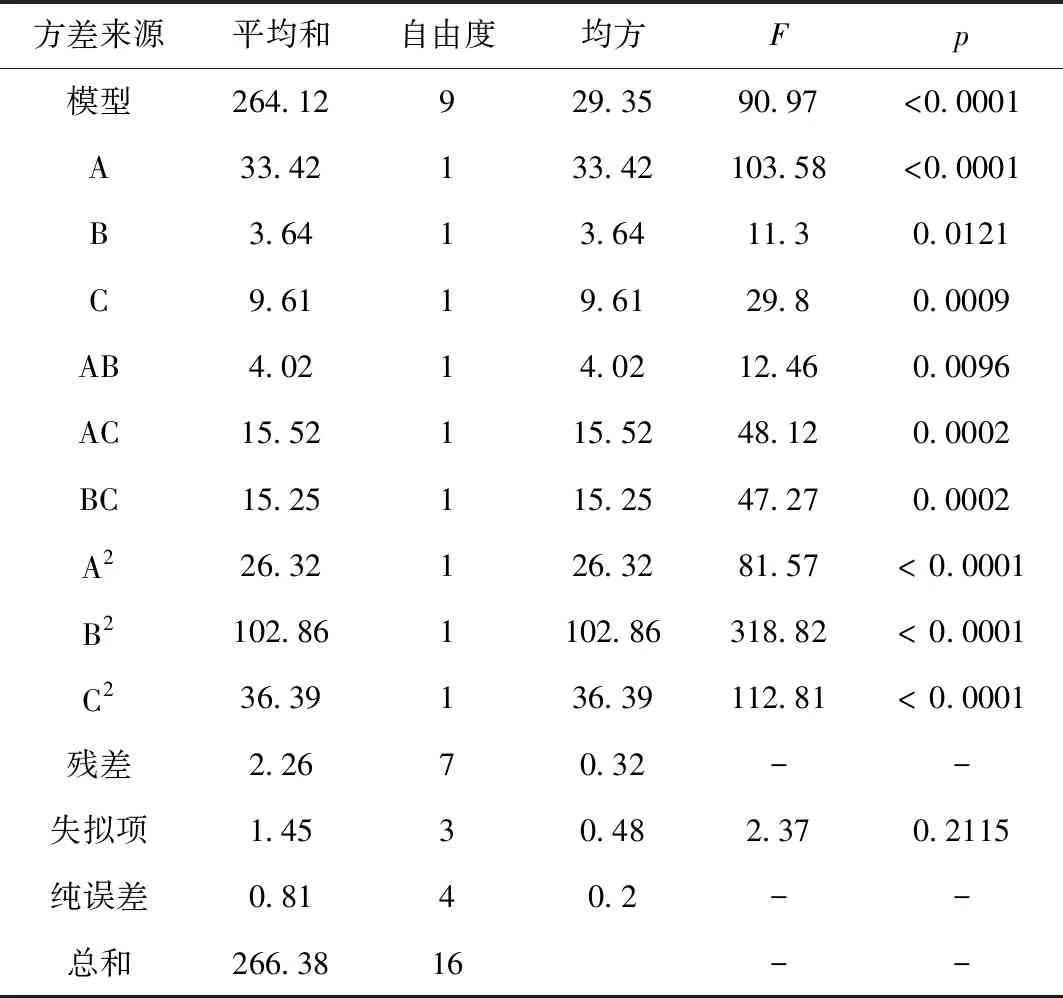
表3 方差分析结果
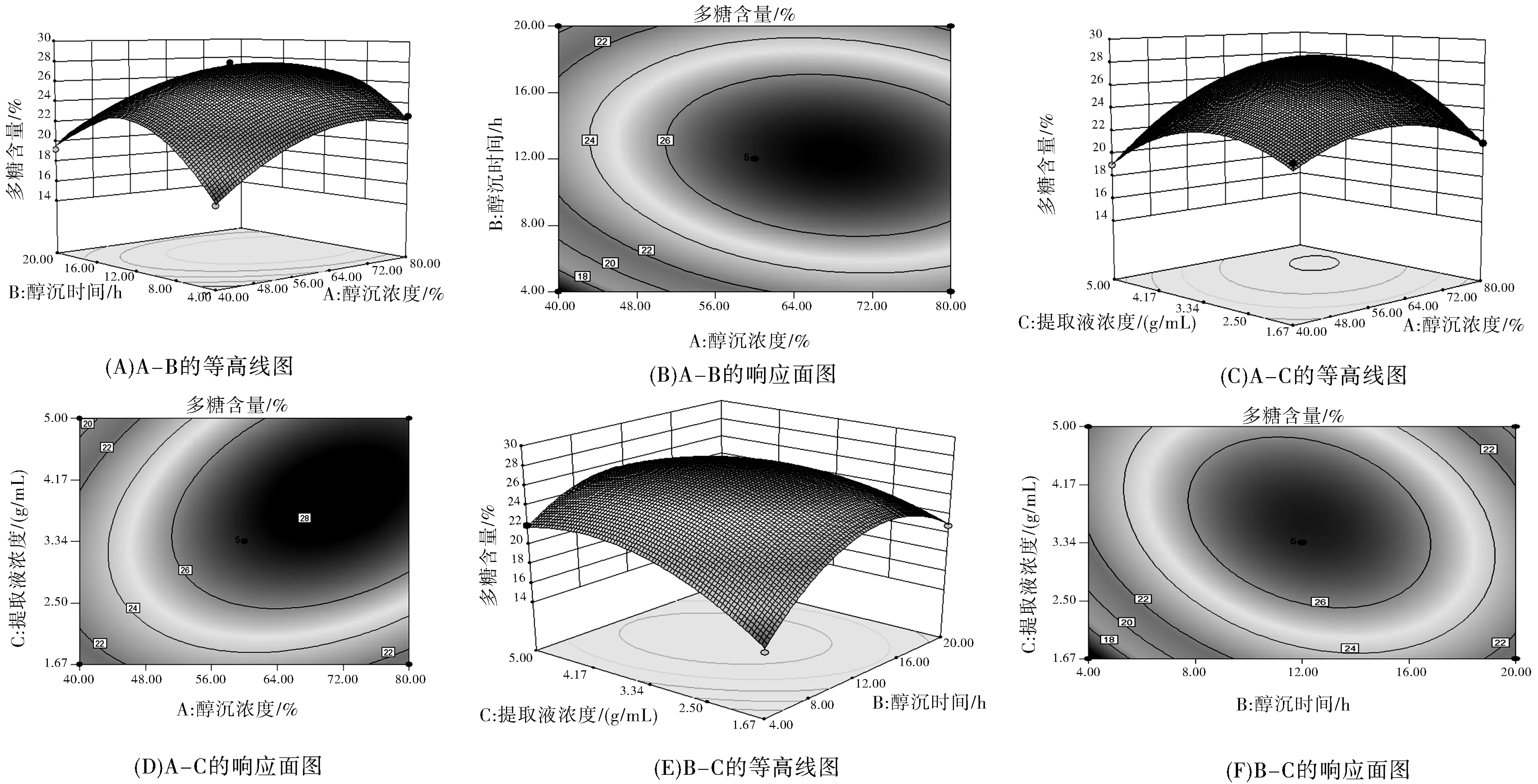
图2 各因素交互作用对多糖含量的效应曲面图和等高线
2.3 验证试验
根据优化醇沉工艺,进行3次平行验证试验,所得多糖含量分别为28.20%,27.85%和27.78%,平均值为27.94%(RSD=0.81%,n=3),与预测值28.06%相近,表明该模型预测性良好,优化工艺稳定可行。
3 结 论
植物多糖常用提取方法很多,本研究选择水提醇沉法,该法对仪器设备要求不高、操作简单,不需要对提取液进行加热,避免了对多糖结构的破坏,避免多糖裂解。本研究在单因素试验基础上利用响应面法优化了醇沉工艺,影响多糖含量的各因素排序为:醇沉浓度>提取液浓度>醇沉时间,优化醇沉工艺为醇沉浓度68.95%,醇沉时间12.57 h,提取液浓度为 2.23 g/mL,结合实际,调整为醇沉浓度69%,醇沉时间13 h,提取液浓度为2.22 g/mL。在此条件下所得杨桃根多糖含量为27.94%,与理论值28.06%接近,说明响应面法优化多糖醇沉工艺稳定可靠,可为其高效制备工艺开发提供研究依据。优化工艺常用方法有正交设计与响应面设计,其中响应面法采用非线性模型,得到的预测模型是连续的,而正交设计法是用线性数学模型进行设计,只对孤立的点进行实验分析,不能在整个区域上找到因素的最佳组合。故本论文采用响应面法进行了优化。
