厄贝沙坦联合5-氟尿嘧啶对Lewis肺癌细胞增殖及ERK/PPARγ信号通路的影响Δ
2022-08-26翟美娟季士亮江翊国白秀华南京医科大学附属苏州医院苏州市立医院药学部江苏苏州1500苏州科技城医院呼吸科江苏苏州15000
翟美娟,季士亮,江翊国,白秀华#(1.南京医科大学附属苏州医院/苏州市立医院药学部,江苏苏州 1500;.苏州科技城医院呼吸科,江苏苏州 15000)
肺癌是全球病死率最高的恶性肿瘤,其死亡人数占所有癌症死亡人数的18%[1]。5-氟尿嘧啶(5-fluoruracil,5-FU)是一种常用且经典的化疗药物,可通过抑制胸苷酸合成酶阻滞DNA合成,从而发挥抗肿瘤活性,临床常用于各种实体恶性肿瘤的治疗。然而,5-FU在使用中存在耐药性和中枢神经毒性等毒副作用,限制了其临床应用[2]。因此,寻找协同增效或削弱5-FU毒性的药物是目前研究的热点。
厄贝沙坦(irbesartan,Irb)是一种血管紧张素Ⅱ受体阻滞剂,具有抗氧化、抗炎、抗纤维化及抗肿瘤等特性,可通过调节机体内炎症因子的释放,发挥心脏保护作用[3]。已有研究表明,Irb与化疗药物表柔比星联用可削弱后者的毒性[4],亦可通过抑制胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)的磷酸化(即成为p-ERK1/2)来阻滞乳腺癌MCF-7细胞的增殖[5],还可通过激活过氧化物酶体增殖物激活受体γ(peroxisome proliferater activated receptor gamma,PPARγ)来诱导细胞自噬[6-7]。基于此,本研究考察了Irb联合5-FU对Lewis肺癌细胞增殖及ERK/PPARγ信号通路的影响,以期为临床肺癌治疗方案的优化提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器包括Miulab GIS-500型凝胶成像仪(杭州米欧仪器有限公司)、DMI 3000B型倒置显微镜(德国Leica公司)、BB150-2TCS型CO2细胞培养箱(美国Thermo Fisher Scientific公司)等。
1.2 主要药品与试剂
Irb(批号T1615,纯度99%)购自南京赛泓瑞生物科技有限公司;5-FU(货号V900394-1G,纯度98%)购自美国Sigma公司;蛋白酶抑制剂苯甲基磺酰氟(批号HY-B0796)购自美国Med Chem Express公司;MTT溶液(批号CS2905)购自北京博奥森生物技术有限公司;Giemsa液(批号G1010-500)购自北京索莱宝科技有限公司;通用型Bradford蛋白定量试剂盒(批号E211-01)购自南京诺唯赞生物科技股份有限公司;兔增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、肿瘤抑制蛋白 p53、ERK1/2、p-ERK1(T202)+p-ERK2(T185)、PPARγ、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体及辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(H&L)二抗(批号分 别 为 ab92552、ab32389、ab184699、ab201015、ab178860、ab181602、ab6721)均购自英国Abcam公司。
1.3 细胞
小鼠Lewis肺癌细胞购自美国ATCC生物标准品资源中心,货号AC-2654H。
2 方法
2.1 Irb对细胞增殖活力的影响考察
取对数生长期的Lewis肺癌细胞,用培养基稀释至1×105个/mL,吸取200 μL接种于96孔板中,用不同浓度(0、1×10-5、1×10-4、1×10-3、1×10-2、1×10-1mmol/L[5])的Irb处理细胞,孵育48 h后,每孔加入MTT溶液20 μL,避光孵育4 h后,去除培养基,再加入二甲基亚砜200 μL,用酶标仪在570 nm波长处检测光密度(optical density,OD),以OD值评价细胞增殖活力。
2.2 细胞分组与给药
取对数生长期的Lewis肺癌细胞,分为正常对照组、Irb低浓度组(1×10-3mmol/L,根据“2.1”项下实验结果设置)、Irb高浓度组(1×10-1mmol/L,根据“2.1”项下实验结果设置)、5-FU组(10 μmol/L[8])、Irb低浓度+5-FU组(Irb 1×10-3mmol/L+5-FU 10 μmol/L)和Irb高浓度+5-FU组(Irb 1×10-1mmol/L+5-FU 10 μmol/L),除正常对照组细胞正常培养外,其余5组细胞使用相应浓度的Irb或(和)5-FU培养24 h。
2.3 Irb联合5-FU对细胞增殖活力的影响考察
按“2.1”项下方法检测“2.2”项下各组细胞培养24 h后的细胞增殖活力。
2.4 Irb联合5-FU对细胞集落形成数的影响考察
取按“2.2”项下方法分组、给药处理18 h后的细胞,制备成单细胞悬液。取单细胞悬液1 mL(细胞密度200个/mL)铺于6 cm培养皿中,于37℃、5%CO2条件下培养1~2周,每天更换1次培养基,直至出现肉眼可见的细胞增殖时终止培养,除去培养基,使用磷酸盐缓冲液浸洗2~3次,干燥后加入甲醇固定15 min,去除甲醇,晾干后,使用Giemsa液染色10 min,洗去染料,干燥后在显微镜下拍照记录细胞集落形成数(按细胞数>50个、直径0.3~1.0 mm为1个集落)。实验重复3次。
2.5 Irb联合 5-FU 对细胞中 PCNA、p53、ERK1/2、p-ERK1/2、PPARγ蛋白表达的影响考察
采用Western blot法进行检测。取按“2.2”项下方法分组、给药处理24 h后的细胞,用预冷的磷酸盐缓冲液冲洗2~3次,加入含苯甲基磺酰氟的RIPA裂解液,在4℃下裂解30 min后以15 000×g离心20 min,分离上清液即为总蛋白,测定蛋白浓度,加上样缓冲液煮沸15 min变性,置于-20℃冰箱备用。每孔上样蛋白50 μg,使用聚丙烯酰胺凝胶电泳分离蛋白,转移到聚偏二氟乙烯膜上,用TBST缓冲液冲洗3次,加入5%牛血清白蛋白(用TBST缓冲液稀释)室温封闭2 h,加入PCNA、p53、ERK1/2、p-ERK1(T202)+p-ERK2(T185)、PPARγ和GAPDH一抗(稀释比例均为1∶500),低温孵育过夜;用TBST缓冲液冲洗3次,加入二抗(稀释比例为1∶5 000),室温孵育2 h,用TBST缓冲液冲洗3次,显影成像。使用Image J v1.8.0软件分析条带的灰度值,按下式计算目的蛋白的表达水平:目的蛋白表达水平=目的蛋白的灰度值/GAPDH蛋白的灰度值。实验重复3次。
2.6 统计学方法
3 结果
3.1 Irb对细胞增殖活力的影响
与0 mmol/L比较,Irb浓度为1×10-5、1×10-4mmol/L时细胞增殖活力无明显变化(P>0.05),Irb浓度为1×10-3、1×10-2、1×10-1mmol/L时细胞增殖活力显著降低(P<0.05)。后续试验选择1×10-1mmol/L为Irb高浓度(OD值为0.66±0.02),1×10-3mmol/L为Irb低浓度(OD值为0.78±0.05)。
3.2 Irb联合5-FU对细胞增殖活力和细胞集落形成数的影响
与正常对照组比较,其余5组细胞增殖活力和细胞集落形成数均显著降低/减少(P<0.05)。与Irb低、高浓度组比较,5-FU组、Irb低浓度+5-FU组和Irb高浓度+5-FU组细胞增殖活力和细胞集落形成数均显著降低/减少(P<0.05)。与5-FU组比较,Irb低浓度+5-FU组和Irb高浓度+5-FU组细胞增殖活力和细胞集落形成数均显著降低/减少(P<0.05)。结果见表1、图1。
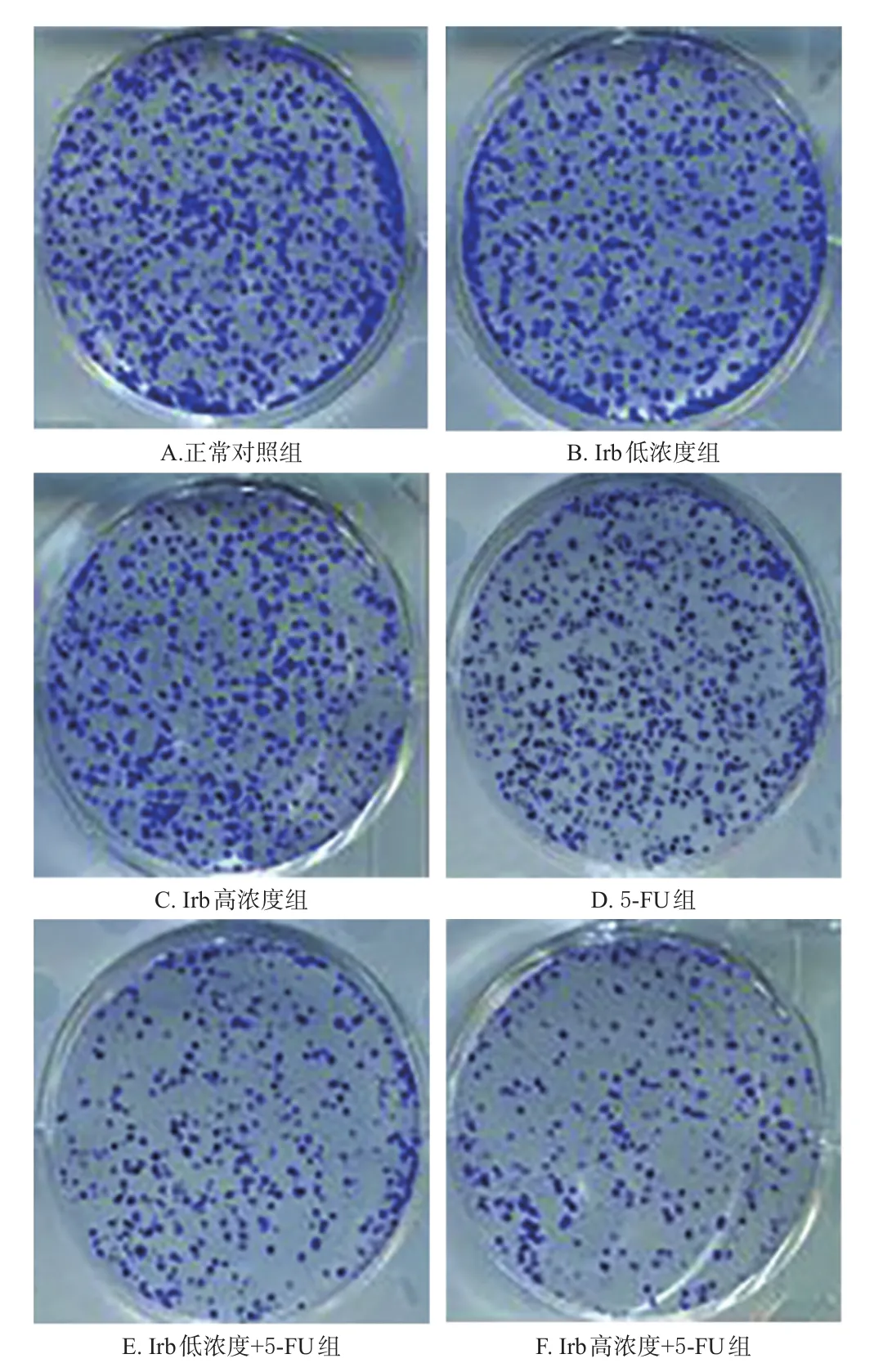
图1 Irb联合5-FU对细胞集落形成数的影响
表1 Irb联合5-FU对细胞增殖活力和细胞集落形成数的影响(±s,n=3)
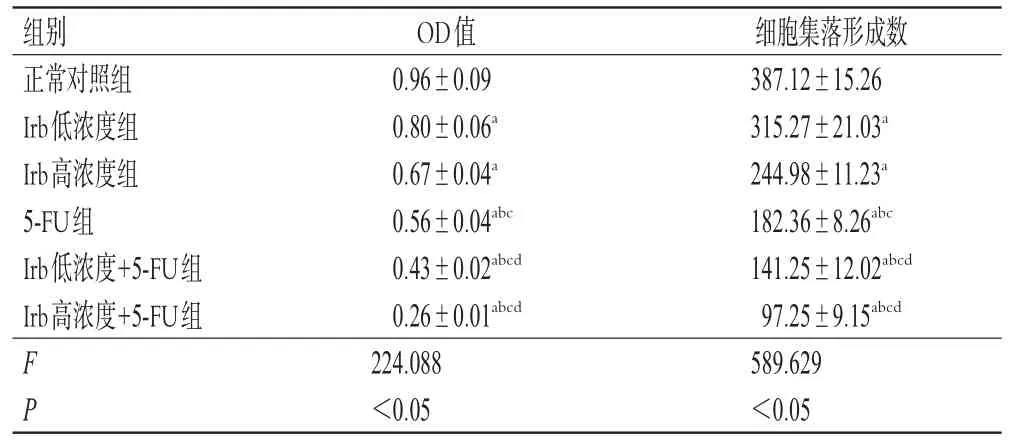
表1 Irb联合5-FU对细胞增殖活力和细胞集落形成数的影响(±s,n=3)
a:与正常对照组比较,P<0.05;b:与Irb低浓度组比较,P<0.05;c:与Irb高浓度组比较,P<0.05;d:与5-FU组比较,P<0.05
细胞集落形成数387.12±15.26 315.27±21.03a 244.98±11.23a 182.36±8.26abc 141.25±12.02abcd 97.25±9.15abcd 589.629<0.05组别正常对照组Irb低浓度组Irb高浓度组5-FU组Irb低浓度+5-FU组Irb高浓度+5-FU组F P OD值0.96±0.09 0.80±0.06a 0.67±0.04a 0.56±0.04abc 0.43±0.02abcd 0.26±0.01abcd 224.088<0.05
3.3 Irb联合 5-FU 对细胞中 PCNA、p53、ERK1/2、p-ERK1/2、PPARγ蛋白表达的影响
与正常对照组比较,其余5组细胞中PCNA、p-ERK1/2、PPARγ蛋白表达水平均显著降低,p53蛋白表达水平均显著升高(P<0.05)。与Irb低、高浓度组比较,5-FU组、Irb低浓度+5-FU组和Irb高浓度+5-FU组细胞中PCNA、p-ERK1/2、PPARγ蛋白表达水平均显著降低,p53蛋白表达水平均显著升高(P<0.05)。与5-FU组比较,Irb低浓度+5-FU组和Irb高浓度+5-FU组细胞中PCNA、p-ERK1/2、PPARγ蛋白表达水平均显著降低,p53蛋白表达水平均显著升高(P<0.05)。各组细胞中ERK1/2蛋白表达水平无明显差异(P>0.05)。结果见图2、表2。
表2 Irb联合 5-FU 对细胞中 PCNA、p53、ERK1/2、p-ERK1/2、PPARγ蛋白表达水平的影响(±s,n=3)
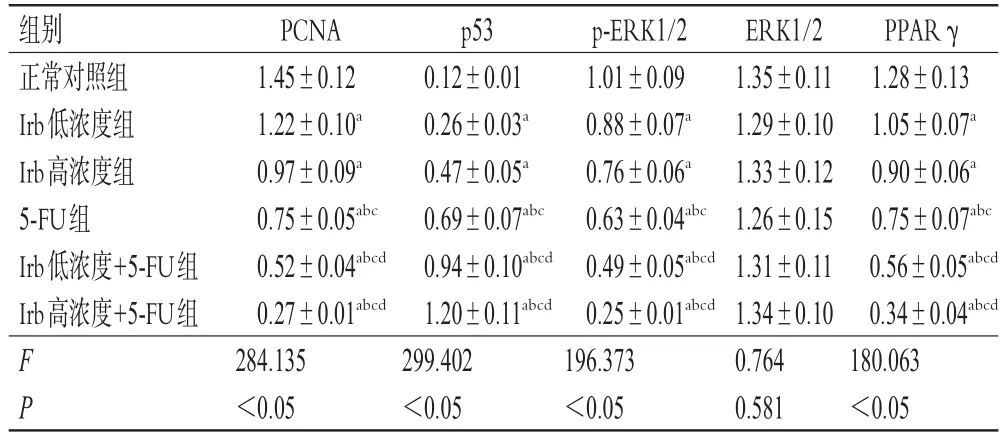
表2 Irb联合 5-FU 对细胞中 PCNA、p53、ERK1/2、p-ERK1/2、PPARγ蛋白表达水平的影响(±s,n=3)
a:与正常对照组比较,P<0.05;b:与Irb低浓度组比较,P<0.05;c:与Irb高浓度组比较,P<0.05;d:与5-FU组比较,P<0.05
PPARγ 1.28±0.13 1.05±0.07a 0.90±0.06a 0.75±0.07abc 0.56±0.05abcd 0.34±0.04abcd 180.063<0.05组别正常对照组Irb低浓度组Irb高浓度组5-FU组Irb低浓度+5-FU组Irb高浓度+5-FU组F P PCNA 1.45±0.12 1.22±0.10a 0.97±0.09a 0.75±0.05abc 0.52±0.04abcd 0.27±0.01abcd 284.135<0.05 p53 0.12±0.01 0.26±0.03a 0.47±0.05a 0.69±0.07abc 0.94±0.10abcd 1.20±0.11abcd 299.402<0.05 p-ERK1/2 1.01±0.09 0.88±0.07a 0.76±0.06a 0.63±0.04abc 0.49±0.05abcd 0.25±0.01abcd 196.373<0.05 ERK1/2 1.35±0.11 1.29±0.10 1.33±0.12 1.26±0.15 1.31±0.11 1.34±0.10 0.764 0.581

图2 各组细胞中 PCNA、p53、ERK1/2、p-ERK1/2、PPARγ蛋白表达的电泳图
4 讨论
PCNA是DNA合成过程中不可缺少的一种辅助蛋白,同时也是衡量肿瘤细胞增殖活性的标志物之一[9]。p53是一种肿瘤抑制蛋白,是研究最为广泛的一种抑癌因子。本研究结果显示,与正常对照组比较,Irb、5-FU单用及联用均可显著降低Lewis肺癌细胞增殖活力、减少细胞集落形成数、降低细胞中PCNA蛋白表达水平,显著提高p53蛋白表达水平;与Irb低、高浓度组比较,5-FU组、Irb低浓度+5-FU组及Irb高浓度+5-FU组Lewis肺癌细胞增殖活力、细胞集落形成数和细胞中PCNA蛋白表达水平均显著降低/减少,p53蛋白表达水平均显著升高;与5-FU组比较,Irb低浓度+5-FU组及Irb高浓度+5-FU组Lewis肺癌细胞增殖活力、细胞集落形成数和细胞中PCNA蛋白表达水平均显著降低/减少,p53蛋白表达水平均显著升高。上述结果说明,Irb和5-FU单用均可有效降低Lewis肺癌细胞增殖活力,二者联用对Lewis肺癌细胞增殖抑制作用更强。
ERK是丝裂原活化蛋白激酶家族中最重要的一员,其本身不具备活性,只有被磷酸化后形成p-ERK才具有活性,可调控细胞增殖、分化等多个生物学过程,并可参与调节炎症因子的产生和分泌[10]。PPARγ是核受体超家族的一部分,可参与调节细胞分化、增殖、免疫/炎症反应和脂质代谢的基因表达,同时在结肠癌、乳腺癌等多种恶性肿瘤细胞中均有表达[11]。本研究结果显示,与正常对照组比较,Irb、5-FU单用及联用均可显著降低Lewis肺癌细胞中p-ERK1/2、PPARγ蛋白表达水平;与Irb低、高浓度组比较,5-FU组、Irb低浓度+5-FU组及Irb高浓度+5-FU组Lewis肺癌细胞中p-ERK1/2、PPARγ蛋白表达水平均显著降低;与5-FU组比较,Irb低浓度+5-FU组及Irb高浓度+5-FU组Lewis肺癌细胞中p-ERK1/2、PPARγ蛋白表达水平均显著降低。上述结果说明,Irb和5-FU对Lewis肺癌细胞增殖活力的抑制作用可能与抑制ERK1/2磷酸化和PPARγ表达有关。
综上所述,Irb联合5-FU可抑制Lewis肺癌细胞增殖,且效果优于二者单用,其机制可能与下调ERK/PPARγ信号通路有关。
