保护性耕作对黑土不同土层土壤固氮菌丰度和群落结构的影响
2022-08-26李猛李海瑜高明
李猛,李海瑜,高明
(中国科学院 东北地理与农业生态研究所,海伦农田生态系统国家野外科学观测研究站,黑龙江 哈尔滨 150081)
0 引 言
黑土是我国农作物生产最重要的土壤资源之一,在保障国家粮食安全方面发挥着至关重要的作用[1]。然而,由于过度耕作,黑土已经严重退化,导致土壤侵蚀和有机质流失[2]。保护性耕作措施可以改善土壤结构,保持水土,增加土壤养分水平,提高作物水分利用率和增加作物产量,是防止土壤退化的一种有效方法,通常被视为未来可持续的耕作方式。因此,采取保护性耕作制度来维持东北地区的土壤生产力非常必要。
土壤氮素循环影响着土壤生态系统的生产力和可持续性。由于氮循环过程几乎都是依靠微生物介导的氧化还原反应完成的,因此土壤微生物在土壤氮循环中起着非常重要的作用[3]。其中,nifH基因是编码固氮酶的一个亚基,为研究固氮菌的分布和多样性提供了一个有用的途径。对土壤中nifH基因多样性的研究揭示了多种未知固氮菌的基因序列类型[4-7]。有数据表明,这些固氮菌在许多土壤系统中有着重要的作用,是主要的固氮微生物[8,11]。保护性耕作增加了土壤微生物丰度以及微生物多样性[12-14]。一些研究表明,保护性耕作增加了固氮菌群落的多样性,耕作方式和土壤深度的交互作用改变了其组成[12-18]。例如,Hsu和Buckley[15]研究表明,免耕制度下固氮菌对氮的固定效率的影响要强于土壤理化性质的改变;赵有翼等[19]认为免耕秸秆覆盖提高了氨化细菌、硝化细菌及自身固氮菌数量,且随着土层的加深,种植小麦土壤中的氨化细菌数量比免耕不覆盖处理增加。同时,土壤理化属性与土壤微生物活性密切相关[20-21]。Calderoli等[13]通过测序对阿根廷的潘帕斯草原土壤研究结果表明,土壤稳定性和土壤有机碳对nifH固氮菌功能有一定影响。适宜的土壤pH和高含量的土壤碳为固氮菌群落提供了更为理想的生存环境[22-23]。
然而,关于保护性耕作对东北黑土区固氮菌群落结构和多样性的影响尚不明确。本研究利用15年免耕和传统耕作试验,采用高通量测序方法,探讨东北地区免耕和传统耕作条件下0~5 cm和5~20 cm两个土壤深度的固氮菌群落的丰度、多样性和组成的差异,解析东北黑土保护性耕作条件下固氮菌的群落结构特征及其与土壤理化性质的关系,研究结果将有助于增强保护性耕作对黑土保育的理论体系,为未来通过调控固氮微生物、优化保护性耕作效果提供探索的途径。
1 材料与方法
1.1 研究区概况
本研究依托中国科学院海伦农田生态系统(N47°26′,E126°38′)长期定位实验站(简称海伦站)。海伦站始建于1978年,2005年成为国家野外科学观测研究站,地处我国东北黑土带的中心区域,也是中国生态系统研究网络(CERN)最北端的生态站,是农业资源、环境和生态多学科的综合研究基地。海伦站海拔240 m,处于温带大陆性季风气候区,夏季高温多雨,冬季寒冷干燥,年平均气温1.5~2.9 ℃,年平均降雨量500~600 mm,主要集中在5~9月,年平均有效积温(≥10 ℃)2 400~2 500 ℃,年平均日照时数2 600~2 800 h,无霜期120~130 d。
1.2 试验设计
海伦站的保护性耕作试验设置于2004年,包括免耕和传统耕作两种耕作制度,每种耕作制度设有3个重复,采用完全随机区组设计。每个地块的面积为8.4 m×40 m,用0.7 m的缓冲带与其他地块隔开,大豆(Glycinemax)和玉米(Zeamays)轮作。免耕处理(NT)只收获作物种子,其他所有生物量都均匀覆盖在整个地块表面。每年5月初,作物(玉米或大豆)用免耕播种机播种,土壤保持原样,不使用任何耕作措施。传统耕作(CT)是所有地上生物量在10月份收获后被移除,然后采用旋耕整地,深度为20 cm,起垄高度为15 cm。下一年在5月初用传统的播种机种植,中耕起垄两次。除耕作作业外,免耕和传统耕作的其他管理都一样。玉米每年施氮(N)138 kg·hm-2,磷(P2O5)51.75 kg·hm-2,钾(K2O)15 kg·hm-2,大豆每年施氮(N)20.25 kg·hm-2,磷(P2O5)51.75 kg·hm-2,钾(K2O)15 kg·hm-2。
1.3 样品的采集与分析
2018年夏季,分别从免耕和传统耕作0~5 cm和5~20 cm土层深度采集土壤样品,每个处理3个重复,其中每一土层的样品是由随机选取并混合均匀的六个样点组成的复合样品。将采集后的样品放在无菌塑料袋里,置于冰盒内运送到实验室。到达实验室后,移除可见的植物残体和石子,过2.0 mm的筛子,之后将样品平均分成3部分,一部分风干样品和一部分鲜样用来测定土壤基础物理、化学和生物学性质,另外部分放在-80 ℃冰箱存储以备进一步提取土壤DNA。
1.4 土壤理化性质测定

1.5 土壤DNA提取,固氮菌nifH基因的荧光定量PCR和Illumina Miseq高通量测序
基于Fast DNA®SPIN Kit(MOBIO PowerSoil DNA Isolation Kit)试剂盒来提取DNA。使用NanoDrop(Thermo Scientific,Wilmington,USA)测量DNA数量和质量。从土壤中提取的DNA的置于-20 ℃冰箱用于下一步分析。
采用引物nifH-F(5′-AAAGGYGGWATCGGYAARTCCACCAC-3′)与nifH-R(5′-TTGTTSGCSGCRTACATSGCCATCAT-3′)对固氮菌nifH基因进行荧光定量PCR测定[27]。具体扩增程序和PCR反应体系为:在95 ℃下变性10 min,40个循环,变性:95 ℃,5 s;退火:50 ℃,30 s;延伸:72 ℃,40 s。对固氮菌nifH采用上述引物进行高通量测序,PCR反应混合物包括:15 μL 1×SYBR预混剂Ex Taq,每种引物0.25 μL,4 μL dNTPs(2.5 mmol)和1 μL DNA模板50 ng。PCR产物用2.0%琼脂糖凝胶电泳。
将每个样品的扩增子进行组合、纯化、定量,然后使用MiSeq PE300委托上海美吉生物医药公司(Majorbio Bio-TecCo.Ltd)进行高通量测序。用QIIME version 1.9.1软件处理序列质量,通过UCHIME算法删除修剪后的序列,用UPARSE将剩余的样本读数以97%的相似性对序列进行OTU划分。
1.6 统计分析方法
基于Chao 1指数和Shannon指数描述固氮菌群落的α多样性。不同处理的Chao 1指数和Shannon指数差异采用One-way ANOVA方法分析,nifH基因的拷贝数和多样性的交互作用使用Two-way ANOVA方法分析,用SPSS 18.0软件统计完成。土壤固氮菌的群落结构用Bray_curtis距离矩阵的PCA分析,nifH基因的拷贝数、多样性和土壤理化性质的相关性采用Pearson相关性进行分析。Mantel test在R(Version 3.5.0)软件的vegan数据包中完成,用来检验土壤固氮菌群落与理化性质之间的相关性。
2 结果与分析
2.1 免耕对土壤固氮菌丰度和群落组成的影响
免耕和传统耕作下,nifH基因的丰度范围为0.73×106~1.81×106copies·g-1dry soil。耕作和土壤深度对nifH基因拷贝数没有显著影响(图1)。本试验从所有样品中获得516 549条优化序列,平均长度386 bp。获得的数据在97%相似性水平上进行分类,检测得到了7个门,12个纲,18个目,23个科,32个属的4 280个OTU。土壤微生物组数据集已保存在NCBI中,登录号为PRJNA777296。
门水平上,变形菌门和未分类k__norank_d__Bacteria细菌的相对丰度占固氮菌群落的99%。属水平上,慢生根瘤菌属和未分类变形菌的相对丰度占固氮菌比例最大,分别占50.6%~69.0%和13.0%~24.5%,其次是未分类细菌属(7.4%~10.1%)和地杆菌属(0.8%~8.8%)(图2)。慢生根瘤菌属在所有处理中无显著差异(P=0.639)。
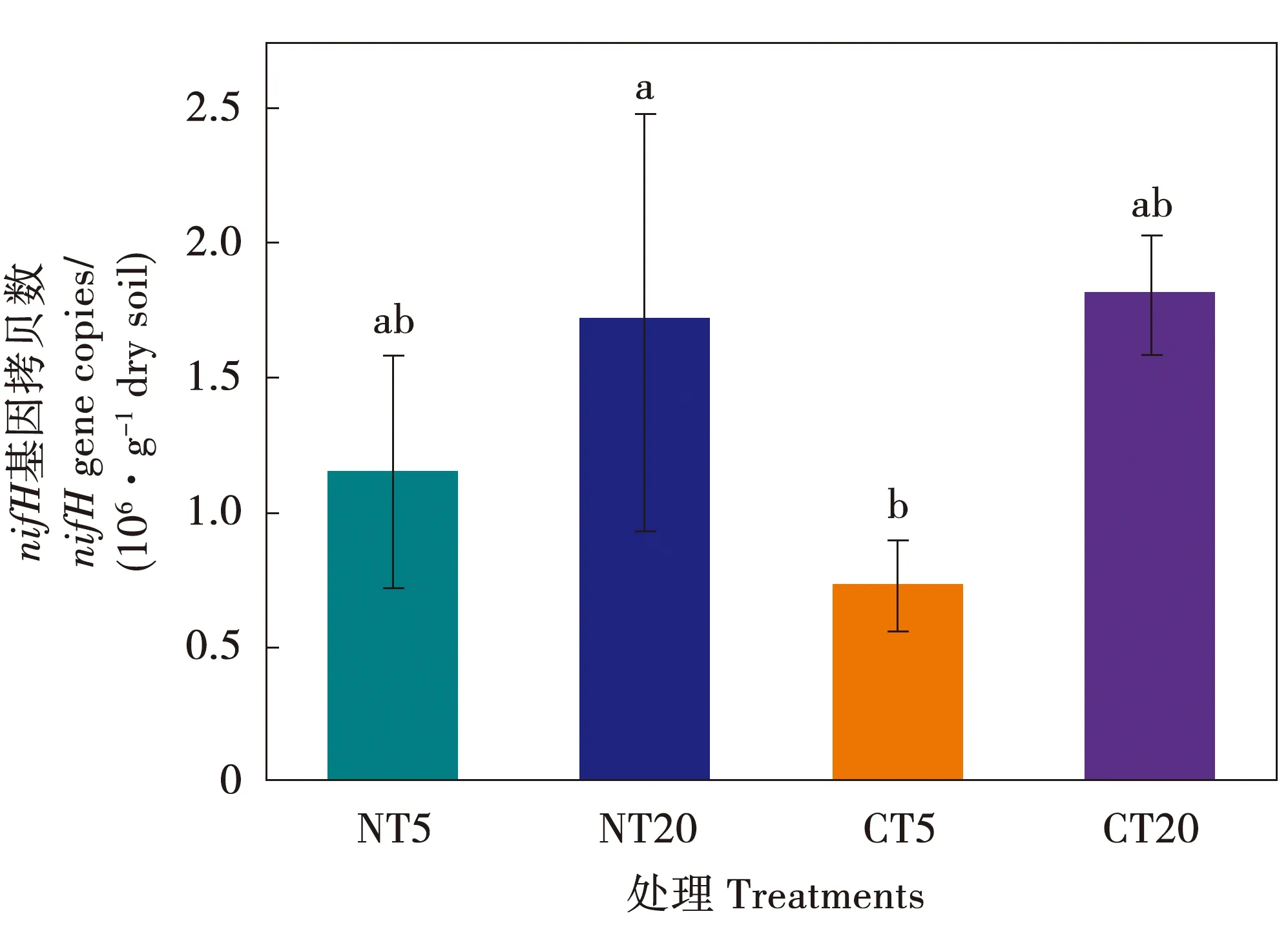
注:NT5代表免耕0~5 cm深度;NT20代表免耕5~20 cm深度;CT5代表传统耕作0~5 cm深度;CT20代表传统耕作5~20 cm深度。下同。Note:NT5,no tillage at soil depths of 0~5 cm;NT20,no tillage at soil depths of 5~20 cm;CT5,conventional tillage at soil depths of 0~5 cm;CT20,conventional tillage at soil depths of 5~20 cm.The same is as below.图1 固氮菌基因丰度对耕作和土壤深度的响应Fig.1 Soil nifH gene abundance response to tillage and soil depth
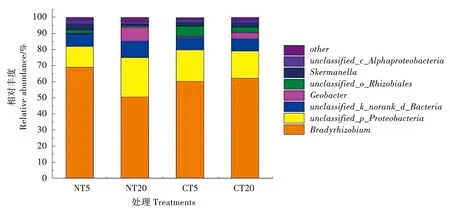
图2 耕作和土壤深度对土壤固氮菌属水平上相对丰度的影响Fig.2 Effects of tillage and soil depth on relative abundance of soil diazotrophic community at genus level
2.2 免耕对土壤固氮菌群落多样性的影响
Chao 1和Shannon指数用于了解固氮菌群落的多样性[23]。本研究中,Chao 1和Shannon在所有处理中都没有显著差异(图3)。Chao 1和Shannon指数也未受到耕作、土壤深度及其交互作用的影响(图3)。采用PCA分析了所有样品的组成分布,PC1轴和PC2轴分别可以解释总方差的36.91%和12.96%(图4)。免耕和传统耕作对土壤固氮菌群落组成有显著影响(r=0.429,P<0.001)。
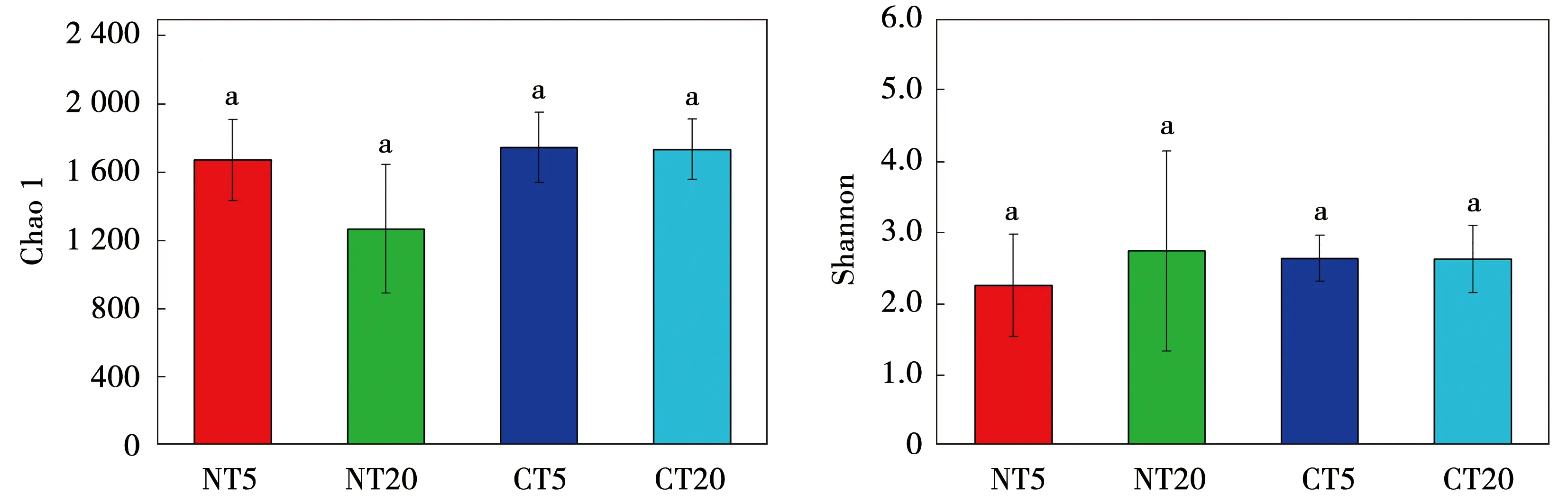
图3 土壤固氮菌群落多样性指数对耕作和土壤深度的响应Fig.3 Soil diazotrophic community diversity indices response to tillage and soil depth
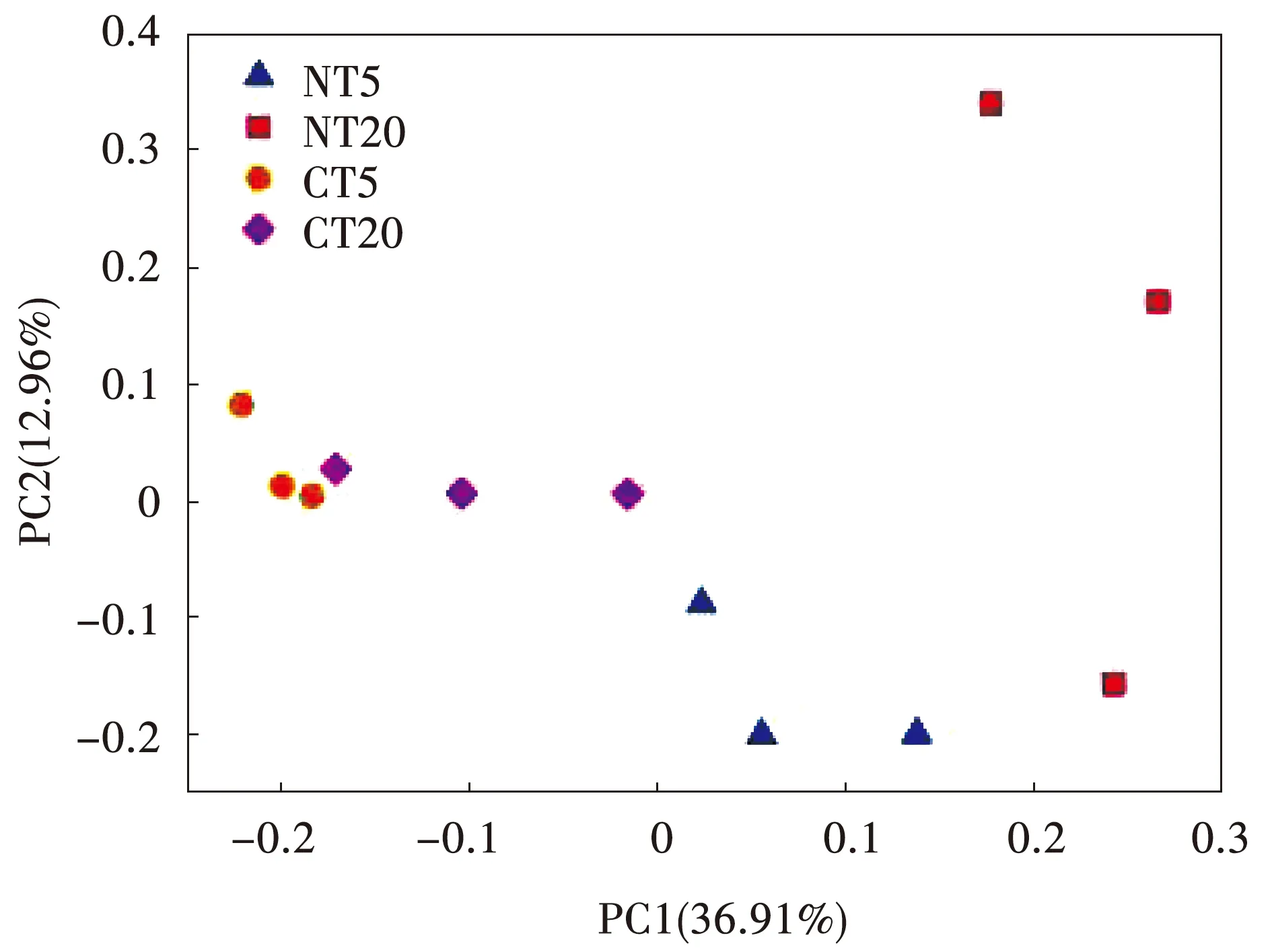
图4 土壤固氮菌群落组成的PCA分析Fig.4 Soil diazotrophic community composition indicated by principal co-ordinates analysis
2.3 土壤固氮菌群落与土壤理化性质的关系
本研究显示,所有土壤理化特征与nifH基因拷贝数、Chao 1和Shannon指数都没有显著相关性(图5),这一结果与先前的研究结果即耕作和土壤深度对nifH基因丰度、Chao 1和Shannon没有显著影响相吻合(图3)。土壤容重与PC1显著相关(图5),同时Mantel test检验也表明,固氮菌群落与土壤容重显著相关(表1)。因此,土壤性质可能主要影响固氮菌群落的构成。本试验的研究结果强调了土壤容重对免耕系统中固氮菌群落的重要性。
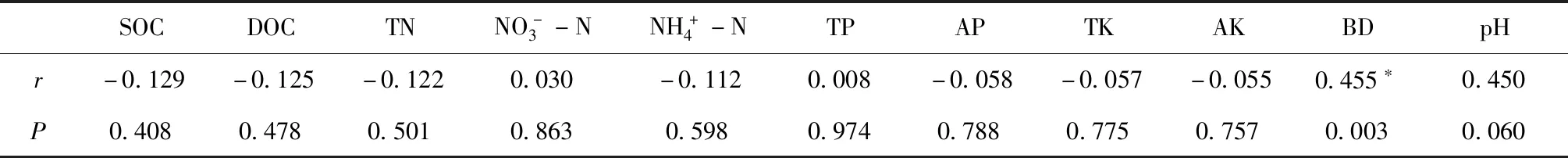
表1 土壤固氮菌群落与土壤理化属性Mantel test分析Table 1 Mantel test analysis between soil diazotrophic community and soil properties

注:SOC代表土壤有机碳;DOC代表可溶性碳;TN代表总氮;TP代表总磷;AP代表有效磷;TK代表全钾;AK代表速效钾;BD代表容重;显著相关(**代表P<0.01;*代表P<0.05)。Note:SOC indicates soil organic carbon;DOC indicates dissolved organic carbon;TN indicates total nitragen;TP indicates total phosphorus;AP indicates available phosphorus;TK indicates total potassium;AK indicates available potassium;BD indicates bulk density.Significant correlations (** indicates P<0.01;* indicates P<0.05).图5 土壤理化属性与固氮菌群落的相关性Fig.5 Correlation between diazotrophic community and soil properties
3 讨 论
土壤氮转化过程需要很多功能微生物的参与,这些功能微生物对土壤氮素的转化具有一定的调控作用。固氮菌将大气中氮气转化为生物可利用形态氮。植被种类、火烧、土壤氮含量和秸秆还田都会影响土壤固氮菌的组成[28-30]。免耕秸秆还田可以通过对土壤水分和温度的影响来调控氮的固定,也可以提高一些作物的固氮率[31-32],增加土壤中的nifH基因丰度[33],并改变固氮菌的群落结构。本研究结果显示,免耕和传统耕作对土壤固氮菌群落的组成有显著影响(图4)。Hsu和Buckley[15]在长达30多年的长期定位试验研究表明,保护性耕作和秸秆还田共同影响土壤固氮菌群落变化。同时,Calderoli等[13]的研究表明,在粉质土壤中,保护性耕作和土壤深度共同影响土壤固氮菌群落的组成,这也证明了本试验的结论,这可能是由于免耕加秸秆还田改变了不同土壤深度的固氮菌生活所需的底物分布状况导致的。有研究表明,nifH基因群落的丰度和多样性主要受某些土壤理化属性驱动[13,28]。土壤pH对固氮菌群落结构有显著影响,而较低的pH不利于土壤固氮[8,16,31]。有研究表明,土壤氮含量影响固氮菌群落的结构[34-36]。氮的有效性既可以具有刺激作用,也可以具有抑制作用[8,37]。土壤有机碳增加了土壤固氮菌群落的丰度、多样性和活性,不稳定碳含量的增加通常会加速氮的固定,这可能是因为环境中较多的可利用碳对固氮菌的生长有良好的促进作用[38-40],但也有研究证明没有效果[41-42]。然而,在本研究中,土壤碳和氮对固氮菌群落没有显著影响,这可能是因为东北黑土具有较高的碳氮含量,导到碳并未成为固氮菌生存的限制因子。本研究中,土壤容重与PC1具有显著相关性(图5)。同时Mantel test检验表明固氮菌群落与土壤容重呈显著相关关系(表1)。土壤容重可以反映土壤的结构以及透气性、透水性和保水能力,在一定程度上影响了土壤微生物的群落组成[43-44]。前人研究表明,土壤微生物种群与土壤容重呈负线性关系[45],这些结果也证实了本研究的发现,即土壤容重与微生物种群密切相关[46]。土壤容重显著影响固氮菌群落可能是因为nifH群落占据的生态位是以水分和孔隙大小的波动为特征的[13]。本研究结果强调了土壤容重对免耕系统中固氮菌群落的重要性。本试验针对土壤固氮菌群落的研究只限于nifH基因,今后可用宏基因组学的方法对整个固氮基因家族进行研究。
4 结 论
本研究表明免耕和传统耕作下土壤固氮菌在门水平上变形菌门的相对丰度最大。属水平上慢生根瘤菌属的相对丰度最大,其次是未分类细菌属和地杆菌属。耕作处理未对慢生根瘤菌属产生显著影响。耕作、土壤深度对nifH基因拷贝数、Chao 1和Shannon指数均无显著影响,PCA分析表明免耕和传统耕作对土壤固氮菌群落的组成有显著影响。所有土壤理化特征与nifH基因拷贝数、Chao 1和Shannon指数均未达到显著相关性,土壤容重与PC1呈显著相关关系。Mantel test检验表明固氮菌群落与土壤容重显著相关。本研究表明保护性耕作通过影响土壤容重改变了土壤固氮菌的群落组成。
