新外来中药紫锥菊对虚寒、虚热证小鼠生物学效应的影响
2022-08-26王禅缔余淑惠朱映黎杨彬睿杜军刘晓菲张建军王林元陈亮王淳
王禅缔 余淑惠 朱映黎 杨彬睿 杜军 刘晓菲 张建军 王林元 陈亮 王淳
紫锥菊Echinacea purpurea(Linn.)Moench为菊科松果菊属植物,原产于北美洲地区,1762年《弗吉尼亚植物志》最早记载,1996年肖培根院士[1]介绍了紫锥菊的化学成分、药理作用、临床应用等。紫锥菊作为19世纪北美、德国等地备受欢迎的天然植物草药,以其独特的提高免疫力、抗病毒[2-5]等生物活性成为近几年医学领域研究开发的一种热点药物[6]。紫锥菊作为免疫调节剂在全球范围内日渐普及,其普遍的制剂为口服浸出液制剂,即不同浓度的乙醇浸出液,主要用于治疗感冒、流感、关节炎、皮肤湿疹、免疫力低下等。
目前,国产紫锥菊保健食品已上市的有10种,主要与黄芪、西洋参、生姜进行配伍,用于增强免疫力、抗疲劳等;进口的有3种,主要用于增强免疫力。已有学者以外来中药药性研究策略[7]和范式[8]为指导,赋予紫锥菊中药药性[6],使其成为新外来中药,促进其在我国的进一步发展。本实验探讨紫锥菊对虚热、虚寒证小鼠环核苷酸、内分泌及物质代谢的影响,旨在求证紫锥菊的中药寒热药性。
1 材料与方法
1.1 动物
昆明种雄性小鼠110只,体质量18~22 g,由斯贝福动物实验中心提供,动物合格证号1102290139911。
1.2 药物
紫锥菊全草(由安徽常富国药有限公司提供,批号:20201203);甲状腺素片(上海中华药业有限公司,批号:200602);氢化可的松(山西兆益生物有限公司,批号:20110102);人参配方颗粒(北京康仁堂药业有限公司,批号:21006942);西洋参配方颗粒(广东一方制药有限公司,批号:412383T)。
1.3 试剂与仪器
环磷酸腺苷(cyclic adenosine monophosphate,cAMP)酶联免疫试剂盒(批号:202103)、环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)酶联免疫试剂盒(批号:202103)、三碘甲状腺原氨酸(triiodothyronine,T3,批号:202105)、甲状腺素(thyroxine,T4,批号:202105)均由江苏科特提供。总蛋白(total protein,TP)试剂盒(批号:20210319)、白蛋白(albumin,ALB)试剂盒(批号:20210320)、总胆固醇(total cholesterol,TC)试剂盒批号:20210325)、甘油三酯(triglyceride,TG)试剂盒(批号:20210323)均由南京建成生物工程研究所提供。
Epoch2C型酶标仪(美国伯滕仪器有限公司),台式冷冻离心机(Centrifuge 5424 R)。
1.4 药物制备
受试药参照陈秋玲等[9]对紫锥菊的提取方式进行提取和制备:紫锥菊全草,剪碎。80℃时用6倍量70%乙醇提取,提取3次,时间分别为2小时、2小时、1小时,合并滤液,浓缩到无醇。
1.5 分组和给药
适应性喂养一周后,将110只小鼠随机分为空白组、虚热模型组、虚热西洋参组(1 g/kg,相当于成人剂量6 g/d)、虚热紫锥菊低剂量组、虚热紫锥菊中剂量组、虚热紫锥菊高剂量组、虚寒模型组、虚寒人参组(1 g/kg,相当于成人剂量6 g/d)、虚寒紫锥菊低剂量组、虚寒紫锥菊中剂量组、虚寒紫锥菊高剂量组,每组10只。虚热组小鼠每天下午4:30灌胃给予甲状腺片溶液160 mg/kg,虚寒组小鼠灌胃给予氢化可的松溶液25 mg/kg,每日1次,连续14天,制备虚热及虚寒模型[10-11]。同时每日上午9:30开始灌胃给药,各给药组灌胃相应浓度的药物,正常组和模型组给予等量生理盐水,给药体积为每0.2 mL/10 g,按体质量变化调整灌胃量。
紫锥菊临床用量推荐3~6 g[6]。为保证药性,以6 g为低剂量,取其40倍、20、10倍设高、中、低3个剂量组,即紫锥菊高剂量为4 g/kg(相当于成人剂量24 g/d)、中剂量为2 g/kg(相当于成人剂量12 g/d)、低剂量为1 g/kg(相当于成人剂量6 g/d)。
1.6 一般情况观察
每日记录小鼠精神状态、毛发光泽度状态等;并在第7天、14天、21天测体质量并加以记录。于实验第21天处死小鼠,将胸腺、脾脏称重,并计算脏器指数=脏器质量/体质量(mg/g)。
1.7 检测指标
实验第22天早晨,小鼠摘眼球取血,静置2~3小时,3500 r/min,离心15分钟,吸取上层血清,采用ELISA检测各组小鼠血清中cAMP、cGMP含量变化,并计算cAMP/cGMP比值。采用ELISA检测各组小鼠血清中T3、T4指标的含量变化。采用比色法检测各组小鼠血清TP含量变化,采用溴甲酚绿比色法检测ALB含量变化,采用单试剂GPO-PAP法检测TC、TG含量变化。
1.8 统计学处理
用SPSS 20.0统计软件对实验数据进行分析,实验所得数据为计量资料且都符合正态分布,采用均数±标准差(±s)表示。虚热组体质量、脏器指数、cAMP、cGMP、cAMP/cGMP、T3、T4、TP、ALB、TG、TC,虚寒组体质量、脏器指数、cAMP、T3、T4、TP、ALB、TC等指标符合方差齐性,多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD法;虚寒cGMP、cAMP/cGMP、TG等指标符合方差不齐性,采用Dunnett's检验。以P<0.05为差异有统计学意义。
2 结果
2.1 行为学观察
与空白组相比,虚热组小鼠毛色及小便发黄、自主活动增加等,符合临床虚热症状。虚寒组消瘦、毛发无光泽、萎靡、蜷缩聚集等,符合临床虚寒症状。与虚热组小鼠相比,虚热西洋参组小鼠的症状有一定程度的改善。与虚寒组相比,虚寒人参组小鼠的症状有一定改善。紫锥菊各剂量组小鼠与西洋参组小鼠状态相似,对虚热组小鼠有改善作用。
2.2 紫锥菊对虚热、虚寒组小鼠体质量的影响
实验第21天,与空白组相比,虚热模型组小鼠体质量明显减轻(P<0.05)。与虚热模型组相比,虚热西洋参组及虚热紫锥菊低、中、高剂量组小鼠体质量显著增加(P<0.05)。见表1。
表1 紫锥菊对虚热组小鼠体质量的影响(±s,g)
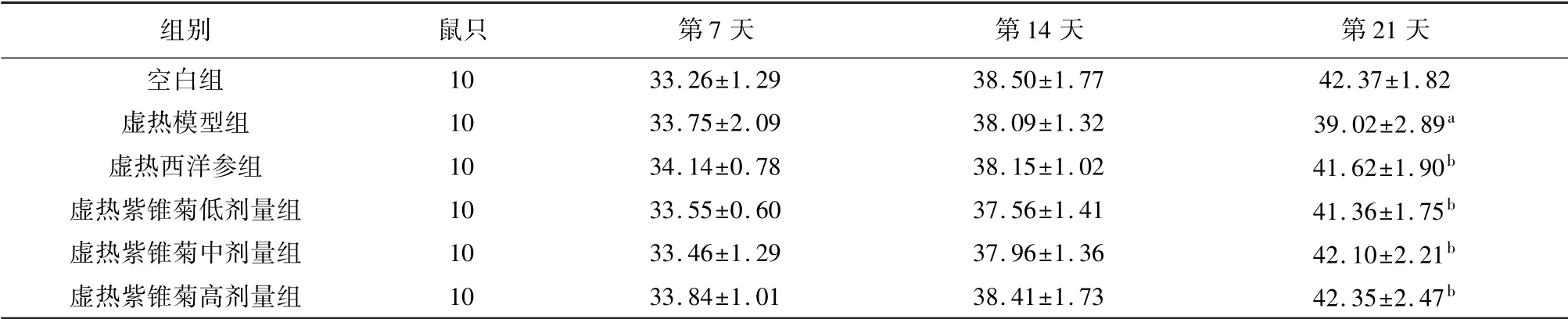
表1 紫锥菊对虚热组小鼠体质量的影响(±s,g)
注:与空白组相比,a P<0.05;与虚热模型组相比,b P<0.05。
组别 鼠只 第7天 第14天 第21天10 33.26±1.29 38.50±1.77 42.37±1.82虚热模型组 10 33.75±2.09 38.09±1.32 39.02±2.89a虚热西洋参组 10 34.14±0.78 38.15±1.02 41.62±1.90b虚热紫锥菊低剂量组 10 33.55±0.60 37.56±1.41 41.36±1.75b虚热紫锥菊中剂量组 10 33.46±1.29 37.96±1.36 42.10±2.21b虚热紫锥菊高剂量组 10 33.84±1.01 38.41±1.73 42.35±2.47空白组b
实验第21天,与空白组比较,虚寒模型组小鼠体质量明显减轻(P<0.05)。与虚寒模型组相比,虚寒人参组小鼠体质量明显增加(P<0.05);虚寒紫锥菊低、中、高剂量组小鼠体质量显著降低(P<0.05)。见表2。
表2 紫锥菊对虚寒组小鼠体质量的影响(±s,g)
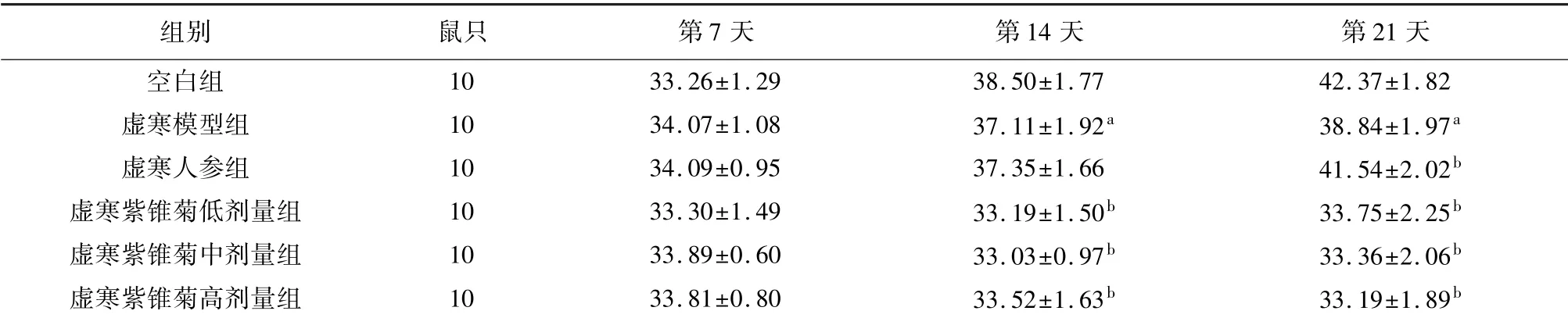
表2 紫锥菊对虚寒组小鼠体质量的影响(±s,g)
注:与空白组相比,a P<0.05;与虚寒模型组相比,b P<0.05。
组别 鼠只 第7天 第14天 第21天10 33.26±1.29 38.50±1.77 42.37±1.82虚寒模型组 10 34.07±1.08 37.11±1.92a 38.84±1.97a虚寒人参组 10 34.09±0.95 37.35±1.66 41.54±2.02b虚寒紫锥菊低剂量组 10 33.30±1.49 33.19±1.50b 33.75±2.25b虚寒紫锥菊中剂量组 10 33.89±0.60 33.03±0.97b 33.36±2.06b虚寒紫锥菊高剂量组 10 33.81±0.80 33.52±1.63b 33.19±1.89空白组b
2.3 紫锥菊对小鼠脏器指数的影响
与空白组相比,虚热模型组小鼠脾脏、胸腺脏器指数显著降低(P<0.05)。与虚热模型组相比,虚热西洋参组及虚热紫锥菊低、中、高剂量组小鼠脾脏、胸腺脏器指数明显增加(P<0.05)。见表3。
表3 紫锥菊对虚热组小鼠脏器指数的影响(±s,mg/g)
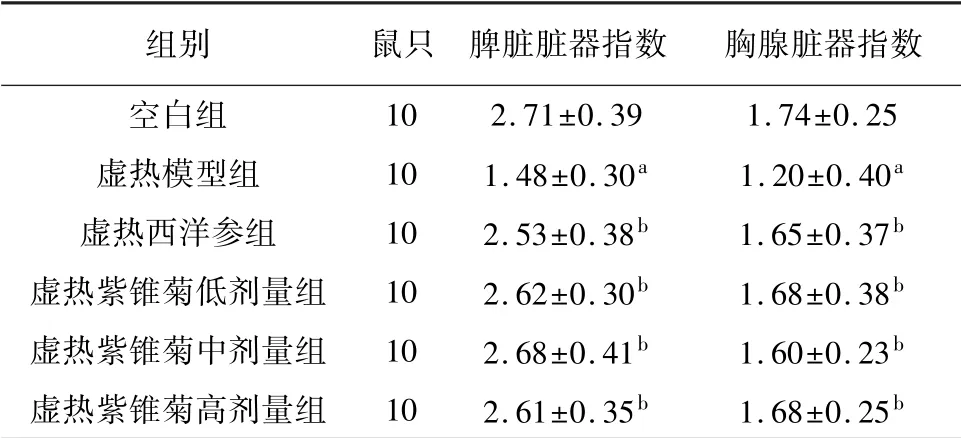
表3 紫锥菊对虚热组小鼠脏器指数的影响(±s,mg/g)
注:与空白组相比,a P<0.05;与虚热模型组相比,b P<0.05。
组别 鼠只 脾脏脏器指数 胸腺脏器指数空白组10 2.71±0.39 1.74±0.25虚热模型组 10 1.48±0.30a 1.20±0.40a虚热西洋参组 10 2.53±0.38b 1.65±0.37b虚热紫锥菊低剂量组 10 2.62±0.30b 1.68±0.38b虚热紫锥菊中剂量组 10 2.68±0.41b 1.60±0.23b虚热紫锥菊高剂量组 10 2.61±0.35b 1.68±0.25 b
与空白组相比,虚寒模型组小鼠脾脏、胸腺脏器指数显著降低(P<0.05)。与虚寒模型组相比,虚寒人参组小鼠脾脏、胸腺脏器指数明显增加(P<0.05)。见表4。
表4 紫锥菊对虚寒组小鼠脏器指数的影响(±s,mg/g)

表4 紫锥菊对虚寒组小鼠脏器指数的影响(±s,mg/g)
注:与空白组相比,a P<0.05;与虚寒模型组相比,b P<0.05。
组别 鼠只 脾脏脏器指数 胸腺脏器指数空白10 2.71±0.39 1.74±0.25虚寒模型组 10 1.58±0.25a 0.52±0.20a虚寒人参组 10 2.86±0.36b 1.53±0.20b虚寒紫锥菊低剂量组 10 1.60±0.26 0.50±0.26虚寒紫锥菊中剂量组 10 1.35±0.33 0.48±0.21虚寒紫锥菊高剂量组10 1.37±0.21 0.45±0.29
2.4 紫锥菊对小鼠环核苷酸水平的影响
与空白组相比,虚热模型组小鼠cAMP、cGMP、cAMP/cGMP显著升高(P<0.05)。与模型组相比,虚热西洋参组及虚热紫锥菊低、中、高剂量组cAMP、cAMP/cGMP显著降低(P<0.05),虚热西洋参组及虚热紫锥菊低、中剂量组cGMP显著升高(P<0.05)。见表5。
表5 紫锥菊对虚热组小鼠环核苷酸水平的影响(±s)
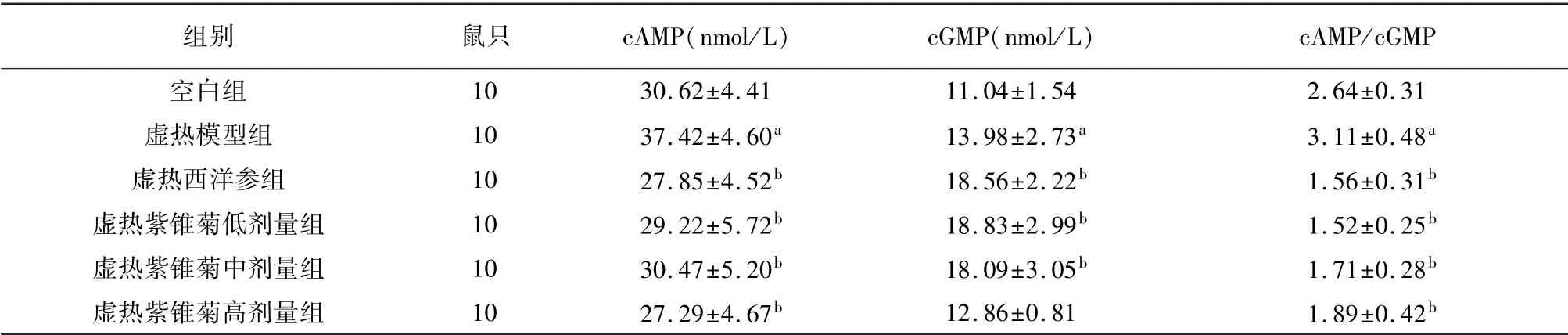
表5 紫锥菊对虚热组小鼠环核苷酸水平的影响(±s)
注:与空白组相比,a P<0.05;与虚热模型组相比,b P<0.05。
组别 鼠只 cAMP(nmol/L) cGMP(nmol/L)cAMP/cGMP空白组10 30.62±4.41 11.04±1.54 2.64±0.31虚热模型组 10 37.42±4.60a 13.98±2.73a 3.11±0.48a虚热西洋参组 10 27.85±4.52b 18.56±2.22b 1.56±0.31b虚热紫锥菊低剂量组 10 29.22±5.72b 18.83±2.99b 1.52±0.25b虚热紫锥菊中剂量组 10 30.47±5.20b 18.09±3.05b 1.71±0.28b虚热紫锥菊高剂量组 10 27.29±4.67b 12.86±0.81 1.89±0.42 b
与空白组相比,虚寒模型组cAMP、cAMP/cGMP显著降低(P<0.05),cGMP显著升高(P<0.05)。与模型组相比,虚寒人参组cAMP、cAMP/cGMP显著升高(P<0.05),虚寒人参组及虚寒紫锥菊低、中、高剂量组cGMP显著降低(P<0.05)。见表6。
表6 紫锥菊对虚寒组小鼠环核苷酸水平的影响(±s)

表6 紫锥菊对虚寒组小鼠环核苷酸水平的影响(±s)
注:与空白组相比,a P<0.05;与虚寒模型组相比,b P<0.05。
组别 鼠只 cAMP(nmol/L) cGMP(nmol/L)cAMP/cGMP空白组10 30.62±4.41 11.04±1.54 2.64±0.31虚寒模型组 10 22.39±3.29a 22.45±1.76a 1.03±0.11a虚寒人参组 10 30.60±4.79b 11.20±0.83b 2.85±0.45b虚寒紫锥菊低剂量组 10 22.11±5.23 15.56±0.73b 1.31±0.43虚寒紫锥菊中剂量组 10 23.80±5.55 16.17±1.82b 1.49±0.40虚寒紫锥菊高剂量组 10 20.16±3.57 15.65±0.90b 1.20±0.34
2.5 紫锥菊对小鼠甲状腺激素水平的影响
与空白组相比,虚热模型组T3、T4含量显著升高(P<0.05)。与模型组小鼠相比,虚热紫锥菊低、中、高组T3含量显著降低(P<0.05),虚热西洋参组及虚热紫锥菊中、高剂量组T4含量显著降低(P<0.05)。见表7。
表7 紫锥菊对虚热组小鼠甲状腺激素水平的影响(10只,±s,pmol/L)
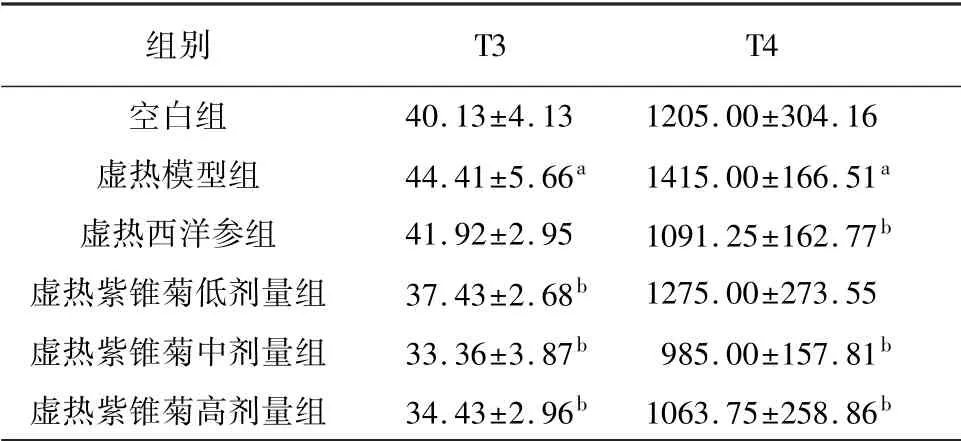
表7 紫锥菊对虚热组小鼠甲状腺激素水平的影响(10只,±s,pmol/L)
注:与空白组相比,a P<0.05;与模型组相比,b P<0.05。
组别T3 T4空白组40.13±4.13 1205.00±304.16虚热模型组 44.41±5.66a 1415.00±166.51a虚热西洋参组 41.92±2.95 1091.25±162.77b虚热紫锥菊低剂量组 37.43±2.68b 1275.00±273.55虚热紫锥菊中剂量组 33.36±3.87b 985.00±157.81b虚热紫锥菊高剂量组 34.43±2.96b 1063.75±258.86 b
与空白组相比,虚寒模型组小鼠T3、T4含量显著降低(P<0.05)。与模型组相比,虚寒紫锥菊低、中、高组小鼠T3含量显著降低(P<0.05),虚寒人参组T4含量显著升高(P<0.05),虚寒紫锥菊中、高剂量组T4含量显著降低(P<0.05)。见表8。
表8 紫锥菊对虚寒组小鼠甲状腺激素水平的影响(10只,±s,pmol/L)

表8 紫锥菊对虚寒组小鼠甲状腺激素水平的影响(10只,±s,pmol/L)
注:与空白组相比,a P<0.05;与虚寒模型组相比,b P<0.05。
组别T3 T4空白组40.13±4.13 1205.00±304.16虚寒模型组 35.41±4.37a 932.50±240.16a虚寒人参组 36.63±3.73 1391.25±207.67b虚寒紫锥菊低剂量组 32.01±3.24b 758.75±167.41虚寒紫锥菊中剂量组 31.26±2.76b 440.00±147.48b虚寒紫锥菊高剂量组 28.25±2.73b 302.50±200.13 b
2.6 紫锥菊对小鼠物质代谢的影响
与空白组相比,虚热模型组小鼠TP、ALB、TC、TG显著降低(P<0.05)。与虚热模型组相比,虚热西洋参组小鼠ALB显著升高(P<0.05);虚热紫锥菊低剂量组小鼠TP、ALB显著升高(P<0.05);虚热紫锥菊中、高剂量组小鼠TP、ALB、TG显著升高(P<0.05)。见表9。
表9 紫锥菊对虚热组小鼠物质代谢的影响(±s)

表9 紫锥菊对虚热组小鼠物质代谢的影响(±s)
注:与空白组相比,a P<0.05;与虚热模型组相比,b P<0.05。
组别 鼠只 TP(g/L) ALB(g/L) G(mmol/L) TC(mmol/L)空白组 10 62.71±7.78 30.59±3.42 1.87±0.42 3.97±0.50虚热模型组 10 54.85±2.93a 24.99±2.94a 1.43±0.24a 2.43±0.43a虚热西洋参组 10 59.27±4.30 29.05±1.92b 1.63±0.27 2.74±0.52虚热紫锥菊低剂量组 10 61.48±5.80b 29.67±2.04b 1.65±0.33 2.58±0.49虚热紫锥菊中剂量组 10 63.00±7.04b 29.36±1.83b 2.05±0.43b 2.41±0.41虚热紫锥菊高剂量组 10 61.60±5.95b 28.15±1.70b 1.83±0.18b 2.08±0.44
与空白组相比,虚寒模型组小鼠TP、ALB、TC、TG显著升高(P<0.05)。与虚寒模型组相比,虚寒人参组及虚寒紫锥菊醇提物低、中、高剂量组小鼠TP、ALB、TC、TG含量变化无统计学意义(P>0.05)。见表10。
表10 紫锥菊对虚寒组小鼠物质代谢的影响(±s)

表10 紫锥菊对虚寒组小鼠物质代谢的影响(±s)
注:与空白组相比,a P<0.05;与虚寒模型组相比,b P<0.05。
组别 鼠只 TP(g/L) ALB(g/L) TG(mmol/L) TC(mmol/L)空白组 10 62.71±7.78 30.59±3.42 1.87±0.42 3.97±0.50虚寒模型组 10 71.26±4.90a 36.23±2.50a 3.06±0.88a 5.30±0.96a虚寒人参组 10 76.15±9.75 34.42±2.94 2.94±0.41 5.92±0.99虚寒紫锥菊低剂量组 10 70.22±5.09 35.92±3.26 2.68±0.48 4.86±1.00虚寒紫锥菊中剂量组 10 69.63±6.98 37.98±2.25 2.56±0.39 5.76±0.85虚寒紫锥菊高剂量组 10 73.13±6.70 36.20±3.56 2.33±0.30 5.76±0.75
3 讨论
中药药性是中药理论的核心组成部分,是中医药学形成与发展的中药基础,寒热温凉四气是中药药性研究的核心和主题内容[12]。陶弘景在《本草经集注》中明确指出:“药物甘苦之味可略,为冷热须明。”李中梓在《医宗必读》中也强调:“寒热温凉,一匕之谬,覆水难收。”可见四气在药性理论中的地位。中医认为,虚热是因机体阴液亏耗,制约阳热功能减退,阴不制阳,出现燥热、升动和化气太过等阳相对亢盛的虚热内生的病理状态[13]。寒热证病人出现中枢神经系统功能的异常变化,脑内神经递质也发生相应变化。甲状腺激素对机体产热过程影响极大,可通过影响垂体-甲状腺轴功能和细胞钠泵活性,从而造成机体能量代谢的异常。环核苷酸是重要的细胞间信号转导第二信使,与机体物质代谢有密切关系。内生致热原引起发热时,脑积液和下丘脑的cAMP含量明显增加,所以阴虚发热时,cAMP升高,cAMP/cGMP比值升高,虚寒时,cAMP、cAMP/cGMP降低[14],此指标是中医微观辨证的指标之一[15-17],是整体性调节机制影响细胞功能的中间枢纽,在维持机体平衡中起重要作用[18]。已有研究表明[19],虚热状态下cAMP/cGMP值明显升高,并增加T3、T4等激素的释放,提高产热。黄俊山等[20]研究表明阴虚状态下,T3、T4升高,基础代谢率升高,产热增多;阳虚状态下,T3、T4含量降低,基础代谢率降低,产热减少。甲亢状态下血脂与甲状腺素水平呈负相关性[21],TG、TC、TP、ALB水平过低[22-24];阳虚状态下TG、ALB、TP含量明显高于正常组[25-26]。本实验虚热模型组cAMP、cAMP/cGMP、T3、T4显著升高,TP、ALB、TC、TG显著降低;虚寒模型组cAMP、cAMP/cGMP、T3、T4显著降低,TP、ALB、TC、TG显著升高,表明本实验造模成功。
有学者研究仙茅辛热药性的表达,实验以左归丸为阳性药,仙茅在甲状腺功能、肾上腺功能、环核苷酸水平及物质代谢水平等方面与左归丸表现一致,佐证了仙茅的辛热药性[26]。李琳[27]基于能量代谢及基因表达研究枳实寒热属性,实验以热药干姜、寒药大黄为阳性药,通过PLSR散点图结果分析,枳实的干预效果介于干姜和大黄之间,佐证了枳实药性微温。本实验结果显示紫锥菊能增加虚热模型动物的体质量及胸腺、脾脏等脏器指数,与西洋参的作用趋势一致。能降低虚寒模型动物的体质量及胸腺、脾脏等脏器指数,与人参的作用趋势相反。人参性温,西洋参性凉,因此,证明紫锥菊的药性与西洋参趋同,为寒凉性质。与虚寒模型组相比,虚寒人参组cAMP、cAMP/cGMP、T4含量显著升高;虚寒紫锥菊组cAMP、cAMP/cGMP、TP、ALB、TG、TC含量无明显变化,T3、T4含量显著降低,表明紫锥菊与人参作用相反。与虚热模型组相比,虚热西洋参组cAMP、cAMP/cGMP、T4含量显著降低,ALB、TP、TG、TC含量显著升高或有升高的趋势;虚热紫锥菊组cAMP、cAMP/cGMP、T3、T4含量显著降低,TP、ALB、TG含量显著升高,表明紫锥菊与西洋参作用相似,药性寒凉。
紫锥菊是近代国际上以免疫调节、抗病毒等生物活性受到普遍重视的天然植物草药,其普遍的制剂为乙醇浸出液制剂,因此本实验以指导临床应用为导向,研究紫锥菊醇提物的寒热药性。随着现代科技的进步,对中药寒热药性理论的研究方法不断提升,除了对物质基础进行研究外,还开始探寻其内在机制,不断向微观领域深入,如基因组学、蛋白组学、代谢组学等研究方法[28]。本实验通过环核苷酸、内分泌、物质代谢水平对紫锥菊醇提物的寒热药性进行验证,为紫锥菊在中药药性指导下进行下一步的中医功效研究奠定实验基础,后期仍需对其寒热药性的物质基础及机制进行深入的研究。
