丝素蛋白/聚左旋乳酸纳米纤维纱线肌腱补片的制备及其性能
2022-08-26陈韶娟吴韶华
刘 蛟,陈韶娟,吴韶华
(青岛大学 纺织服装学院,山东 青岛 266071)
肌腱是连接肌肉和骨骼之间的软组织,是肌肉骨骼系统的重要组成部分。肌腱损伤是常见的运动型损伤,据统计,全球每年至少有3 000万的肌腱损伤患者就医[1-2]。原生肌腱是由结构致密的纤维结缔组织构成,具有细胞含量低、成血管能力弱等缺陷,导致肌腱损伤后无法自我修复[3-4],对于大尺度损伤的患者来说必须采用补片进行辅助治疗。
近年来,尽管人工肌腱补片的种类层出不穷,但当前实现商业化的人工肌腱补片均采用纺织技术加工而成。与其他技术相比,纺织构型的肌腱补片具有三维可调的多孔结构以及刚柔并济的力学特征,具备显著的优势[5-6]。然而,传统纺织结构的肌腱补片仍存在许多缺点。例如:采用的纱线原料为聚酯纤维或碳纤维微米纤维纱线,植入人体后无法降解,容易引发炎症,甚至诱发强烈的机体免疫反应,长期使用具有致畸性和致癌性;此外,微米纤维结构无法有效仿生原生肌腱细胞外基质(ECM)胶原蛋白纤维的纳米尺度和结构,导致补片的生物活性差,不利于细胞生长和新生组织再生。新型静电纺纳米纤维成纱技术所生产的纳米纤维纱线具有更高的比表面积,且能够有效仿生原生肌腱组织ECM胶原纤维的纳米束状多级结构,更有利于细胞黏附和组织再生[7-8]。此外,在纳米纤维成纱过程中,可选用生物可降解的高聚物材料,植入体内后伴随肌腱组织的再生慢慢降解,最终通过新陈代谢排出体外,不会对机体造成安全隐患[9]。
目前,经美国食品与药品监督局(FDA)认可的可生物降解高聚物,主要包括聚左旋乳酸(PLLA)、聚己内酯(PCL)、聚乳酸-羟基乙酸(PLGA)和聚对二氧环己酮(PPDO)等[10-11]。此外,为进一步提高细胞在材料表面的黏附性,可添加一些生物活性高的天然高聚物,如明胶、胶原、壳聚糖以及丝素蛋白(SF)等[12]。基于此,本文通过自主研发的静电纺纳米纤维成纱技术结合传统纺织机织工艺,设计并研发了几款可生物吸收的纳米结构肌腱补片。以 4种不同SF/PLLA配比的纳米纤维纱线为主体材料,以传统PLLA微米纤维纱线为辅助材料,采用机织工艺制备了4种不同的肌腱补片,对其形貌、结构、理化性能以及生物性能进行测试与分析,为今后可吸收纳米结构人工肌腱补片的设计、研发以及临床应用提供参考。
1 实验部分
1.1 实验材料
聚左旋乳酸(PLLA,相对分子质量为1×105),济南岱罡生物科技有限公司;六氟异丙醇(HFIP),上海阿拉丁生化科技股份有限公司;PLLA微米纤维纱线(线密度为100 dtex(75 f)),青岛叒米科技有限公司;桑蚕茧,青岛盛天义商贸公司;无水碳酸钠(Na2CO3)、溴化锂(LiBr)、酒精,国药集团化学试剂有限公司;磷酸盐缓冲溶液(PBS)、噻唑蓝溶液(MTT)、二甲基亚砜溶液(DMSO),索莱宝生物科技有限公司;低糖基础培养基(DMEM)、胎牛血清(FBS)、青霉素/链霉素(P/S),赛默飞世尔科技(中国)有限公司;鬼笔环肽染液,上海翎圣生物科技有限公司;Draq5染液,美国Cell Signaling Technology公司。
1.2 丝素蛋白制备
用剪刀将桑蚕茧剪成硬币大小状,称取桑蚕茧片加入含有0.02 mol/L Na2CO3的溶液中沸煮30 min,使之脱胶;然后,用玻璃棒搅拌并于清水中洗涤3次,置于通风橱中过夜晾干。将配制好的9.3 mol/L的LiBr溶液倒进干燥的脱胶蚕丝中,然后于60 ℃溶解4 h,之后将完全溶解的蚕丝溶液于4 ℃离心机中离心去除杂质,再于室温下透析3 d,于-20 ℃冰箱中冷冻过夜,最后在冷冻干燥机中冷冻干燥2 d,获得海绵状丝素蛋白(SF)。
1.3 SF/PLLA纳米纤维纱线肌腱补片制备
SF/PLLA纺丝液配制:按照质量比为0∶100、20∶80、35∶65和50∶50分别称取相应质量的SF和PLLA,然后溶于HFIP中配制0.1 g/mL的聚合物溶液,于室温在磁力搅拌器上搅拌过夜,获得均匀的共混纺丝液。
SF/PLLA纳米纤维纱线的制备:将配制好的纺丝液静置30 min,然后采用自制的静电纺纳米纤维成纱牵伸一体机纺制纳米纤维纱线[13]。负载共混纺丝液的双喷头电压设置为±12 kV,2个喷头间距离为20 cm,纺丝液流速为0.8 mL/h,利用金属圆盘和空心金属棒(间距为10 cm)收集2个喷头喷出的纳米纤维,金属圆盘旋转(250 r/min)将纳米纤维加工成纱线,然后经由初纱辊送入热牵伸装置(温度为80 ℃),经1倍牵伸后获得纳米纤维纱线并卷绕在辊筒上。
SF/PLLA纳米纤维纱线肌腱补片的制备:以PLLA微米纤维纱线为经纱,自制的不同质量比SF/PLLA纳米纤维纱线作为纬纱,在SGA598型半自动织布小样机上织造成布,经密为120 根/(10 cm),纬密为260 根/(10 cm)。采用热刀裁剪获得4种不同材质的肌腱补片,补片纵向为织物纬纱方向,补片横向为织物经纱方向。
1.4 形貌观察
采用VEGA3型扫描电子显微镜(SEM)对4种补片的形貌进行观察,观察前利用小型离子溅射仪进行喷金处理,加速电压为10 kV,工作距离为10 mm。
1.5 化学结构测试
采用5225 Verona RD型傅里叶变换红外光谱仪对4种补片的化学基团进行分析,分辨率为4 cm-1,扫描范围为4 000~500 cm-1。
1.6 晶体结构测试
采用Ultima IV型广角X射线衍射仪对4种补片的晶体结构进行分析,扫描范围(2θ)为5°~45°,扫描速度为5 (°)/min,扫描电压为40 kV,电流为40 A。
1.7 拉伸力学性能测试
用数显千分尺对4种补片的厚度进行测量,精度为0.001 mm。沿补片纵向裁取40 mm×20 mm(长×宽)的样品,采用Instron-3300型单轴拉伸强力仪进行拉伸力学性能测试,每组分别测试5个样品,取平均值作为测试结果。实验夹持距离为20 mm,拉伸速度为120 mm/min,预加张力为1 N。
1.8 体外细胞培养实验
样品准备:将样品裁剪成半径约为3.5 mm的圆片状,在生物安全柜内进行紫外光照射灭菌,样品正反面各照射2 h,然后用70%酒精浸泡过夜,用灭菌的PBS缓冲溶液洗涤3次,最后放入细胞培养基中浸泡过夜。
细胞培养及接种:选取人的跟腱细胞为模型细胞对补片的细胞相容性进行测试,培养基主体是DMEM,含有10%的FBS和1%的P/S。按照密度为1×105个/圆片将细胞接种到样品上。实验过程中每2 d更换1次培养基,共培养7 d。
1.8.1 鬼笔环肽染色
细胞培养至第7天时,对接种细胞的样品进行固定、透膜、封闭后,在避光条件下,采用鬼笔环肽染液对细胞骨架蛋白(F-actin)染色2 h,然后用Draq5染液对细胞核(Nuclei)染色30 min,最后利用Zeiss 900 CLSM型激光共聚焦显微镜(CLSM)观察染色情况。
1.8.2 细胞黏附性能测试
细胞培养至第7 天时,将接种细胞的样品固定后,于30%、50%、70%、80%、90%、100%的梯度酒精中分别脱水5 min,于40 ℃干燥箱中干燥过夜,喷金90 s后通过SEM观察细胞在样品表面的黏附情况。
1.8.3 MTT增殖实验
接种细胞的样品培养至第1、3、7 天时,通过MTT实验测试细胞的增殖活性。避光条件下,将5 mg/mL MTT溶液加入接种细胞的样品中孵育4 h后,先将MTT溶液吸出弃掉后再加入DMSO溶液,在脱色摇床上使得细胞中生成的蓝紫色结晶——甲瓒(Formazan)完全溶解,然后吸取甲瓒/DMSO溶液置于96孔板中,于Infinite M Nano型酶标仪上读取吸光度值。每组样品每个时间节点分别设置5组对照样,用吸光度值定量表征细胞在样品上随着时间增加的生长和增殖情况。
2 结果与讨论
2.1 肌腱补片的形貌结构
图1示出4种不同质量比SF/PLLA纳米纤维纱线肌腱补片及其内部纳米纤维纱线和纳米纤维的电镜照片。可知:4种肌腱补片均由纳米纤维纱线和微米纤维纱线交织而成,纱线之间构成明显的孔隙;4种SF/PLLA纳米纤维纱线表面光滑且无杂丝;纳米纤维连续分布无断裂点,纵向分布均匀,取向度较高。

图1 不同质量比SF/PLLA纳米纤维纱线肌腱补片的扫描电镜照片Fig.1 SEM images of nanofiber yarns-based tendon patches with different SF/PLLA mass ratios
图2示出4种SF/PLLA纱线内部纳米纤维的直径分布直方图。可知,质量比为0∶100、20∶80、35∶65和50∶50的SF/PLLA纳米纤维的平均直径分别为(477±226)、(421±132)、(336±115)、(281±129) nm,即随着SF占比的增加,纳米纤维直径逐渐变细。这是由于在静电纺丝过程中,SF的添加导致纺丝液电导率增加,从而提高了射流的牵伸程度,致使最终获得的纤维直径变小[14-15]。以横轴为基准,取垂直于横轴逆时针方向的角度为纳米纤维取向度,测试结果如图3所示。可知,4种纳米纤维的取向度均集中分布在75°~105°之间,分布频率分别为94%、84%、88%、70%,说明4种纳米纤维均具有较高的取向度,这得益于较低的成纱捻度以及热牵伸的牵伸作用[8]。
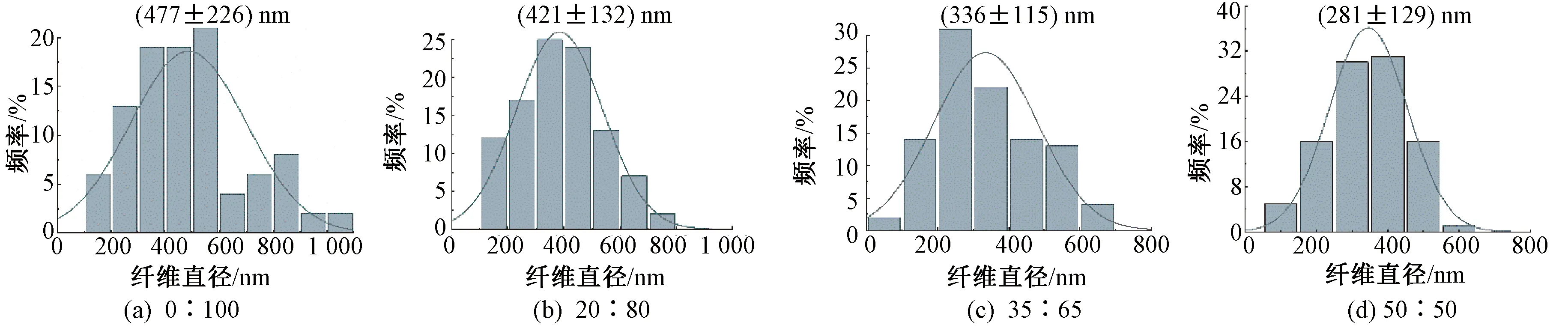
图2 不同质量比SF/PLLA纳米纤维纱线肌腱补片纳米纤维直径Fig.2 Nanofiber diameter of nanofiber yarns-based tendon patches with diverse SF/PLLA mass ratios
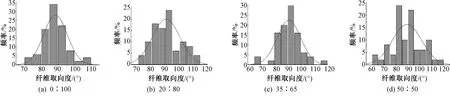
图3 不同质量比SF/PLLA纳米纤维纱线肌腱补片纳米纤维取向度分布Fig.3 Orientation distribution of nanofiber yarns-based tendon patches with diverse SF/PLLA mass ratios
2.2 肌腱补片的分子基团及结晶结构

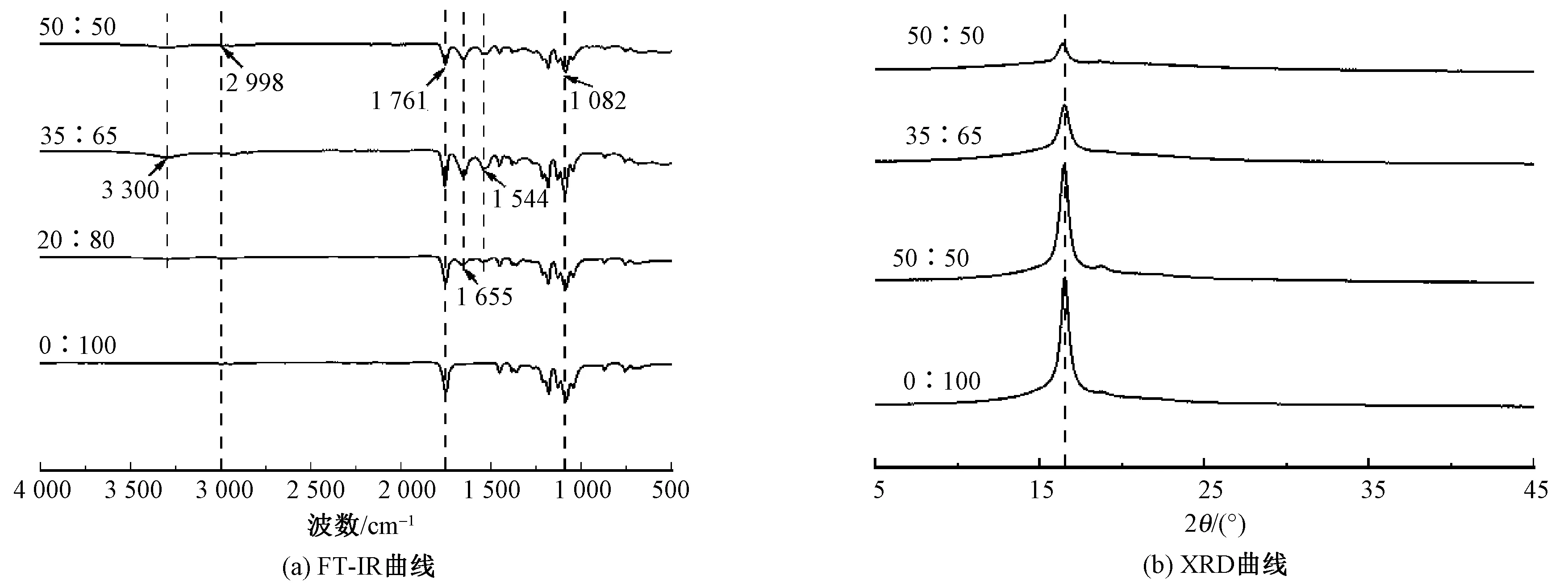
图4 不同质量比SF/PLLA纳米纤维纱线肌腱补片FT-IR和XRD曲线Fig.4 FT-IR (a) and XRD (b) curves of nanofiber yarns-based tendon patches with diverse SF/PLLA mass ratios
4种SF/PLLA纳米纤维纱线肌腱补片的X射线衍射光谱曲线如图4(b)所示。可知,SF/PLLA纳米纤维肌腱补片均在约16.4°附近出现细而高的衍射峰,对应着PLLA晶型中α′晶体的衍射峰(110)/(200);随着SF占比的增加,衍射峰的强度逐渐变弱。由于热牵伸过程中的处理温度(80 ℃)高于PLLA的玻璃化转变温度,致使PLLA内部杂乱排列的晶体开始滑移,牵伸作用导致晶体取向排列转变为取向α′晶体,取向排列的α′晶体的出现致使纱线的结晶衍射峰强度增加[17-18]。然而,SF的添加会抑制晶体在热处理过程中的取向排列[19],且随着SF占比的增加,抑制作用增强,导致PLLA晶型中α′晶体结晶能力变弱,衍射峰强度变低。
2.3 肌腱补片的拉伸力学性能
4种SF/PLLA纳米纤维纱线肌腱补片纵向的载荷-伸长曲线如图5所示,相关力学性能指标计算结果见表1。从图5可以看出,4种肌腱补片的载荷-伸长曲线具有相似的拉伸变形过程。在拉伸起始阶段,经历了微弱的脚趾区(toe)后,进入线性弹性阶段,紧接着经过非弹性变形直至拉伸至断裂。由表1可以看出,断裂载荷随着SF占比增加呈现出逐渐减小的趋势,但均高于100 N;其中SF与PLLA质量比为0∶100和20∶80的纳米纤维纱线肌腱补片的断裂载荷甚至能达到200 N以上,满足组织再生所需的力学性能要求[2]。与此同时,肌腱补片的断裂强度和初始模量也均随着SF占比增加呈现出逐渐降低的趋势,这与X射线衍射光谱图的变化趋势具有一致性,主要是由于SF的增加抑制了PLLA内部取向排列α′晶体的形成,从而导致力学性能逐渐下降。
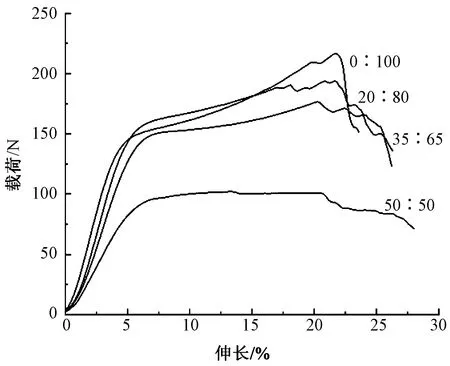
图5 不同质量比SF/PLLA纳米纤维纱线肌腱补片载荷-伸长曲线Fig.5 Load-elongation curves of nanofiber yarns-based tendon patches with diverse SF/PLLA mass ratios

表1 不同质量比SF/PLLA纳米纤维纱线肌腱补片力学性能Tab.1 Mechanical properties of SF/PLLA nanofiber yarns-based tendon patches with diverse SF/PLLA mass ratios
2.4 细胞在肌腱补片上的鬼笔环肽染色
将人的跟腱细胞分别在4种SF/PLLA纳米纤维纱线肌腱补片上培养7 d后,其细胞核(Nuclei)-细胞骨架蛋白(F-actin)荧光照片如图6所示。可看出:细胞核均较大,呈现圆形或椭圆状,表明所制备的肌腱补片无毒且有利于细胞生长;细胞骨架沿着纤维取向方向生长并几乎覆盖了整个肌腱补片,表明所制备的肌腱补片具有良好的生物相容性,有利于细胞黏附和生长。此外,添加SF的肌腱补片相较于未添加SF的肌腱补片具有更多的细胞,且随着SF占比增加,细胞骨架覆盖的面积更多,这表明SF有利于促进细胞的黏附和生长。

图6 不同质量比SF/PLLA纳米纤维纱线肌腱补片鬼笔环肽染色照片Fig.6 Phalloidin staining images of nanofiber yarns-based tendon patches with diverse SF/PLLA mass ratios
2.5 细胞在肌腱补片上的黏附图像
将人的跟腱细胞分别在4种SF/PLLA纳米纤维纱线肌腱补片上培养7 d,其细胞黏附扫描电镜照片如图7所示。可以观察到,细胞均能在4种肌腱补片上黏附生长,并且细胞几乎覆盖了整根纳米纤维纱线。

图7 不同质量比SF/PLLA纳米纤维纱线肌腱补片细胞黏附扫描电镜照片Fig.7 Cell adhesion SEM images of nanofiber yarns-based tendon patches with diverse SF/PLLA mass ratios
2.6 细胞在肌腱补片上的增殖活性
将人的跟腱细胞在4种SF/PLLA纳米纤维纱线肌腱补片上分别培养1、3和7 d,其细胞增殖情况如图8所示。可看出,随着培养时间增加,细胞在肌腱补片上的吸光度值逐渐增加,表明细胞逐渐增殖。同时,采用Scheffé 事后检验对比分析了不同质量比SF/PLLA纳米纤维纱线基肌腱补片的增殖活性。结果表明:随着SF占比的增加,肌腱补片的吸光度值呈现逐渐增加的趋势,细胞培养至第3天时,50∶50肌腱补片相较于0∶100和20∶80肌腱补片,呈现出显著性增殖;培养至第7 天时,50∶50肌腱补片相较于0∶100和20∶80肌腱补片进一步呈现出显著性差异,35∶65肌腱补片相较于0∶100和20∶80肌腱补片也呈现出显著性增殖。

注:“*”表示P<0.05;“**”表示P<0.01。图8 不同质量比SF/PLLA纳米纤维纱线肌腱补片的吸光度Fig.8 Absorbance values of nanofiber yarns-based tendon patches with diverse SF/PLLA mass ratios
3 结 论
本文利用静电纺纱结合机织工艺共制备了0∶100、20∶80、35∶65、50∶50质量比的丝素蛋白/聚左旋乳酸(SF/PLLA)纳米纤维纱线肌腱补片,研究了SF和PLLA质量比对补片形态结构、理化性能以及生物性能的影响。结果表明:随着SF占比增加,肌腱补片中纱线内部纳米纤维的平均直径逐渐减小,纳米纤维取向度均集中分布在75°~105°之间,呈现出较高的取向度;肌腱补片均在16.4°附近出现了结晶衍射峰,且随着SF占比增加,结晶衍射峰的强度逐渐降低;断裂载荷、断裂强度、初始模量也均随着SF占比的增加逐渐降低,但4种肌腱补片的断裂载荷均在100 N以上,能够满足组织再生所需的力学性能要求,其中0∶100和20∶80肌腱补片的断裂载荷甚至达到200 N以上。体外细胞实验表明,人的跟腱细胞能够在4种肌腱补片上黏附、生长并增殖,细胞数量随着培养时间的增加而逐渐增多;此外,细胞数量随着SF占比的增加而逐渐增加,表明肌腱补片能进一步促进细胞的生长、增殖。
本文以纳米纤维纱线代替传统用微米纤维纱线制备的可生物吸收纳米结构肌腱补片,具有较高的取向度,较强的力学性能以及促进细胞黏附、增殖的能力,从而有利于受损肌腱的组织再生与功能重建,为未来人工肌腱的性能优化以及临床应用提供一定的参考。
FZXB
