大穗型小麦新种质穗部性状遗传效应分析
2022-08-26赵永涛孟凡奇张中州甄士聪望俊森鲁进恒范志业
袁 谦, 赵永涛, 孟凡奇, 张中州, 甄士聪, 望俊森, 王 清, 鲁进恒, 范志业
(漯河市农业科学院,河南漯河 462300)
大穗型小麦种质是小麦品种的重要遗传基础,是实现小麦高产的重要途径之一。大穗型小麦品种的穗长、小穗数、小穗粒数和穗粒数等穗部性状表现突出,田间长相优异,深受群众喜爱,同时育种过程中注重大穗与粒质量协调,容易实现小麦的超高产。利用小黑麦进行远缘杂交育种是创制大穗型小麦种质的一种重要方法。小黑麦具有生物量大、分蘖力强、综合抗性突出、大穗大粒等优良性状,是小麦遗传改良的重要资源。漯河市农业科学院通过近缘属植物小黑麦LHXH11与普通小麦周麦22连续回交创制出大穗型小麦新种质漯新001。漯新001遗传了小黑麦的多小穗、多粒等优异穗部性状、强韧性茎秆性状及分蘖力强等优点,同时遗传了广适品种周麦22的部分主要农艺性状,株高适中、株叶型合理及籽粒灌浆好等特点。
小麦穗部性状是受主效基因、微效基因和环境共同作用的复杂数量性状,研究其遗传规律对于小麦创新种质的应用具有重要的指导意义。盖钧镒等提出的多世代联合分析方法能够根据表型性状确定其遗传模型,分析主效基因和微效基因的遗传效应,明确其遗传机制,目前这种方法已应用于多种作物的表型性状遗传研究中。近年来,该方法在小麦重要农艺性状的遗传规律研究方面也得到了应用,不同的研究选用的亲本材料不同,获得的研究结果也不尽相同。本研究以小黑麦创制的大穗型小麦种质漯新001为研究材料,分析其大穗相关性状的遗传规律,指导构建最佳的育种选择群体及制定高效的后代选择策略,以期为小麦创新种质更有效率地应用于小麦育种提供参考。
1 材料与方法
1.1 试验材料
漯新001和漯丰4446是漯河市农业科学院分别采用小黑麦和人工合成小麦创制的小麦新种质,漯新001是大穗型小麦新种质,具有多小穗、多粒等优异穗部性状;漯丰4446是多穗、大粒型小麦新种质,具有千粒质量、成穗率高等丰产特性。以漯新001为母本(P)、漯丰4446为父本(P)构建6世代联合群体,即3个不分离世代(母本P、父本P、杂交一代F)和3个分离世代(单交二代F、母本回交一代B、父本回交一代B)。
1.2 穗部性状调查
2020年10月在漯河市农业科学院试验基地种植漯新001×漯丰4446组合的6个世代联合群体。行长2.50 m,行距0.25 m,每行点播30粒种子。不分离世代(P、P和F)各种植3行,分离世代(F、B和B)各种植24行,整个生育期常规田间管理。于2021年小麦乳熟期调查穗长、小穗数、小穗粒数、穗粒数。调查标准参考李立会等的方法,穗长为主茎穗的基部小穗节到穗顶部的长度(不含芒);小穗数为所有小穗总数;穗粒数为全穗实际粒数;小穗粒数为穗中部小穗最多粒数。P、P和F各调查30株,F、B、B分别调查200、200、190株。
1.3 数据分析
应用盖钧镒等提出的植物数量性状遗传体系主基因+多基因混合遗传模型分离分析方法,对4个穗部性状进行遗传分析。通过迭代最大期望(IECM)算法从模型的对数极大似然函数估计各成分的参数及似然函数值,进一步计算出赤池信息量准则(AIC)值,根据适合性检验和最佳模型选择原则,确立最佳遗传模型,同时采用最小二乘法计算基因效应值,估计遗传方差,分析遗传效应。利用R语言软件中的pastecs包和SEA包分别进行描述性统计分析和遗传分析,利用Excel 2003绘制图表。
2 结果与分析
2.1 穗部性状的描述性统计分析
由表1可知,亲本P(漯新001)与亲本P(漯丰4446)的穗长分别为14.93、10.75 cm,小穗数分别为27.63、24.77个,小穗粒数分别为4.93、3.80粒,穗粒数分别为102.67、69.10粒,检验结果表明2个亲本的4个穗部性状均达到极显著差异。F的穗长、小穗数、小穗粒数和穗粒数分别为 13.80 cm、27.53个、3.90粒和83.47粒,均介于P和P之间,说明F穗部的各性状未表现出超亲优势,其中小穗数更接近于大穗亲本P(漯新001),小穗粒数更接近于丰产亲本P(漯丰4446),穗长和穗粒数则接近于中亲值。3个分离世代(F、B和B)的穗长变异的值域分别为8.9、8.1、 7.2 cm,变异系数分别为12%、9%、11%;小穗数变异的值域分别为15、14、13,变异系数分别为9%、7%、10%;小穗粒数变异的值域分别为4、3、3,变异系数分别为18%、14%、18%;穗粒数变异的值域分别为103、93、84,变异系数分别为23%、19%、25%;其中穗长和小穗数在F和B群体中有超亲现象存在,穗粒数在B群体中有超亲现象存在,3个分离世代(F、B和B)穗部各性状的变异幅度大,表型丰富。将3个分离世代(F、B和B)的穗部性状绘制成频数分布图(图1)可知,4个性状均为连续分布,呈现单峰偏态分布或多峰混合分布,具有典型的植物数量性状遗传分布特征,适合进行主基因+多基因遗传分析。
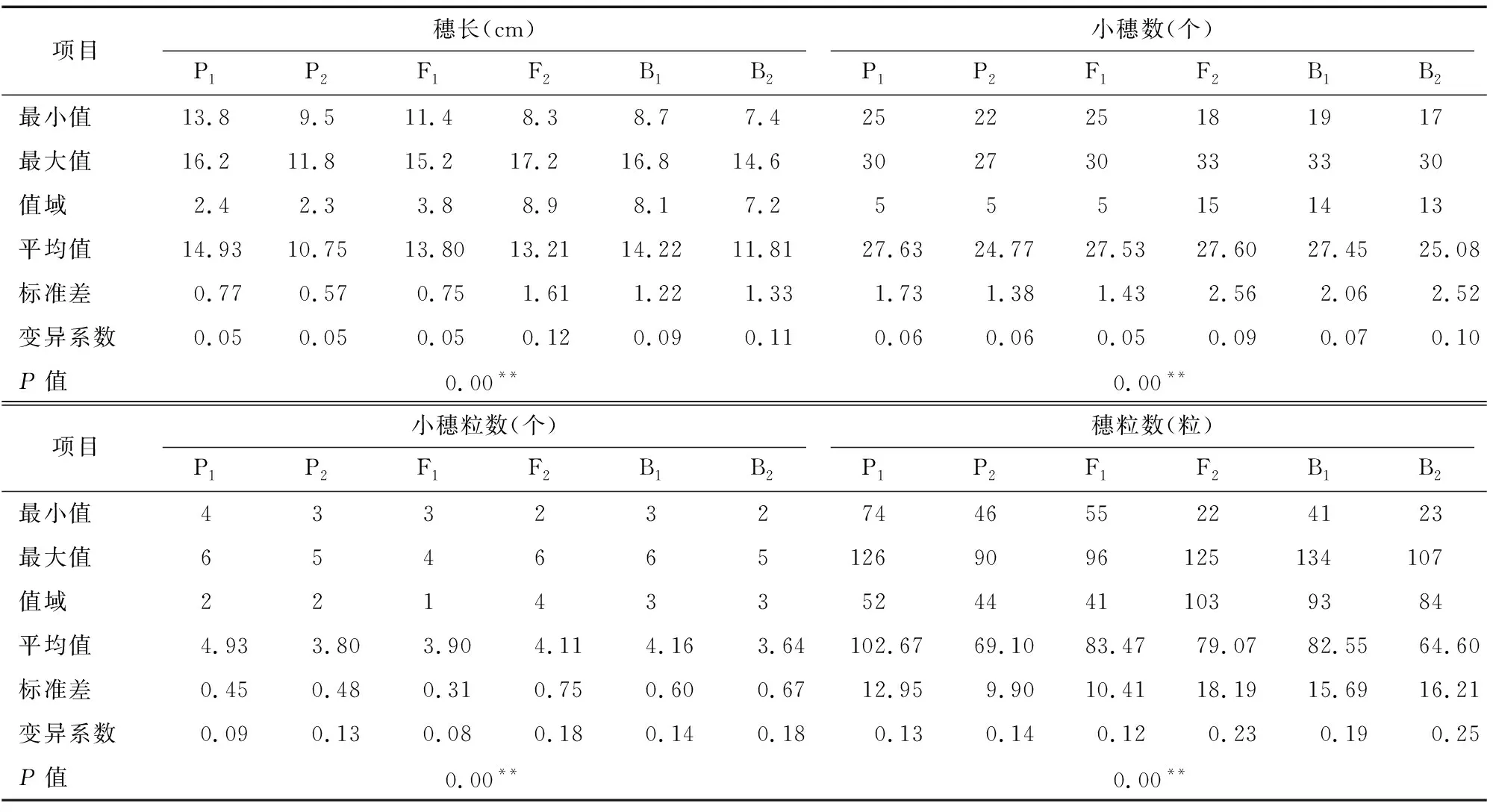
表1 各世代群体穗部性状的描述性统计
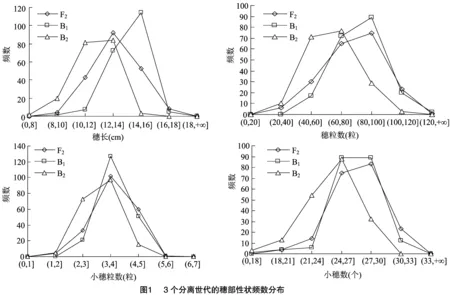
2.2 穗部性状最优遗传模型的适合性分析
利用植物数量性状遗传体系主基因+多基因混合遗传模型分离分析方法对6世代(P、P、F、F、B和B)群体的4个穗部性状进行遗传分析,获得了5类24种遗传模型。根据最优模型选取原则,选择AIC值最小及与最小值差异不大的模型作为备选模型,同时进行适合性检验,遗传模型参数差异达到显著性水平(<0.05)个数最少的模型确定为最佳遗传模型。如表2所示,穗长AIC值较小的3个模型为MX2-A-AD、MX2-ADI-AD和MX2-ADI-ADI,其AIC值分别为2 251.45、2 259.69、2 261.42,其中MX2-A-AD模型的AIC值最小,且达到显著水平的统计量仅有1个,因此,MX2-A-AD模型确定为穗长的最佳遗传模型,即2对加性主基因+加性-显性多基因混合遗传模型。小穗数AIC值较小的3个模型为MX2-ADI-ADI、PG-ADI 和MX2-ADI-AD,其AIC值分别为 3 024.68、3 034.64、 3 036.77,其中MX2-ADI-ADI模型的AIC值最小,且达到显著性水平的统计量最少(4个),确定为小穗数的最佳遗传模型。小穗粒数AIC值较小的3个模型为2MG-ADI、MX2-ADI-ADI 和MX2-A-AD,其AIC值分别为1 072.18、1 162.35、1 188.09,其中2MG-ADI模型的AIC值最小,且达到显著性水平的统计量较少(19个),确定为小穗粒数的最佳遗传模型。穗粒数AIC值较小的3个模型为PG-ADI、2MG-ADI和MX1-AD-ADI,其AIC值分别为5 698.20、5 698.98、 5 702.20,其中PG-ADI模型的AIC值最小,且达到显著性水平的统计量最少(0个),确定为穗粒数的最佳遗传模型。
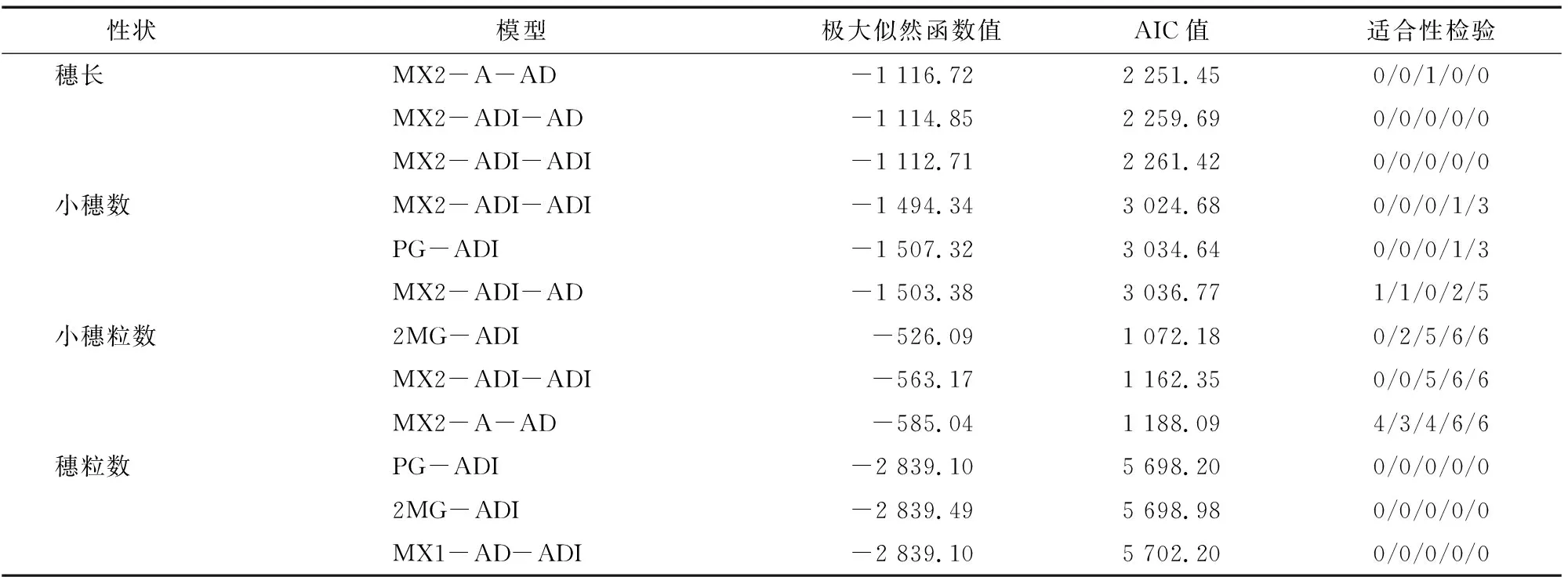
表2 穗部各性状候选模型的极大似然函数值和AIC值及其适合性检验
2.3 穗部性状遗传参数的估计
由最佳遗传模型的各成分分布参数估算一阶遗传参数(表3)和二阶遗传参数(表4)分析遗传效应。结果表明,穗长的最佳遗传模型为MX2-A-AD,3个分离世代(F、B和B)的遗传率(主基因遗传率+多基因遗传率)分别为81.15%、67.18%和72.38%,说明遗传因素占主要作用;控制穗长的2对主基因加性效应和分别为0.12和0.01,同时多基因加性效应[]为2.11,显性效应[]为0.80,均为正向效应,+=0.13<[]=2.11,说明穗长性状除2对加性主基因控制外多基因也起到重要的作用,易在早代进行选择。
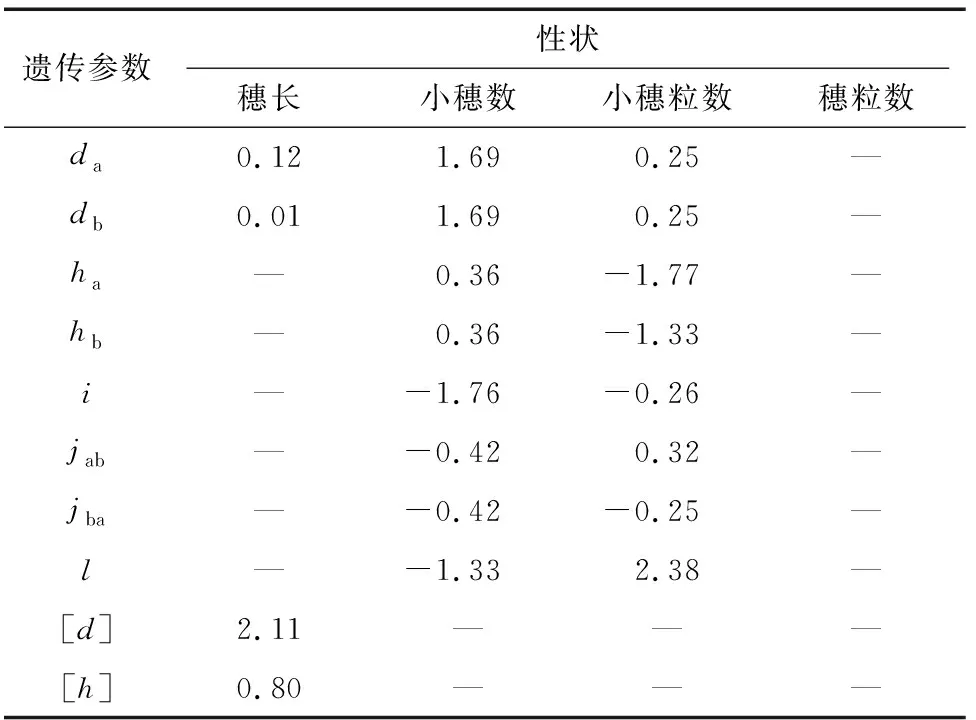
表3 穗部各性状最佳遗传模型的一阶遗传参数
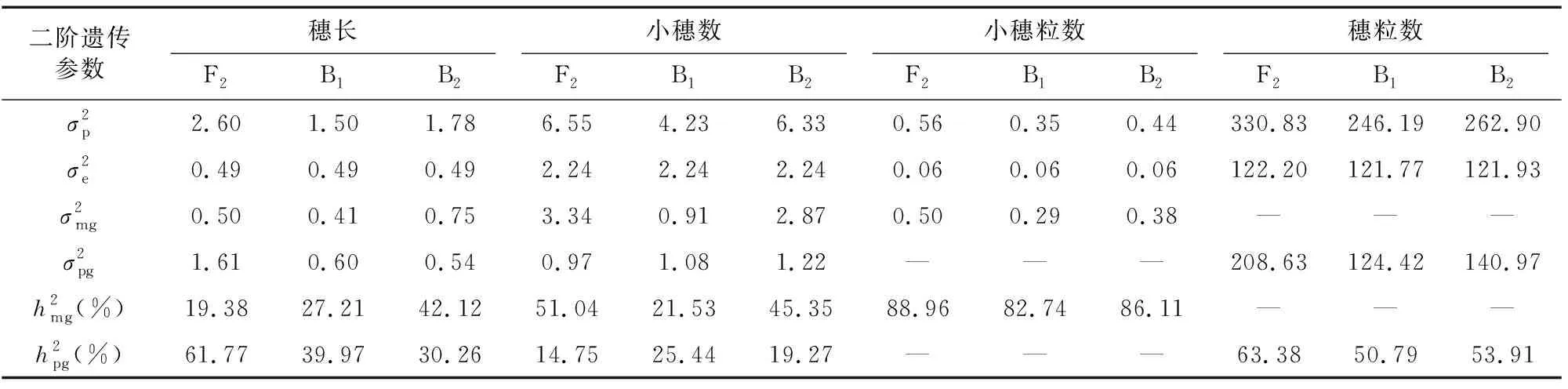
表4 穗部各性状最佳遗传模型的二阶遗传参数
小穗数的最佳遗传模型为MX2-ADI-ADI,3个分离世代(F、B和B)的遗传率分别为65.79%、46.97%和64.62%,说明遗传因素占主要因素,环境因素也有一定影响;控制小穗数的2对主基因为等加性等显性效应,==1.69,==0.36,且加性效应大于显性效应,+=3.38>+=0.72,均为正向效应,但上位性效应均为负向效应,=-1.76,=-0.42,=-0.42,=-1.33,||+||+||+||>||+||>||+
||,上位性效应>加性效应>显性效应,说明2个主基因共同作用时效果不好,单个主基因是最佳选择;同时F和B群体主基因遗传率(51.04%和45.35%)远大于多基因遗传率(14.75%和19.27%),为提高育种效率,易应用主基因的效应,采用单交及丰产亲本回交的方式构建群体在早代进行选择。
小穗粒数的最佳遗传模型为2MG-ADI,2对主基因具有正向的等加性效应(==0.25)和负向的显性效应(=-1.77,=-1.33),||+||>||+||,显性效应大于加性效应,显性×显性上位性效应=2.38,远大于其他上位性效应,占上位性效应的主要遗传组分,且为正向效应,说明2对主基因可能为隐性基因,且在稳定纯合时能起到较好的效果,因此小穗粒数易在高代进行选择。
穗粒数的最佳遗传模型为PG-ADI,3个分离群体(F、B和B)的多基因遗传率分别为63.38%、50.79%和53.91%,虽然遗传因素占主要因素,但环境因素影响也较大,说明穗粒数受多基因控制,无主效基因。
3 讨论
穗部性状的选择是小麦高产育种的重要环节,不同世代选择的重点和强度决定着能否选择出优良的品种(品系),采用植物数量性状遗传体系主基因+多基因混合遗传模型分离分析方法研究穗部性状的遗传规律对小麦种质资源创新、评价和应用提供了指导和理论依据。本试验利用小黑麦创制的大穗型小麦创新种质漯新001和丰产大粒型小麦创新种质漯丰4446构建6世代群体,对穗部性状进行了遗传分析。结果表明,穗长的最佳遗传模型为MX2-A-AD,2对主基因加性效应和分别为0.12和0.01,同时多基因加性效应[]为2.11,均为正向效应,多基因效应远大于主基因效应,说明穗长性状除2对加性主基因控制外多基因也起到重要的作用,这与毕晓静等的加性-显性-上位性多基因模型和魏艳丽等的2对加性-显性-上位性主基因+加性-显性多基因模型略有不同,与张安静等的研究结论一致,大穗穗长性状遗传力较高,在育种中可以加以利用。小穗数的最佳遗传模型为MX2-ADI-ADI,这与毕晓静等的小穗数受1对主基因+多基因控制的结论不同,但本研究控制小穗数的2对主基因为等加性等显性正向效应,表现为上位性效应均为负向效应,上位性效应>加性效应>显性效应,说明2个主基因共同作用时效果不好,选择含有单个主基因是最佳选择,这可能是有来自小黑麦的外缘基因在起作用。小穗粒数的最佳遗传模型为 2MG-ADI,与程洁等的小穗粒数受1对加性主基因控制的结论不同,2对主基因具有正向的等加性效应和较高的显性×显性上位性效应,但具有负向的显性效应,因此应在高代稳定纯合后显性效应逐渐消失时进行选择。穗粒数的最佳遗传模型为PG-ADI,F、B和B世代分离群体的多基因遗传率分别为63.38%、50.79%和53.91%,遗传因素占主要因素,但环境因素影响也较大,这与毕晓静等的研究结果一致。
大穗性状是深受小麦育种家和市场欢迎的优良性状,但要实现小麦高产的目标需要将大穗与多穗和大粒性状结合,本试验采用小黑麦创制的大穗型小麦新种质漯新001和人工合成小麦创制的大粒型丰产小麦新种质漯丰4446组配,通过优优组合对穗部性状的遗传规律进行综合分析,为实际生产提供指导。穗长由2对主基因和多基因共同作用,遗传效应以加性效应为主,F、B和B分离世代群体的遗传率分别为81.15%、67.18%和72.38%,遗传因素占主要作用,其中F世代群体的多基因遗传率和B世代群体主基因遗传率偏高,分别为61.77%和42.12%,育种选择时应采用单交和丰产亲本回交的组配方式,在获得主基因加性效应的同时兼顾多基因加性效应,利用遗传力高的特点在早代即开始选择。F、B和B分离世代群体小穗数的遗传率分别为65.79%、46.97%和64.62%,其中主基因遗传率分别为51.04%、21.53%和45.35%,育种时以主基因加性效应为主,其中B世代群体受环境因素影响较大,利用单交和丰产亲本回交的组配方式是较好的选择,由于2对主基因均具有负向的上位性效应,应在早代利用单个主基因效应进行选择。F、B和B分离世代群体小穗粒数的主基因遗传率分别为88.96%、82.74%和86.11%,3个分离群体均可收到较好的选择效果,结合2对主基因的特点,应在高代纯合后进行选择。F、B和B分离世代群体穗粒数的多基因遗传率分别为63.38%、50.79%和53.91%,其中在F和B世代群体的遗传率稍高,穗粒数受多基因控制,受环境影响也较大,育种时应采用早代适当扩大选择群体、高代纯合后多点多环境鉴定进行选择的策略。综上,对于本试验构建的6世代群体穗部性状的选择,育种选择时应采用单交和丰产亲本回交的组配方式,但考虑到单交不易聚合丰产亲本的其他优良丰产性状,为提高育种效率,易优先采用丰产亲本回交的方式组配构建选择群体。
4 结论
大穗型穗部性状的穗长最佳模型为MX2-A-AD,主基因+多基因遗传效应以加性效应为主,显性效应为辅,均为正向增效,易在早代通过基因加性效应的累加进行选择;小穗数的最佳模型为 MX2-ADI-ADI,以主基因遗传效应为主,2对主基因为等加性等显性正向效应,但具有较强的负向上位性效应,在F和B群体主基因遗传率高,在育种中易采用单交及丰产亲本回交的方式构建群体利用单个主基因的遗传效应在早代进行选择;小穗粒数的最佳模型为2MG-ADI,主基因遗传效应以显性效应为主,同时具有较强的正向显性×显性上位性效应,稳定纯合时能起到较好的效果,易在高代进行选择;穗粒数的最佳模型为PG-ADI,主要受多基因控制,F、B和B群体的多基因遗传率分别为63.38%、50.79%和53.91%,育种中要综合考虑多基因和环境因素的影响。大穗型穗部性状的选择易采用丰产亲本回交的方式(B世代群体)构建育种选择群体。
