FGF-18治疗骨关节炎的研究进展
2022-08-24杨振兴刘大鹏
杨振兴,刘大鹏
(新疆医科大学第五附属医院骨二科,新疆 乌鲁木齐 830011)
骨关节炎(osteoarthritis,OA)是一种常见的累及关节的疾病,并且呈逐年上升趋势[1-2]。骨关节炎的患者以关节疼痛、肿胀、压痛、僵硬等症状最为常见,严重时会导致残疾,极大地降低了患者的生活质量[3]。由于关节软骨缺乏自我愈合能力,目前尚未出现可以治愈的方法,因此治疗OA的重点在于减轻患者疼痛和改善关节功能状态[4]。药物治疗对缓解疼痛有比较优秀的疗效,成为目前比较主流的治疗方法,但另一方面应用药物治疗经常伴随着各种不良事件[5]。而新兴的再生疗法能够有效地促进组织的修复和再生,有效地促进了关节的修复。
成纤维细胞生长因子(fibroblast growth factor,FGF)-18是一种含有207个氨基酸,相对分子量为23731Da的蛋白。其在45-164氨基酸位点存在氨基酸保守核心,在FGF家族中第18个被发现,并于1998年首次报道[6]。FGF-18是与FGF-8和FGF-17具有高同源性的FGF,起源于神经外胚层细胞和各种间叶细胞[7]。FGF-18在骨骼生长和发育中发挥关键作用[8],尤其体现在软骨的形成和骨骼的发育作用上[9]。同时,FGF-18与软骨和骨的修复和重构有关,有望成为OA的靶向治疗药物。
1 FGF-18的调控通路及影响因素
1.1 FGF-18激活ATK及ERK调控通路 FGF-18通过与其内皮细胞上的成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)-3结合激活AKT和ERK通路(见图1)[10]。Yao等[11]通过小鼠关节腔内注射FGF-18,利用免疫印记实验后发现FGF-18通过磷酸肌醇3激酶(phosphoinositide 3-kinase,PI3K)-AKT信号传导促进了OA软骨细胞的增殖。同时发现FGF-18以剂量依赖的方式,通过PI3K信号促进软骨细胞的迁移。另一方面FGF-18通过PI3K-AKT信号负向调控白细胞介素(interleukin,IL)-1β诱导细胞凋亡,并进一步说明了FGF-18在早期治疗关节炎方面具有明显的研究意义。Chen等[12]通过化学合成FGF-18siRNA转染H460细胞后发现,在48 h内不同浓度的FGF-18显著促进H460细胞的增殖,并且证实了FGF-18通过ERK和p38信号传导的同时,增加G0/G1期和S期的细胞达成增殖。Yu等[13]通过细胞培养转染后发现,FGF-18通过调节ERK/c-Myc信号通路,促进了MDA-MB231细胞的增殖,并通过增加G0期细胞的比例调节细胞增殖。Zhai等[14]利用体外细胞培养并用噻唑蓝法(methyl thiazolyl tetrazolium,MTT)检测时发现40μg/mL剂量的FGF-18与对照组相比在72 h增强了MC3T3-E1细胞41%的活力,进一步发现第7天时该剂量显著减少了MC3T3-E1细胞中碱性磷酸酶(alkaline phosphatase,ALP)的活性。同时,FGF-18抑制了MC3T3-E1细胞中成骨细胞相关基因的表达和MC3T3-E1细胞中的矿物沉积。另一方面,FGF-18对MC3T3-E1细胞的治疗增加了ERK和磷酸化-ERK的蛋白表达水平,激活了ERK信号通路。综上所述,FGF-18可能通过ERK信号通路抑制MC3T3-E1的分化和矿物沉积。Xu等[15]使用MTT法发现融合Halo-FGF-18能够有效刺激NIH3T3细胞的增殖,并且呈剂量依赖性。更进一步发现Halo-FGF-18的作用机制不仅局限于NIH3T3细胞,其对ATDC5细胞也具有明显的增殖效应,并在促进增殖的同时可以通过调节ERK1/2信号定向调节ATDC5细胞的分化过程,间接说明了FGF-18可能作为一种促进软骨生长的新药物。
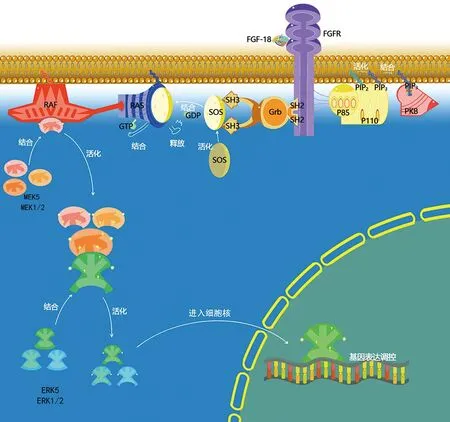
图1 ERK通路和AKT通路流程图
1.2 影响FGF-18的上游核酸结构 关节炎的易感性可能与FGF-18有关,一项包括2 556例的单核苷酸多态性基因标记关联分析发现FGF-18的遗传多态性与膝关节OA的风险显著相关[16]。Wang等[9]分析20例患者关节液后发现,对比无软骨损伤的关节液微小RNA(micro RNA,miR)-195显著增加的同时伴随着FGF-18的显著减少。进一步发现通过利用抑制剂转染下调miR-195可以促进软骨细胞的增殖和Ⅱ型胶原蛋白αI链的表达。Liu等[17]通过转基因杂交敲除细胞信号传导抑制剂(suppressor of cytokine signaling,SOCS)-3小鼠后发现,SOCS-3的过度表达降低了FGFR-3的表达并且伴随着丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号的减弱。一般情况下,FGFR-3在HEK293T细胞中的表达增加了FGF-18的MAPK磷酸化,因此SOCS-3通过调节FGFR-3依赖于FGF-18的MAPK信号在骺板软骨细胞增殖中发挥潜在作用。Wang等[18]分析了1 527例基因综合表达后发现在关节炎的患者中miR-21-5p存在过度表达,进一步通过实验发现敲除miR-21-5p的小鼠关节软骨的骨折出现更大程度的破坏,并且通过荧光素酶报告分析证实FGF-18是miR-21-5p的直接靶点。
1.3 影响FGF-18的体外分子结构 Imamura等[19]使用胶原蛋白膜(collagen membranes,CM)联合FGF-18诱导骨再生时发现对比单一CM,miR-133a的表达显著降低了37%~64%,miR-135a的表达显著降低了41%~50%。并且通过评估ALP活性,证实了CM联合FGF-18对MC3T3-E1细胞成骨分化的生物学作用。Yoshimura等[20]通过体外细胞实验利用逆转录聚合酶链式反应(reverse transcriotion-polymerase chain reaction,RT-PCR)和western blot技术发现Nymphaeol-C使FGF-18的Wnt通路中的β-catenin降低了38%,并进一步发现Nymphaeol-C显著降低了磷酸化ERK蛋白的含量,说明了Nymphaeol-C抑制FGF-18的表达,并影响FGF-18相关信号。Shu等[21]利用敲除了小鼠硫酸乙酰肝素基因并人工制造关节炎后发现,敲除基因的小鼠软骨细胞中FGF-18等蛋白表达显著降低。虽然有显著的关节软骨保护,但突变小鼠软骨下骨量并没有显著增加,相同的是突变小鼠骨生理体积显著降低。可以说明的是硫酸乙酰肝素在指导创伤后OA的发展中具有重要作用,进一步提示可能通过正向调控FGF信号来指导OA的转归,更进一步得出FGF-18可以促进早期软骨形成、软骨细胞成熟和关节组织的成骨。
2 FGF-18的体外细胞实验
2.1 FGF-18对软骨细胞的增殖 FGF-18的生物活性与软骨细胞增殖、炎症减少和退行性过程有关,主要靶向细胞为软骨细胞和成骨细胞[22],并且主要增殖对象为蛋白聚糖,糖胺聚糖及Ⅰ、Ⅱ型胶原蛋白。Shu等[23]利用体外培养牛髋、膝关节细胞发现FGF-18在培养21 d时可显著增大软骨中微质量颗粒,并明显促进软骨的发生。同时相比较Ⅱ型胶原蛋白,FGF-18对于Ⅰ型胶原蛋白的生长具有显著促进作用。Müller等[24]利用体外培养牛软骨细胞发现,经过100 μg/mL FGF-18处理实验组中细胞数量较对照组高了3.6倍,并显著增加了糖胺聚糖的含量。并且通过比较发现FGF-18是促进细胞增殖量最高的分子,但随之带来强烈的增殖可能是以牺牲基质的产生为代价来实现的。Häckel等[25]利用牛细胞体外培养经FGF-18处理后发现,蛋白聚糖和糖胺聚糖较对照组具有显著的提高,并进一步发现相关的DNA的表达及受体的表达较对照组也出现了显著的提高。然而,针对牛细胞和人细胞组间蛋白聚糖和糖胺聚糖的含量无明显统计学差异,证明FGF-18对细胞的种类不做区分。Frerker等[26]利用体外人软骨细胞培养发现,100 μg的FGF-18可以显著提高mRNA COL1A1水平,但是其中胶原蛋白的增加量明显不及骨形态发生蛋白(bone morphogenetic protein,BMP)-2。Gigout等[27]利用体外培养猪软骨细胞发现,FGF-18处理单层培养基时刺激了细胞增殖和Sox9的表达,另一方面在3D培养基FGF-18增加了产生基质的软骨细胞的数量。两个培养基中FGF-18都增加了Ⅰ、Ⅱ型胶原蛋白的含量和细胞外基质的容量。
2.2 FGF-18对软骨细胞分化的干预 FGF-18促进软骨细胞增殖的同时,通过抑制了基质金属蛋白酶(matrix metalloproteinase,MMP)的表达来定向刺激软骨细胞的分化。Huang等[28]利用体外培养脂肪源性干细胞发现添加FGF-18刺激了其与转化生长因子(transforming growth factor,TGF)-β3的软骨发生,并进一步发现FGF-18和TGF-β3对脂肪源性干细胞的软骨源性分化有协同作用。Chen等[29]利用体外培养人诱导多能干细胞RNA测序分析表明,与中心软骨相比,软骨样薄膜中人诱导的多能干细胞透明软骨组织颗粒FGF-18的表达更高,并且培养中加入FGF-18可以加速人诱导多能干细胞——软骨细胞的整合,这有助于实现关节软骨损伤患者的再生治疗。
3 FGF-18治疗OA的临床试验
FGF-18的体外及动物实验提示该药物具有临床应用的可能,并且已经进入临床试验阶段。本文列举了近年来的临床试验研究发现,FGF-18激活软骨细胞的增殖系统后,增加了膝关节软骨的厚度。Sprifermin是一种潜在的重组人FGF-18抗关节炎的药物[30]。既往动物实验中,100 μg剂量的Sprifermin能有效降低软骨的流失并且增加软骨细胞的增殖[31]。一项550例多中心参与的随机对照试验表明,与安慰剂组相比,膝关节MRI上关节腔内注射2年的Sprifermin的患者软骨厚度具有明显的增加[32]。在人工及自动化测量双重验证下,胫骨的内外侧中心、股骨的外侧中心对比安慰剂组均有显著的软骨厚度增加。两种独立的定量图像分析方法证明了相同的结果,并验证了Sprifermin可以有效减少膝关节软骨流失。一项474例大型多中心随机对照试验发现,试验组1(每6个月口服Sprifermin 100 μg)、试验组2(每12个月口服Sprifermin 100 μg)对比安慰剂组膝关节软骨厚度具有明显的增加[33]。另一方面试验组3(每6个月口服Sprifermin 30 μg)与安慰剂组膝关节软骨厚度差异无统计学意义,且3个试验组都出现了不同程度的并发症,其中最常见的为关节疼痛和背部疼痛。可以证明的是,口服不同剂量的Sprifermin可以增加患者软骨厚度,但目前尚不清楚对关节软骨厚度的增加是否会降低膝关节置换术使用率和延迟膝关节置换术时间的风险。Roemer等[34]的一项随机对照试验通过观察2年的Sprifermin的疗效后,其对软骨形态变化和骨髓疾病改善的呈现积极的影响。但是对于全膝关节骨生理差异、半月板半脱位的治疗及延缓半月板的退化方面,应用关节腔内连续3次注射30 μg和100 μg的Sprifermin对安慰剂组差异无统计学意义,这可能与螺旋纤维蛋白的作用机制有关。通过前期的实验Sprifermin已被证明是一种合成代谢药物[35],在实现软骨细胞增殖的同时使软骨细胞产生更透明清亮的细胞外基质[36]。Sprifermin在增加软骨厚度的同时减小了软骨的流失[37],30 μg剂量和100 μg剂量的Sprifermin对比安慰剂组在软骨流失方面差异有统计学意义。并进一步发现,每6个月30 μg、每6个月100 μg、每12个月100 μg剂量组在软骨增厚方面对比安慰剂组差异有统计学意义,呈现明显的剂量依赖关系,并且与注射的腔隙具体部位无关。Eckstein等[38]包含378例的一项大型随机对照试验,连续每6个月关节腔内注射Sprifermin 100 μg,从第3年开始到第5年西大略湖麦克马斯特大学(Western Ontario McMaster Universities,WOMAC)评分对比安慰剂组出现明显的提升。在并发症方面,关节痛是应用Sprifermin最主要的临床症状,但是频繁出现的不良事件和并发症中约79%与治疗无关,可以充分说明Sprifermin作为治疗膝关节炎潜在疾病修饰药物的安全性与可靠性。Sprifermin作为增加软骨厚度且可以减少软骨流失的一种药物,间接说明其改变了软骨的结构,可以作为治疗膝关节炎的潜在疾病修饰药物。Roemer等[39]的一项随机对照试验发现,关节腔内注射100 μg Sprifermin剂量组对比安慰剂组在1年后股骨、髌骨关节中心的软骨恶化的速度明显的减弱,同时骨髓病变在药物治疗6个月后对比安慰剂组差异有统计学意义。然而,骨生理学、半月板病理学、关节积液等方面差异无统计学意义,这也间接说明了药物对关节内不同结构的潜在影响。Lohmander等[40]的一项192例的大型随机对照实验发现,关节腔内注射Sprifermin能有效改善股骨、胫骨关节左侧中心软骨厚度,并对Sprifermin有剂量依赖效应。同时,100 μg剂量组相比安慰剂组能有效减少股骨、胫骨关节左侧中心的关节间隙狭窄,并显著改善患者的疼痛情况。在药物安全性方面,没有发现明显安全隐患,并且各剂量组与安慰剂组并发症发生率差异无统计学意义(见表1)。

表1 FGF-18临床试验
4 小 结
FGF-18是参与胚胎生长发育过程中的重要因子,并对软骨细胞增殖、炎症减少和退行性过程有着积极的作用。此外FGF-18通过ERK和AKT信号通路,增加了软骨细胞中Ⅰ型、Ⅱ型胶原蛋白和糖胺聚糖的含量,并显著增加并重组了细胞外基质。另一方面,FGF-18在显著增加软骨细胞数量的同时,亦干预了软骨细胞的分化过程,显著抑制了MMP的表达,诱导干细胞向软骨细胞表达。FGF18作为潜在的治疗骨关节炎的药物,能明显减少关节内关节软骨流失,增加关节内中心软骨厚度,同时拥有较少的药物副作用。因此,针对骨关节炎的治疗和改善预后,FGF-18可以作为一种潜在疾病修饰型抗关节炎药物。
