多囊卵巢综合征患者睡眠质量与代谢综合征的相关性分析
2022-08-24匡洪影李爽程显卓江昕桐侯丽辉
匡洪影,李爽,程显卓,江昕桐,侯丽辉
多囊卵巢综合征(polysystic ovary syndrome,PCOS)是常见于青春期及育龄期女性的内分泌紊乱性疾病[1]。代谢综合征(metabolic syndrome,MS)是一组以中心性肥胖、糖脂代谢异常和高血压为特征的内分泌紊乱症候群,与PCOS 具有相似的内分泌紊乱特征[2]。研究证实,大部分PCOS 患者均伴随不同程度的睡眠障碍[3],睡眠健康状况不佳,包括睡眠时长、时间、质量和睡眠呼吸障碍(sleep disorder breathing,SDB)等可能是PCOS 发病的危险因素[4]。与未患PCOS的女性相比,PCOS 患者更易出现睡眠障碍,但目前研究大多关注阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA),对主观睡眠质量和日间嗜睡等方面的研究较少[5]。本研究探讨PCOS 患者睡眠质量与MS的关系,以期为PCOS 患者睡眠障碍的防治提供参考,改善PCOS 患者生活质量。
1 对象与方法
1.1 研究对象选取2021 年4—10 月在黑龙江中医药大学附属第一医院(我院)妇科门诊就诊的信息完整有效的PCOS患者170 例,按照是否合并MS 分为PCOS 合并MS 组(A 组,40 例)、PCOS 无MS 组(B 组,130 例),另选取同期非PCOS的MS 患者(C 组,30 例)作为对照组。
PCOS 诊断标准参照《多囊卵巢综合征中国诊疗指南》[6]:必需条件为月经稀发或闭经或异常子宫出血。另外再符合下列2 项中的1 项:①雄激素升高的临床表现和(或)高雄激素血症;②超声下表现为多囊样卵巢:B 超见一侧或双侧卵巢直径2~9 mm 的卵泡≥12 个,和(或)卵巢体积≥10 cm3。并且排除其他可能引起高雄激素血症的疾病和排卵异常的疾病才能诊断。
MS 诊断标准依据修订联合委员会制定的2016 年《中国成人血脂异常防治指南》[7],具备以下3 项或更多项:①中心型肥胖和(或)腹型肥胖:腰围男性≥90 cm,女性≥85 cm;②高血糖:空腹血糖(fasting plasma glucose,FPG)≥6.10 mmol/L(110 mg/dL)或糖负荷后2 h 血糖≥7.80 mmol/L(140 mg/dL)及(或)已确诊为糖尿病并治疗者;③高血压:血压≥130/85 mmHg(1 mmHg=0.133 kPa)及(或)已确诊为高血压并治疗者;④空腹三酰甘油(triglyceride,TG)≥1.7 mmol/L(150 mg/dL);⑤空腹高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-c)<1.0 mmol/L(40 mg/dL)。
纳入标准:①年龄19~39 岁;②PCOS 诊断符合中国标准;③同意配合填写量表。排除标准:①近3 个月内应用激素类药物或近1 个月内服用可能会影响检测结果的中药、西药或中成药的患者;②患有甲状腺功能亢进、甲状腺功能减退、高泌乳素血症和垂体性闭经等疾病者[5]。
1.2 研究方法
1.2.1 由专人测量并记录3 组患者的一般资料及外在体征 包括体质量、体质量指数(body mass index,BMI)、腰围(waist circumference,WC)、臀围(hip circumference,HC)、腰臀比(waist-to-hip ratio,WHR)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)。
1.2.2 性激素指标 于月经周期第3~5 天清晨空腹采血,检测血清卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、睾酮(testosterone,T)、催乳素(prolactin,PRL)、雌二醇(estradiol,E2)、硫酸脱氢表雄酮(dehydroepiandrosterone sulfate,DHEAS)、雄烯二酮(androstenedione,AND)、性激素结合球蛋白(sex hormone binding globulin,SHBG)水平及LH/FSH 值。
1.2.3 糖脂代谢指标 所有患者均于清晨空腹采血,检测FPG、空腹胰岛素(fasting insulin,FINS)、血清总胆固醇(total cholesterol,TC)、TG、HDL-c、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-c)、载脂蛋白A(apolipoprotein A,ApoA)、ApoB 和脂蛋白,稳态模型评估的胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)=空腹血糖×空腹胰岛素/22.5。以上实验室指标均在本院测定并由专人进行数据收集。
1.2.4 睡眠状况的评价 患者就诊时在专业医师指导下填写睡眠状况自评量表(self-rating scale of sleep,SRSS)[8]并计算得分。此量表可以评估患者近1 个月的睡眠状况,量表中包含10 项睡眠因子,每项的评分均为0~5 分,总评分为10~50分。睡眠障碍分级标准:22 分及以下为睡眠状态正常,23~29分为轻度睡眠问题,30~39 分为中度睡眠问题,40~50 分为重度睡眠问题。
1.3 统计学方法采用SPSS 25.0 统计学软件进行数据分析。符合正态分布的定量资料用均数±标准差()表示,组间比较采用单因素方差分析,组间两两比较方差齐采用Bonferroni 法,方差不齐选择Tamhane’s T2 法;不符合正态分布的定量资料用中位数(四分位数)[M(P25,P75)]表示,组间比较采用Kruskal-Wallis 检验,组间两两比较采用Bonferroni 校正法。定性资料采用频数和构成比描述,多组等级资料组间比较采用秩和检验。非参数相关性分析采用Spearman 相关分析。P<0.05 为差异有统计学意义。
2 结果
2.1 纳入患者基本情况所纳入的170 例PCOS 患者中,睡眠状态正常者108 例(63.53%),轻度睡眠障碍者46 例(27.06%),中度睡眠障碍者16 例(9.41%),无重度睡眠障碍者。无PCOS 但存在MS的30 例患者中,睡眠状态正常者26 例(86.67%),轻度睡眠障碍者4 例(13.33%),无中、重度睡眠障碍者。A、B、C 组睡眠障碍者分别为18 例(45.00%)、44例(33.84%)和4 例(13.33%),各组睡眠障碍的程度差异有统计学意义(H=8.352,P=0.015),见表1。
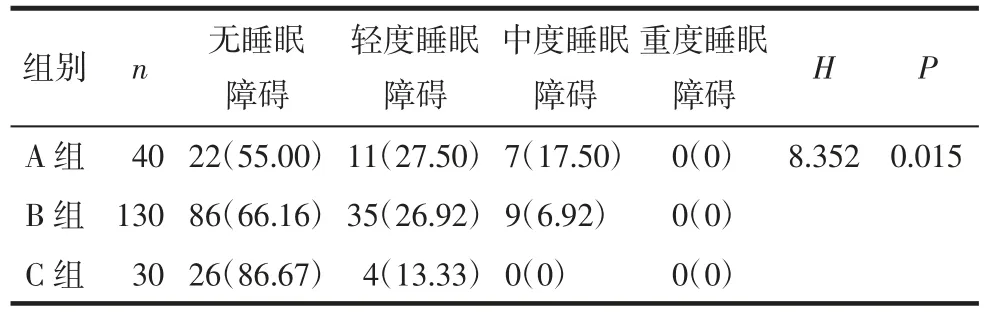
表1 3 组患者睡眠质量分布 [例(%)]
2.2 3 组临床特征分析3 组体质量、BMI、SBP、DBP 和WHR 比较,差异有统计学意义(P<0.05)。A组体质量、BMI、SBP、DBP 和WHR 均高于B 组(P<0.05);B 组体质量、BMI、SBP 和DBP 均低于C 组(P<0.05),见表2。3 组LH、LH/FSH、T、DHEAS、AND 和SHBG 水平比较,差异有统计学意义(P<0.05)。A 组LH、LH/FSH 和SHBG 水平低于B 组(均P<0.05),LH、LH/FSH、T、DHEAS 和AND 水平高于C 组(均P<0.05);A 组SHBG 水平低于C 组(P<0.05);B 组LH、LH/FSH、T、DHEAS 和AND 水平高于C 组(均P<0.05),SHBG 水平低于C 组(P<0.05);3 组FSH、PRL 和E2水平差异无统计学意义(均P>0.05),见表3。3 组FPG、FINS、TG、TC、LDLc、HDL-c、ApoB 和HOMA-IR 比较,差异有统计学意义(P<0.05)。A 组FPG、FINS、TG、TC、LDL-c、ApoB 和HOMA-IR 水平高于B 组(均P<0.05)。3 组ApoA、脂蛋白水平比较,差异无统计学意义(P>0.05),见表4。
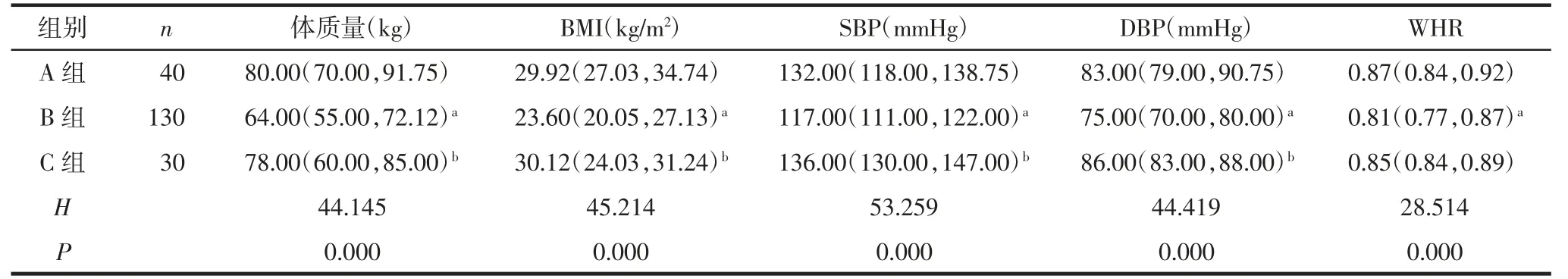
表2 3 组一般资料及外在体征的比较[M(P25,P75)]
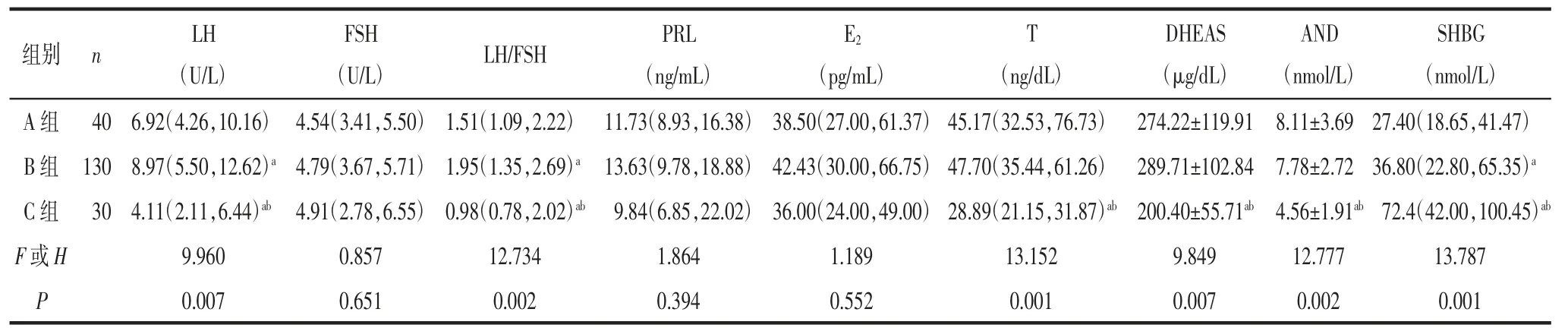
表3 3 组性激素指标的比较
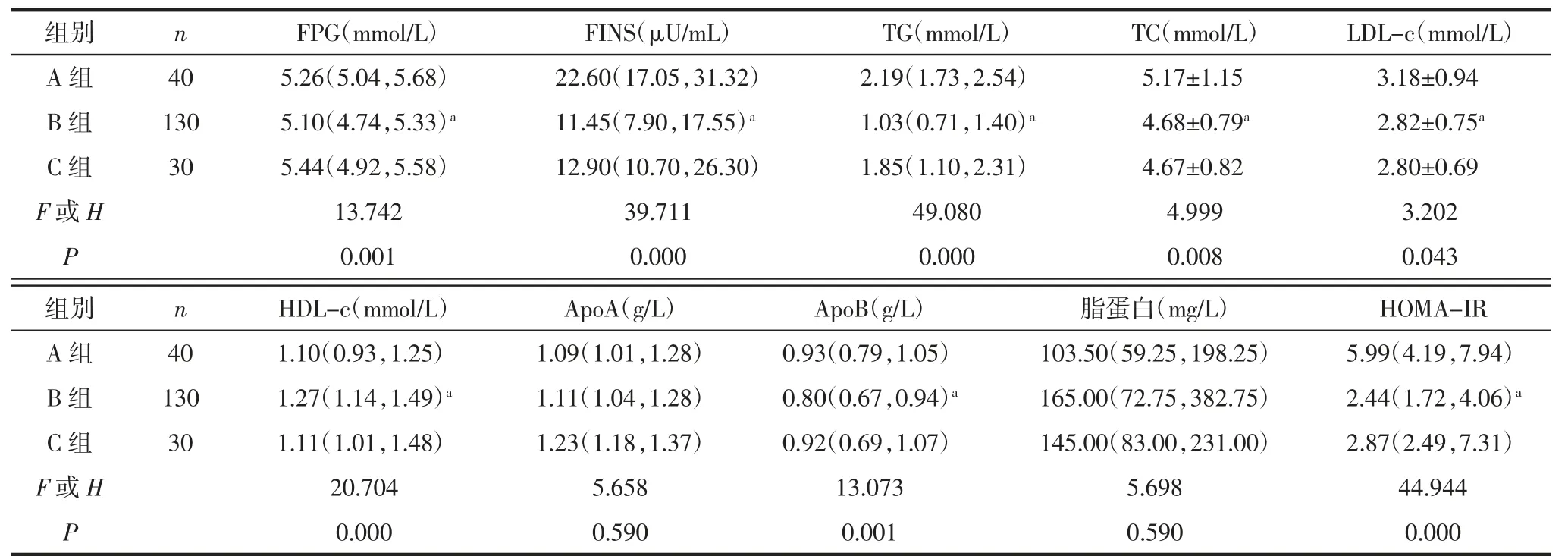
表4 3 组糖脂代谢指标的比较
2.3 3 组患者睡眠质量差异性分析见表5。3 组患者的睡眠时间、睡眠不稳、早醒、多梦或梦魇夜惊和SRSS 评分比较,差异有统计学意义(P<0.05)。A 组睡眠不稳、早醒及SRSS 评分高于B 组,差异有统计学意义(P<0.05);A 组睡眠时间、多梦或梦魇夜惊、SRSS 评分高于C 组,差异有统计学意义(P<0.05);B 组睡眠时间和SRSS 评分高于C 组,差异有统计学意义(P<0.05)。3 组间睡眠时长、睡眠质量、觉醒不够、入睡困难、服药情况、睡眠态度比较,差异无统计学意义(P>0.05)。
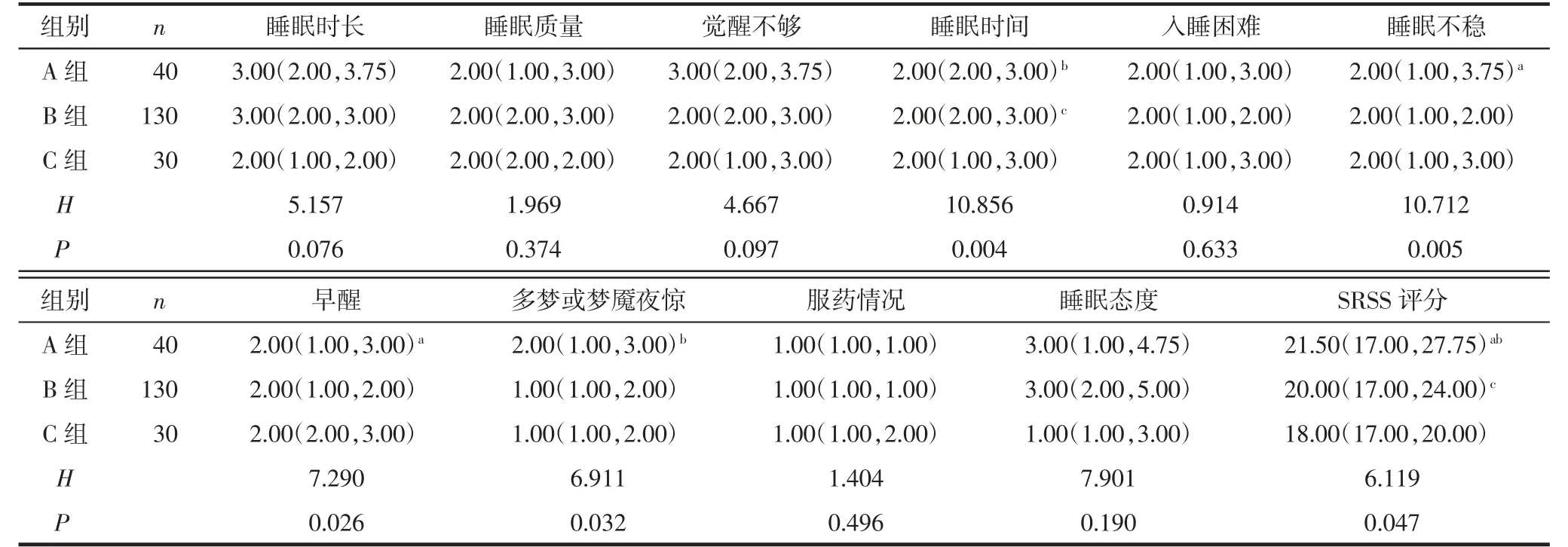
表5 3 组睡眠质量评分的比较 [分,M(P25,P75)]
2.4 PCOS 患者睡眠情况差异与MS 标志物相关性分析PCOS 患者睡眠不稳和早醒与TG 水平呈正相关(P<0.05),与HDL-c、FPG、SBP、DBP 和WC 水平无显著相关性(均P>0.05)。见表6。
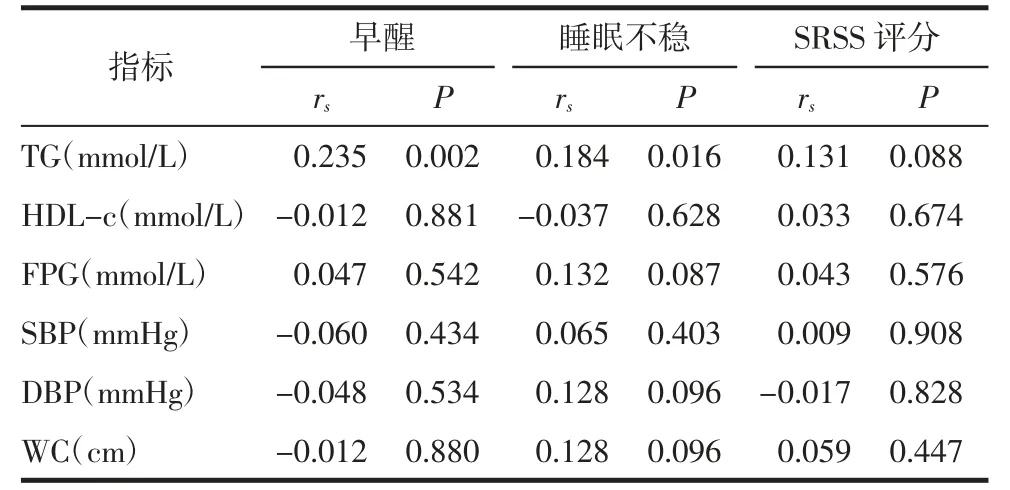
表6 PCOS 患者睡眠状况与MS 标志物相关性
3 讨论
PCOS 是一种复杂的生殖内分泌紊乱性疾病[9],睡眠障碍在PCOS 中很常见,且影响着PCOS 焦虑和抑郁的病因和发展,因此改善睡眠状态是治疗PCOS不可或缺的一部分[10]。Simon 等[4]对66 例青春期PCOS患者的研究发现,与无MS 的青春期PCOS 患者相比,伴有MS 的青春期PCOS 患者睡眠呼吸障碍的程度更严重,包括更高的呼吸暂停低通气指数和觉醒指数,PCOS 患者更多的不健康睡眠行为与代谢紊乱的严重程度增加有关。本研究共纳入200 例患者,A、B、C 组睡眠障碍率逐渐减小,3 组间睡眠障碍程度差异有统计学意义(P<0.05),这提示了PCOS 群体中睡眠障碍的真实存在。
本研究结果表明,PCOS 患者睡眠状况较差,A组患者SRSS 评分均高于其余2 组(P<0.05)。从SRSS 评分和睡眠差异与MS 标志物的关系两个方面进行评价,A 组较B 组有更严重的睡眠问题,且睡眠不稳、早醒与MS 标志物TG 水平呈正相关(P<0.05)。在对3 组患者进行临床特征差异性分析时发现,A 组患者具有高血压、超重或肥胖的同时伴有胰岛素抵抗、血脂异常等多种内分泌紊乱,表明睡眠质量和糖脂代谢紊乱可能存在相互影响,故MS 可能会增加PCOS 患者发生睡眠障碍的风险。TG 是心血管疾病的危险因子,这些观察结果预示睡眠质量差可以通过脂代谢失调进而增加PCOS 女性患冠心病的风险[11-12]。近年OSA 在PCOS 发病机制中的研究比较广泛,其是反复出现的完全性或部分上呼吸道阻塞性疾病,是睡眠障碍的一种常见类型,OSA 会增加夜间觉醒次数,改变睡眠结构。本研究中PCOS 患者出现早醒以及睡眠不稳可能与OSA 的间歇性低氧和睡眠碎片化有关,这种睡眠障碍可通过中间通路的相互作用导致代谢紊乱,其恶化代谢结局的潜在机制是多方面的,包括交感神经激活、脂代谢改变、氧化应激和线粒体功能障碍、促炎标志物释放,以及内皮功能障碍[13-14]。PCOS 女性胰岛素抵抗状态会增加OSA 的发生风险,可能与腹型肥胖有关[13],腹部脂肪堆积向上推压膈肌,导致肺容积减小和低通气状态。但本研究B 组中仍有显著的睡眠障碍的发生,提示PCOS 女性的睡眠障碍可能还与其下丘脑功能紊乱有关,内分泌系统在昼夜节律系统中具有重要作用,因此PCOS 很可能会干扰唤醒和睡眠模式,或者存在更复杂的相互关系[15]。同时PCOS 女性的睡眠障碍可能会进一步加剧胰岛素抵抗,恶化能量的平衡,并同时加重PCOS 的临床症状和远期并发症风险形成恶性循环,使机体发生一系列病理生理改变,引发高血压、心血管-代谢性疾病,以及神经认识功能障碍等不良结局[16]。
综上所述,在评估PCOS 患者的临床症状时,应结合主观睡眠质量、睡眠药物使用和日间功能障碍等中间因素加以考虑[17-18]。PCOS 应进行多维度的治疗,包括改善睡眠质量、生活方式及内分泌代谢功能,积极预测和预防远期并发症[19-20]。此外,临床上应将PCOS 女性睡眠健康作为常规筛查项目以期更好地理解睡眠在PCOS 中的作用。但目前对PCOS 患者睡眠障碍发病的解释仍存在一定的局限性,仍需更大的样本量和睡眠监测方法来阐述代谢紊乱严重程度与睡眠障碍之间的关系。
