美罗培南治疗重症肺炎的疗效及对炎症指标和免疫功能的影响
2022-08-24肖淑娜孟亚磊赵宏巧
肖淑娜 孟亚磊 赵宏巧
(河南科技大学第一附属医院药学部 洛阳 471003)
肺炎是临床常见的呼吸系统疾病,大多数患者症状较轻,总体预后好,而重症肺炎危害较大,若未给予及时的治疗,会出现极高的病死率[1]。相关报道称,重症肺炎死亡率居感染性疾病首位,在人类疾病总死亡率中位列第五位[2]。相关研究显示,重症肺炎患者体内存在明显的免疫功能异常和炎症介质水平失调,特别是T 淋巴细胞亚群比例异常,引发炎症级联反应甚至进展为多器官功能障碍综合征(Multiple Organ Dysfunction Syndrome, MODS),因此及时纠正患者免疫功能紊乱、减轻防御机制过度激活自身组织器官破坏对重症肺炎患者的治疗十分重要[3~4]。重症肺炎患者感染病原微生物种类较多,且大多对常规抗生素有耐药性,因此临床上多使用抗感染作用较强的美罗培南进行治疗,但其对机体免疫功能影响尚不明确[5]。基于此,本研究观察了美罗培南治疗重症肺炎患者的临床疗效及对炎症指标和免疫功能的影响,以期为临床治疗提供一定的参考依据。现报道如下:
1 资料与方法
1.1 一般资料 选取2019年1月至2021年6月在医院治疗的重症肺炎患者105例,经患者知情同意及并经医院医学伦理委员会审核(伦理批号:HNKJXDYFSYY-201804)。105例重症肺炎患者按照随机数字表法分为美罗培南(MER)组(n=53)和对照组(n=52)。MER 组男30例,女23例;年龄36~80岁,平均(60.84±7.52)岁;APACHEⅡ评分[7]10~34 分,平均(22.86±3.28)分。对照组男33例,女19例;年龄37~82岁,平均(61.70±7.18)岁;APACHEⅡ评分12~29 分,平均(19.24±3.75)分。两组一般资料对比无明显差异(P>0.05),具有可比性。
1.2 入组标准 (1)纳入标准:确诊为重症肺炎,参考标准为《中国急诊重症肺炎的临床实践专家相关共识》[6];年龄≥18岁;预计生存期超过7 d;签署知情同意书。(2)排除标准:伴有严重的肝、心、肾功能不全、肺部器质性病变、恶性肿瘤或血液系统疾病;存在免疫系统疾病或近期有使用免疫调节剂;对本研究药物过敏;合并精神障碍或无法配合治疗。
1.3 治疗方法 所有患者入院后进行常规肝肾功能、血常规、CT 及肺部X 线检查。对照组采用常规止咳、化痰、吸氧、营养支持、电解质平衡调节、抗感染等对症治疗。MER 组在对照组治疗基础上加用注射用美罗培南(国药准字J20140169)静滴治疗,取0.5 g 溶于250 ml 的0.9%浓度氯化钠(NaCl)溶液中,每8 小时给药1 次,治疗7 d。
1.4 观察指标 治疗结束后评价两组临床总有效率,记录28 d 内生存情况、机械通气时间和总住院时间,检测血清感染指标、T 淋巴细胞亚群及免疫球蛋白水平。(1)临床总有效率[8]:治愈,临床体征、症状、实验室和病原学检测结果均正常;显效,病情有所好转,但4 项中有1 项未恢复;有效,病情好转,但4 项中有2 项以上未恢复;无效,病情无明显好转甚至加重,临床总有效率=(治愈例数+显效例数+有效例数)/总例数×100%。(2)细菌清除率[9]:治疗结束后采集患者病原菌标本,检测不到对应病原菌,且无新病原菌出现视为病原菌已经清除。(3)血液指标检测:治疗前后采集患者6 ml 外周静脉血,取2 ml采用EDTA 抗凝,用流式细胞术对T 淋巴细胞亚群(CD3+、CD4+、CD8+) 水 平 进 行 检 测, 并 计 算CD4+/CD8+值;取4 ml 全血以3 000 r/min 的速度离心15 min 取血清层,利用免疫荧光法对血清降钙素原(PCT)水平进行检测,利用速率散射比浊法对C反应蛋白(CRP)含量进行检测,利用免疫比浊法对血清免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)及补体C3、C4 水平进行检测。
1.5 统计学方法 采用SPSS22.0 软件处理数据,以(±s)代表符合正态分布的免疫球蛋白等计量资料,行t检验;计数资料如总体疗效以%表示,行χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组炎症指标比较 治疗后两组PCT、CRP 均降低,且MER 组低于对照组(P<0.05)。见表1。
表1 两组炎症指标比较(±s)

表1 两组炎症指标比较(±s)
注:与同组治疗前比较,*P<0.05。
?
2.2 两组总体治疗效果比较 MER 组临床总有效率、28 d 生存率、细菌清除率均高于对照组,机械通气时间、住院时间均低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组总体治疗效果比较(±s)
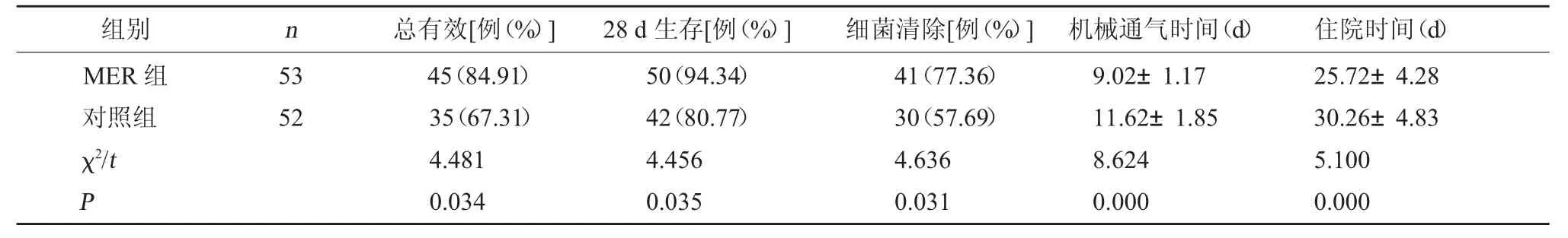
表2 两组总体治疗效果比较(±s)
?
2.3 两组T 淋巴细胞亚群比较 治疗后两组CD3+、CD4+、CD4+/CD8+均 升 高,CD8+均 降 低,且MER 组变化较对照组更明显,差异有统计学意义(P<0.05)。见表3。
表3 两组T 淋巴细胞亚群比较(±s)
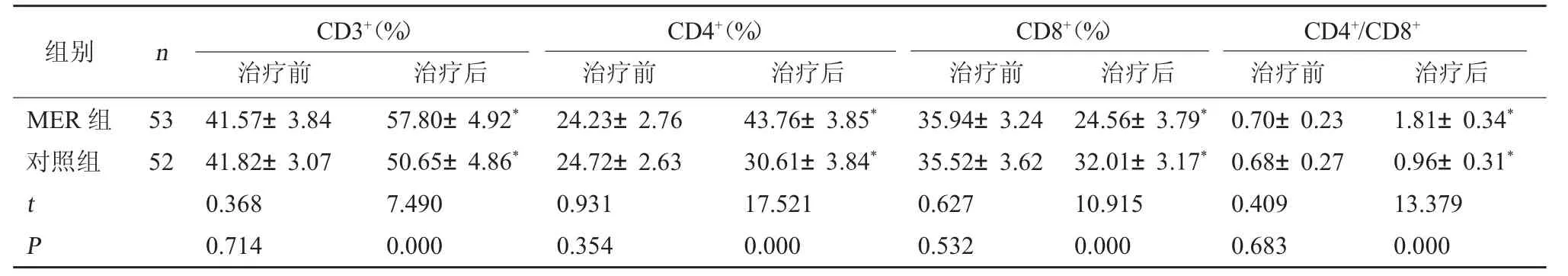
表3 两组T 淋巴细胞亚群比较(±s)
注:与同组治疗前比较,*P<0.05。
?
2.4 两组免疫球蛋白指标比较 治疗前后,MER组与对照组免疫球蛋白指标IgA、IgG、IgM、C3、C4水平组间比较,差异无统计学意义(P>0.05)。见表4。
表4 两组免疫球蛋白指标比较(g/L,±s)

表4 两组免疫球蛋白指标比较(g/L,±s)
?
3 讨论
重症肺炎具有起病快、病情进展迅速、感染不易控制的特点,多发于老年人群,预后较差[10]。随着临床对重症肺炎研究的不断深入,发现多种免疫细胞、炎症细胞及细胞因子参与发病过程,从而引发MOSD 和机体防御机制破坏[11]。相关研究认为,改善重症肺炎患者免疫功能对减轻炎症反应和改善患者预后具有重要意义[12]。
重症肺炎作为一种快速恶化疾病,临床在实际操作过程中往往等不到细菌检查结果出来就开始进行抗感染治疗,因此在抗感染药物选择上有许多盲区。MER 作为第二代碳青霉烯类抗生素,能穿透大多数革兰氏阳性菌、革兰氏阴性菌的细胞壁,到达作用靶点,即青霉素结合蛋白,从而有效抑制病原菌细胞壁中肽聚糖生长[13~14]。此外,MER 对肝肾功能影响较少,在治疗重症感染性疾病中的安全性和有效性已经被众多研究证实[15~16]。
本研究采用MER 治疗取得了较好效果,结果显示,MER 组临床总有效率、28 d 生存率、细菌清除率均高于对照组,机械通气时间、住院时间均低于对照组,提示MER 治疗重症肺炎具有较好细菌清除效果,能促进患者康复,有效提高生存率。炎症反应强度是影响感染性疾病进展的重要因素,PCT、CRP对反映全身性细菌感染具有较高的灵敏度和特异度,在肺炎的早期诊断中具有重要参考意义[17]。治疗后两组PCT、CRP 均降低,且MER 组低于对照组,提示MER 能明显降低体内炎症反应强度。
重症肺炎患者免疫功能的改善也尤为重要。已有研究发现,重症肺炎患者体内存在细胞免疫功能不足,伴随CD3+T 淋巴细胞比例减少和CD8+T 淋巴细胞比例增多[18]。相关研究也显示,采用注射胸腺肽α1进行免疫治疗能提高重症肺炎患者的临床疗效[19]。治疗前两组患者出现CD3+、CD4+、CD4+/CD8+下调,提示患者处于免疫抑制状态。治疗后两组CD3+、CD4+、CD4+/CD8+均升高,CD8+降低,且MER 组变化更明显,提示患者体内T 淋巴细胞亚群紊乱情况均明显改善,且MER 组效果更好,推测原因可能是MER 的杀菌作用较强,有助于机体免疫功能的自我调节和恢复。还有研究认为,MER 的强大杀菌效应能促进机体免疫防御功能的恢复[20]。相关研究显示,机体炎症反应强度和炎症介质水平的变化能反过来调节体内T 淋巴细胞的分化方向和其亚群比例,从而调节免疫功能,这可能是MER 能改善患者免疫功能的重要原因[21]。相关动物实验也显示,MER 能通过抑制内质网应激途径从而减轻淋巴细胞凋亡,调节体内免疫功能,对各个脏器起到保护作用,这可能是MER 能改善患者免疫功能的另一原因[22]。
治疗7 d 后,两组IgA、IgG、IgM、C3、C4 水平比较无明显差异,且两组治疗前后均无明显变化,提示MER 主要对T 淋巴细胞分泌产生影响,而对体液免疫无明显影响。还有研究认为,IgA、IgG、IgM、C3、C4水平与重症肺炎治疗转归关系不大[23]。也有研究发现MER 治疗重症肺炎14 d 后患者血清IgA、IgG、IgM 水平均改善,与本研究不符[24],这可能与本研究纳入患者例数较少、观察时间较短有关。
MER 治疗重症肺炎能提高患者生存率、减少住院时间,其作用机制可能与MER 抗菌作用及促进T淋巴细胞分泌、降低机体炎症反应有关。而MER 对免疫球蛋白水平无明显影响,提示其可能更多影响细胞免疫而非体液免疫,但具体原因有待进一步研究和论证。
