清热八味丸质量标准研究*
2022-08-24刘学良韩达斌年永琪汪永明王永晶刘海青
刘学良,韩达斌,陈 鹏,年永琪,汪永明,王永晶,刘海青
(青海省药品审评核查中心,青海 西宁 810007)
蒙药清热八味丸由石膏、人工牛黄、胡黄连、红花等8 味药材制成,有清热解毒功效,主要用于炽热、血热、脏腑之热、肺热咳嗽、痰中带血、肝火肋痛的治疗。始载于《卫生部药品标准·蒙药分册》[1],现行标准《国家食品药品监督管理局标准》中,检验项目有显微鉴别、理化鉴别及胆酸的含量测定。为了更全面控制该制剂质量,本研究中采用薄层色谱(TLC)法对方中人工牛黄、红花进行定性鉴别,同时采用高效液相色谱(HPLC)法对方中胡黄连的有效成分胡黄连苷Ⅰ、胡黄连苷Ⅱ进行含量测定。现报道如下。
1 仪器与试药
1.1 仪器
Waters 1525型高效液相色谱仪,包含Waters 2489型紫外检测器、Empower 化学工作站(美国Waters 公司);AB204-S型、ME204E型、XS105DU型十万分之一电子天平(瑞士Mettler Toledo 公司);Lambda 35 型紫外 - 可见分光光度计(美国PE 公司);硅胶H,G 薄层板(青岛海洋化工有限公司)。
1.2 试药
清热八味丸(内蒙古蒙药股份有限公司,批号分别为 090424,090614,100217,100526,101022,101212,111214);胡黄连苷Ⅰ对照品(国家标准物质中心,批号为MUST - 11062102,含量98%);胡黄连苷Ⅱ对照品(批号为111596 - 201805,含量93.2%),胆酸对照品(批号为110775-201105,含量98.9%),猪去氧胆酸对照品(批号为110749-201316,含量99.7%),均购自中国食品药品检定研究院。乙腈、磷酸、甲醇为色谱纯,其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 薄层鉴别
2.1.1 人工牛黄[2-5]
取样品适量,研细,称取粉末0.5 g,精密称定,加乙醇10 mL,振摇15 min,离心,取上清液,作为供试品溶液。取猪去氧胆酸对照品、胆酸对照品各适量,分别加乙醇制成每1 mL 含2 种成分1 mg 的单一对照品溶液。按清热八味丸处方和工艺制备缺人工牛黄的阴性样品,并按供试品溶液方法制成阴性对照品溶液。按2020 年版《中国药典(四部)》通则 0502 TLC 法,精密吸取上述溶液各5µL,分别点于同一硅胶G 薄层板上,以乙酸乙酯 - 正己烷 - 甲醇 - 冰醋酸(8∶1.5∶0.25∶0.25,V/V/V/V)为展开剂,展开,取出,晾干,喷以10%磷钼酸乙醇溶液,105 ℃加热至斑点显色清晰,置日光灯下检视。供试品溶液色谱中,在与对照品溶液色谱相应位置上显相同颜色斑点,且阴性对照无干扰。详见图1。

图1 人工牛黄薄层色谱图Fig.1 TLC chromatogram of Bovis Calculus Artifatus
2.1.2 红花[6-10]
取样品适量,研细,称取粉末4 g,精密称定,加80%丙酮溶液 20 mL,振摇 15 min,静置 10 min 后,取上清液,作为供试品溶液。另取红花对照药材0.5 g,同供试品溶液制备方法制成对照药材溶液。按清热八味丸处方和工艺制备缺红花的阴性样品,并按供试品溶液方法制成阴性对照品溶液。按2020 年版《中国药典(四部)》通则0502 TLC 法,精密吸取上述溶液各10µL,分别点于同一硅胶H薄层板上,以乙酸乙酯-水-甲酸-甲醇(7∶3∶2∶0.4,V/V/V/V)为展开剂,展开,取出,晾干,置日光灯下检视。供试品溶液色谱中,在与对照药材溶液色谱相应位置上,显相同颜色主斑点,且阴性对照无干扰。详见图2。

图2 红花薄层色谱图Fig.2 TLC chromatogram of Carthami Flos
2.2 胡黄连苷含量测定[11-17]
2.2.1 色谱条件
色谱柱:Hypersil - ODS 柱(250 mm × 4.6 mm,5µm);流动相:乙腈(A)-0.15%磷酸溶液(B),梯度洗脱(0~7 min 时 22%A→17%A,7~14 min 时 17%A,14~15 min 时 17%A→19%A,15~30 min 时 19%A→20%A,30~45 min时20%A→22%A);流速:1.0 mL/min;检测波长:266 nm;柱温:30 ℃;进样量:10µL。
2.2.2 溶液制备
取胡黄连苷Ⅰ对照品10.86 mg、胡黄连苷Ⅱ对照品11.70 mg,精密称定,分别置50 mL容量瓶中,加甲醇溶解、定容,摇匀,即得胡黄连苷Ⅰ,Ⅱ质量浓度分别为0.212 9,0.218 0 mg/ mL 的单一对照品溶液。各取4 mL,置20 mL 容量瓶中,加甲醇定容,摇匀,即得胡黄连苷Ⅰ,Ⅱ质量浓度分别为0.0425 8,0.0436 0 mg/mL的混合对照品溶液。取样品(批号100217)适量,研细,取1 g,精密称定,置锥形瓶中,精密加入甲醇50 mL,称定质量,超声(功率250 W,频率50 kHz)处理30 min,放冷,再称定质量,加甲醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。按清热八味丸处方工艺制备缺胡黄连的阴性样品,按供试品溶液制备方法制成阴性对照品溶液。
2.2.3 方法学考察
专属性试验:精密吸取2.2.2 项下混合对照品溶液、供试品溶液、阴性对照品溶液各10µL,按2.2.1 项下色谱条件进样测定,记录色谱图。结果待测成分与样品中其他成分分离良好,理论板数按胡黄连苷Ⅱ峰计应不低于3 000,阴性对照品溶液在与对照品溶液相同保留时间处无干扰峰,表明专属性良好。详见图3。
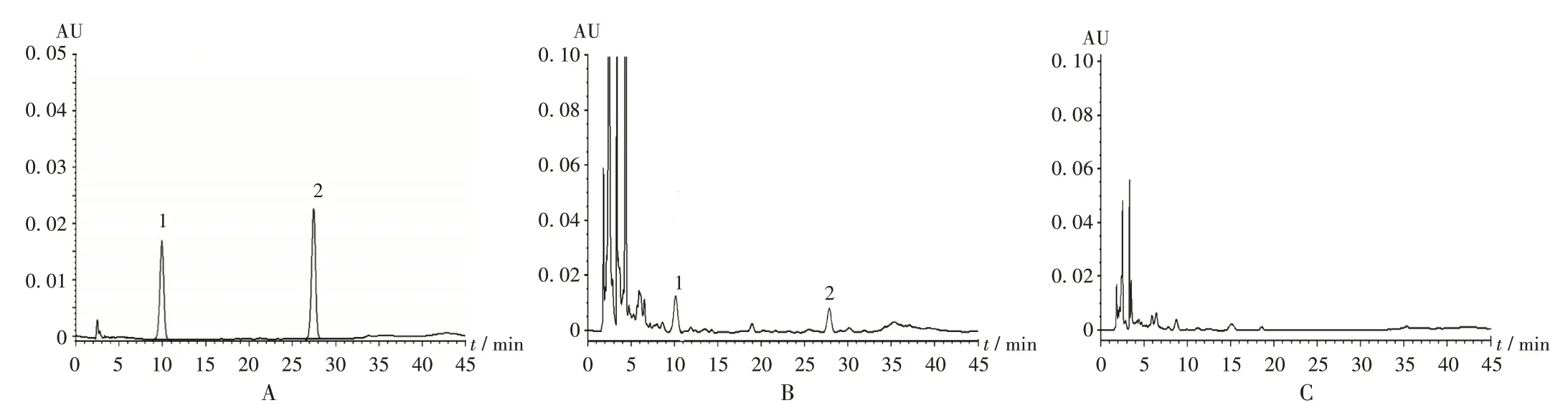
图3 高效液相色谱图Fig.3 HPLC chromatograms
线性关系考察:分别精密吸取2.2.2项下混合对照品溶液1,2,4,8,12,20 µL,按2.2.1项下色谱条件进样测定,记录峰面积。以待测成分进样量(X,µg)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程,胡黄连苷Ⅰ为Y1= 1 738 693X1+ 9 175(r= 0.999 8),胡黄连苷Ⅱ为Y2=1 286 879X2+1 344(r=0.999 7)。结果表明,胡黄连苷Ⅰ和Ⅱ进样量分别在0.042 58~0.851 6µg和0.043 60~0.872 0 µg 范围内与峰面积线性关系良好。
精密度试验:精密吸取2.2.2项下混合对照品溶液10µL,按2.2.1 项下色谱条件连续进样测定6 次,记录峰面积。结果胡黄连苷Ⅰ和Ⅱ峰面积的RSD分别为0.65%和0.52%(n=6),表明仪器精密度良好。
稳定性试验:取2.2.2项下供试品溶液10µL,室温下按2.2.1 项下色谱条件分别于第0,3,6,12,18,24 h进样测定,记录峰面积。结果胡黄连苷Ⅰ和Ⅱ峰面积的RSD分别为1.22%和1.06%(n= 6),表明供试品溶液在室温下放置24 h内基本稳定。
重复性试验:取同一批样品(批号100217)适量,精密称定,共5 份,按2.2.2 项下方法制备供试品溶液,按2.2.1项下色谱条件进样测定,记录峰面积并计算含量。结果胡黄连苷Ⅰ和Ⅱ的平均含量分别为1.049 0 mg/g和1.722 4 mg/g,RSD分别为1.12%和0.86%(n=5),表明该方法重复性良好。
加样回收试验:称取样品(批号100217)适量,研细,精密称定,共6 份,分别精密加入2.2.2 项下胡黄连苷Ⅰ和Ⅱ单一对照品溶液,各适量,按2.2.2 项下方法制备供试品溶液,按2.2.1 项下色谱条件进样测定,记录峰面积并计算加样回收率。结果见表1。
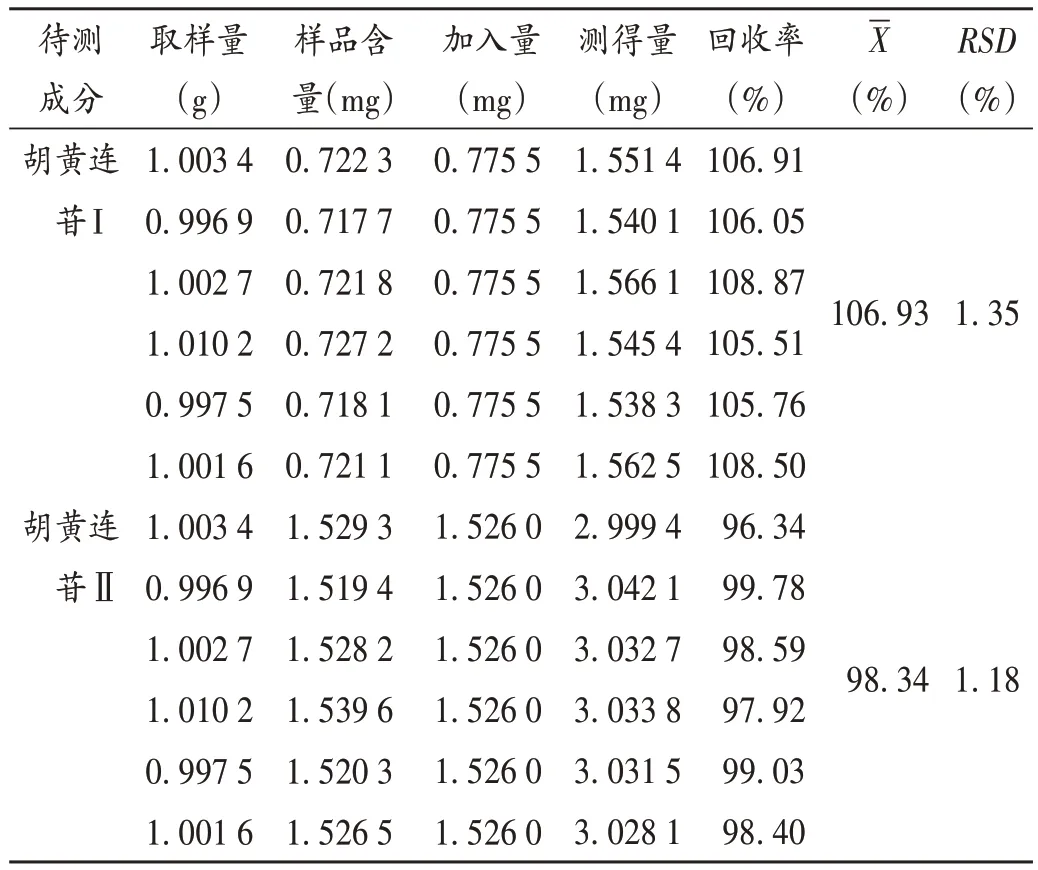
表1 加样回收试验结果(n=6)Tab.1 Results of the recovery test(n=6)
2.2.4 样品含量测定
取7 批样品各适量,分别按2.2.2 项下方法制备供试品溶液,再按2.2.1 项下色谱条件进样测定,平行测定3次,记录峰面积并计算样品含量。结果见表2。
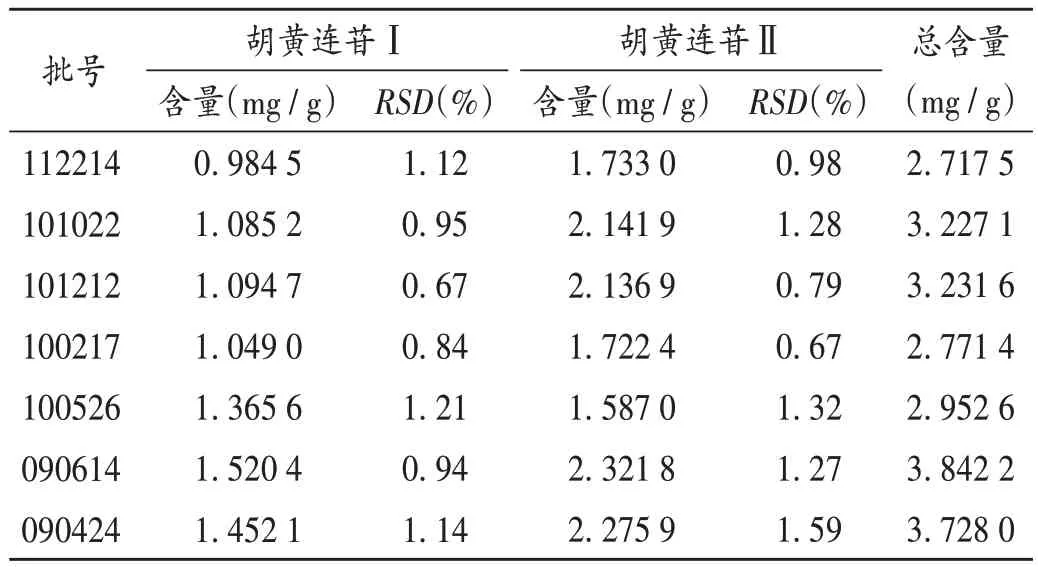
表2 样品含量测定结果(n=3)Tab.2 Results of content determination of picroside Ⅰand picroside Ⅱ in samples(n=3)
3 讨论
清热八味丸方中,人工牛黄可清热解毒、化痰定惊[18],红花可活血通经、散瘀止痛[19],胡黄连可清热燥湿、泻火解毒、通经利尿,且胡黄连中胡黄连苷Ⅰ和Ⅱ是其主要活性成分,具有较好的清热、杀菌及利尿作用[20],与清热八味丸清热解毒功效一致。本研究中基于预试验中对提取溶剂、提取方法、提取时间等因素进行的考察,建立了清热八味丸方中人工牛黄、红花的TLC鉴别方法,胡黄连中胡黄连苷Ⅰ和Ⅱ的HPLC 定量检测方法,可为今后研究清热八味丸质量标准提供依据。
含量测定预试验中,参考相关文献,同时结合胡黄连苷Ⅰ和Ⅱ对照品溶液的紫外光谱扫描结果,选择紫外检测波长为266 nm。同时分别对甲醇- 0.10%冰醋酸溶液、甲醇-0.15%磷酸溶液、乙腈-0.15%磷酸溶液3种流动相进行考察,结果以乙腈-0.15%磷酸溶液为流动相进行梯度洗脱时基线较平稳,对待测组分峰无干扰,故选择。
清热八味丸方中八味药材处方量相同,均为药材原粉入药制成水丸,胡黄连占处方总量的12.5%,2020 年版《中国药典(一部)》中规定,胡黄连中胡黄连苷Ⅰ与胡黄连苷Ⅱ的总量不得少于9.0%[21],原粉入药转移率按90%计算,得样品中两者总量的理论值下限为10.125 0 mg/ g,而本研究中7 批样品的含量为2.718 2~3.842 2 mg/g,明显低于理论值下限。分析原因,清热八味丸现行质量标准中未对胡黄连进行控制,企业在生产过程中可能存在以次充好或投料不足的情况。
清热八味丸与清热八味散、清热八味胶囊均收载于《卫生部药品标准·蒙药分册》,药味相同,处方量略有差异,但清热八味系列3种制剂的质量标准控制项目差异较大,部分项目制定的控制指标不尽合理。2020 年版《中国药典》中对胡黄连苷Ⅰ和Ⅱ的含量进行控制,然而,清热八味胶囊现行标准中仅以肉桂酸的含量作为质量控制指标,不合理,也缺少代表性。后续制订的控制指标要考虑与其功能主治紧密结合,可考虑同时对3 种剂型的清热八味制剂进行研究,尽量建立较统一、完善的质量标准。
