土壤中纤维素分解菌的分离与产酶条件测定①
2022-08-24温国琴
温国琴
(朔州师范高等专科学校,山西 朔州 036002)
0 引 言
纤维素是一种巨大的可再生资源,也是植物秸秆、木材、纸张、棉麻等的主要组分。自然界中能降解和利用纤维素的微生物种类繁多,真菌、细菌、放线菌属即部分酵母菌等主要的微生物类群中都含有。微生物对天然纤维素的快速降解与能量转化不仅仅是人类自然界中发生碳素能量转化的主要组成环节,也是天然土壤中的微生物进行能量转化代谢的主要能量来源,且可以利用天然纤维素降解微生物及其代谢产生的纤维素酶把天然纤维素物质转化为食品、饲料、医药、化工原料等产品,具有广阔的应用前景,对于不同种类纤维素分解菌的产酶活力和不同条件下产酶活性的研究同样具有重要的价值。
1 材料与方法
1.1 实验材料
土壤样品;平板培养基(CMC-Na刚果红培养基1,CMC-Na刚果红培养基2、羧甲基纤维素钠培养基);液体培养基;粗酶液;3,5二硝基水杨酸(DNS)显色液;0.1mol/L p H=4.6 CH3COOH-CH3COONa缓冲溶液;羧甲基纤维素钠溶液;葡萄糖标准溶液(1.0mg/m L)。
1.2 方 法
1.2.1 取样与处理
去除表层3cm土壤后采集下层土样。同时在距土壤表层10cm到15cm范围内埋下滤纸片,等待一周后采集土样,用无菌离心管盛装,称取10g土样加入100m L无菌水,充分混合摇匀,得到10-1土壤稀释液,逐步稀释制成10-2,10-3,10-4,10-5不同稀释浓度的土壤悬液。
1.2.2 纤维素分解菌初步筛选
吸取上述不同梯度的稀释液200μl,涂布于CMC-Na刚果红培养基及羧甲基纤维素钠培养基上。每个稀释梯度下各涂布三个平板,在37℃左右恒温培养一周,而后仔细观察CMC-Na刚果红培养基上的菌落周围是否形成透明圈。对羧甲基纤维素钠培养基上的菌落,刚果红染色10min后用1mol/L的NaCl脱色15min后仔细观察培养基上透明圈的形成情况。
1.2.3 纤维素分解菌的纯化
挑取羧甲基纤维素钠培养基上经染色后产生透明圈的菌落,在新的羧甲基纤维素钠培养基进行划线处理,编上菌落序号之后,放入37℃的培养箱中继续培养一周。
1.2.4 富集培养
将纯化培养基上长出的菌落与原菌落对比,确定无杂菌污染后用接种环挑取多个菌落于加入20μL无菌水离心管中混匀,将20μL的菌液接种于用于富集的液体培养基中,37℃160 r/min条件下震荡3d。
1.2.5 菌种鉴定
吸取10μL的菌液于EP管中,再加入30μL的25m M NaOH溶液,在98℃下加热10min,而后取5μL加入到PCR体系中,进行DNA扩增,经DNA凝胶电泳技术测定后判断扩增成功,则送去测序,并对测序结果进行BLAST分析,得出菌的种属。或直接挑取菌落于离心管中,直接加到PCR体系中,进行扩增。
1.2.6 产酶条件的研究[1]
1.2.6.1 葡萄糖标准曲线的绘制
分别吸取1.0mg/m L的葡萄糖标准溶液0.0,0.16,0.32,0.48,0.64,0.8m L,分别加蒸馏水至体系为0.8m L,各加0.6m L DNS显色液,煮沸5min,冷却后定容至10m L。在540nm波长下检测光密度的数值,以光密度值为纵坐标,对应标准葡萄糖的含量作为横坐标,绘制标准曲线。[5]
1.2.6.2 DNS法测定CMC酶活
取10m L小试管,加入CMC-Na溶液0.6m L置于40℃水浴中预热2~3min后加入0.2m L粗酶液,保温30min后马上加入0.6m L DNS显色液,沸水浴煮沸5min,冷却后定容至10m L,用分光光度计在540nm处比色测定记录各管的吸光度A1。
对照组空白样的处理中,加入所有试剂后直接沸水浴煮沸5min,冷却后定容至10m L,用分光光度计在540nm处比色测定记录吸光度A0。扣除空白值后得到的吸光值根据标准曲线得到还原糖含量。
羧甲基纤维素酶活(Carboxy Methyl Cellulase,CMCase)的测定[4]:一个酶活单位(International Unit,IU)定义为在40℃,p H=4.6条件下,1min内转化底物产生1μg还原糖所需酶量。
CMC酶活力的计算公式如式(1):
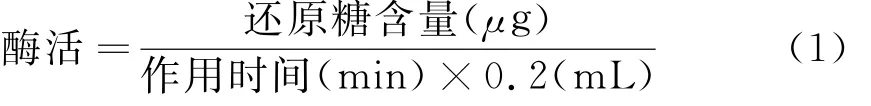
1.2.6.3 液体培养基初始p H对产酶的影响
调节液体发酵培养基的p H,p H值使用NaOH和KCl调节在5,5.5,6,6.5,7。
1.2.6.4 不同碳源对产酶的影响
液体发酵培养基的氮源不变,碳源分别采用饲料秸秆粉、滤纸、葡萄糖、蔗糖、CMC(10g/L),在p H值为5.5,37℃,160 r/min条件下振荡连续培养3 d,再进行CMC酶活力的分析测定。
1.2.6.5 不同氮源对产酶的影响
液体发酵培养基中的碳源保持不变,氮源分别采用蛋白胨、硫酸铵、草酸铵、尿素、柠檬酸(5g/L),在p H值为5.5,37℃,160 r/min条件下振荡连续培养3 d,进行CMC酶活力的分析测定。
2 结果分析
2.1 平板培养基筛选效果
在相同条件下接种土壤悬液。CMC-Na刚果红培养基1中菌落生长缓慢,菌落很小,不易于观察和测量;CMC-Na刚果红培养基2中菌株生长较快,菌落直径明显增大,但水解圈小,平板颜色深不易观察;羧甲基纤维素钠培养基平板上菌株生长速度较快,染色后纤维素分解菌水解圈大且非常清晰。
2.2 菌种筛选
通过观察菌落的直径与经过纤维素分解产生的水解圈直径的比值判断筛选得到纤维素分解能力较好的3株菌株:1,4,5,见表1。比较得到的4种具有一定的分解纤维素能力的菌株中1号菌的分解能力最强。

表1 3株菌株纤维素分解能力比较
2.3 菌种的形态特征观察
如图1,1号菌菌落较小,直径0.6mm,菌落呈 圆形,表面微微突出隆起,为不透明米白色或者灰白色,菌落表面干燥呈粗糙粉状,边缘不规则。菌落排列小而紧密,与培养基紧密结合。根据培养基上的菌落形态以及显微镜下的观察结果,可以确定1号菌为放线菌属,但由于PCR没有结果,因此没有进行进一步的菌种鉴定。

图1 (A)1号菌菌落(B)100x油镜下1号菌气生菌丝及孢子丝(C)100x油镜下1号菌基内菌丝
2.4 针对1号菌的产酶条件的测定[2]
2.4.1 葡萄糖标准曲线
绘制的葡萄糖标准曲线如图2所示。
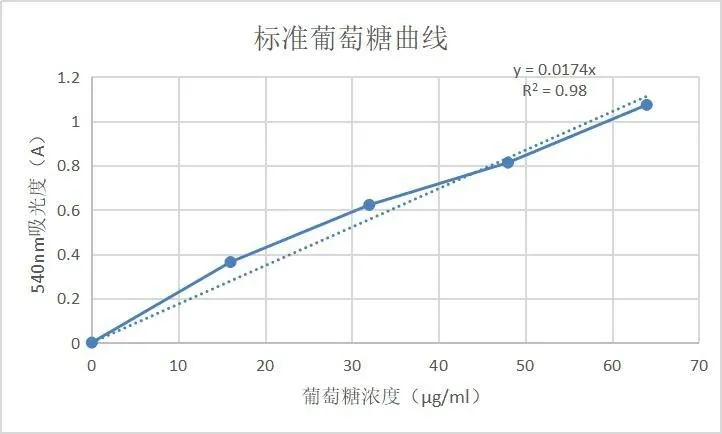
图2 标准葡萄糖曲线
2.4.2 液体培养基初始p H对产酶的影响:
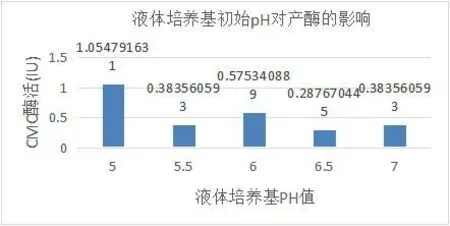
图3 液体培养基初始p H对产酶的影响
以DNS比色法对不同初始p H的液体培养基条件下CMC酶活进行测定,结果显示,在p H=5.0时酶活最高,其余p H条件下酶活较低,表明p H=5.0条件下该菌产酶活性最旺盛。
2.4.3 不同碳源对产酶的影响

图4 不同碳源对产酶的影响
以DNS比色法对不同碳源的各类液体培养基条件下的1号菌的CMC酶活进行测定,结果显示,以蔗糖为碳源的液体培养基中纤维素酶酶活最高,表明蔗糖作为菌株的营养物质,可能对该菌产生纤维素酶具有较好的诱导作用,而CMC和滤纸作为纤维素类物质,对产生纤维素酶具有较好的诱导效果。
2.4.4 不同氮源对产酶的影响[3]
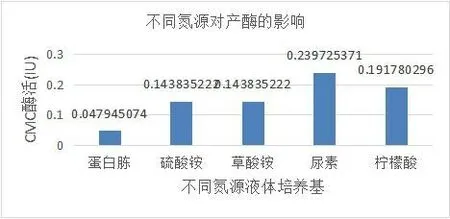
图5 不同氮源对产酶的影响
以DNS比色法对不同氮源的液体培养基条件下CMC酶活进行测定,结果显示,以尿素为氮源的液体培养基中酶活最高。CMC酶活力反应了纤维素酶将无定性的纤维素水解成纤维寡糖的能力,结果表明尿素作为各类培养基中的常用氮源,能够较好地促进该菌产生纤维素酶,柠檬酸作为一种有机酸,也能产生一定的促进作用,硫酸铵、草酸铵等含氮无机盐则仅有较小的促进作用。
3 讨论与总结
关于不同配比纤维素平板培养基和不同水解圈比较方法的实验中,分析认为:CMC-Na刚果红培养基1,CMC-Na刚果红培养基2,羧甲基纤维素钠培养基三者相比,CMC-Na刚果红培养基1中菌落生长缓慢的可能原因是碳源不足,菌株的正常生长受到一定限制。CMC-Na刚果红培养基2加大了碳源羧甲基纤维素钠的配比,菌株生长较快;羧甲基纤维素钠培养基与前两种不同的平板培养基相比,通过加入葡萄糖将原本培养基的唯一碳源纤维素改良成复合型碳源纤维素和葡萄糖,由于纤维素酶本身属于一种诱导型酶,生产纤维素酶的菌种生长需要将单糖如葡萄糖等作为营养来源,之后才能够通过纤维素诱导产生纤维素酶。同时,先培养后用刚果红染色的方式使得培养基背景颜色降低,水解圈非常清晰易于实验记录和观察。
在进行菌种的鉴定实验过程中,选择了水解圈较大的3种菌进行进一步的鉴定。其中4号菌确定为新鞘鞍醇杆菌,5号菌确定为内生链霉菌。1号菌在尝试了多种使菌裂解释放出DNA的方法:25m M NaOH溶液、在98℃下加热10min进行碱裂解;利用DNA试剂盒提取DNA,以及调整多次PCR程序设定进行扩增,依然没有PCR扩增成功。查阅文献得出虽然通用引物27F和1492R,适合放线菌DNA扩增,但是放线菌裂解非常困难,常用方法通常还需要有液氮进行处理,要求条件较高,实验室无法满足。
通过配制不同初始p H,不同碳源、不同氮源的液体培养基,对刚果红染色法筛选出的1号菌进行了产酶条件的研究,以DNS比色法进行CMC酶活测定,筛选的菌种最适宜的产酶条件为:液体培养基p H=5.0,以蔗糖为碳源,尿素为氮源。
