烟酸-辛伐他汀温敏凝胶的制备及降脂作用研究①
2022-08-24孙维彤张向宇
王 超, 孙维彤, 付 琳, 张向宇
(佳木斯大学药学院,黑龙江 佳木斯 154007)
0 引 言
高脂血症是间接加速动脉粥样硬化发病的原因之一,而内皮细胞本身合成的胆固醇增加和血浆中的胆固醇堆积,会引发一种慢性炎症[1],这种慢性炎症以及血管内脂质堆积引发的血流异常,均会引发人体局部的温度略高于正常体温。烟酸(nicotinic acid,NA)可以抑制脂甘油酯酶的活性,促进血浆TG的水解,并减少VLDL向LDL的转化[2];辛伐他汀(simvastatin,SV)是还原酶抑制剂,抑制竞争型胆固醇合成速度极限酶[3]。临床上为避免单一药物长期或大量用药后对患者身体的损伤,对烟酸类降脂药物烟酸与他汀类的辛伐他汀的联合研究逐渐深入。
温度敏感性水凝胶[4-6]是可以在液态与固态两相间转变特性的药物载体,低温或常温时呈现出流动的液体,而注射入体内后可以迅速凝胶化,且转变过程具有可逆性[7-8]。本研究将常用的血脂调节药物NA和SV作为模型药物,用温敏性药物载体PLGA-PEG-PLGA构建可以使药物传递并滞留在炎症发热部、可注射型温敏性载药递释系统,实现药物的缓释效果,为降脂药物新剂型的研究提供参考。
1 材料和方法
1.1 实验材料
UV-2550紫外可见分光光度仪(岛津仪器(苏州)公司);DF-101S集热式恒温磁力搅拌器(上海力辰邦西仪器科技有限公司);Hitachi7700型透射电镜(日本日立公司);Zetasizer Nano ZSE纳米粒度电位仪(英国马尔文公司);TGL-16G-C高速冷冻台式离心机(上海安亭科学仪器厂);Tecan Austria GmbH 5802自动酶标仪(Austria);烟酸(大连美仑生物技术有限公司);辛伐他汀(湖北康宝泰精细化工有限公司);聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯(济南岱罡生物工程有限公司);总胆固醇试剂盒、甘油三酯试剂盒、低密度脂蛋白胆固醇试剂盒、高密度脂蛋白胆固醇试剂盒(南京建成生物科技有限公司);其余试剂均为分析纯
雄性SPF级SD大鼠72只,180~220 g,购买于长春亿斯实验动物责任有限公司,合格证编号:201900030428,许可证号码:SCXK(吉)-2018-0007
1.2 NA-SV-PEP-HDs的制备
采用溶剂挥发法制备NA-SV-PEP-HDs,将一定量SV、PLGA-PEG-PLGA 200mg,与5 mL二氯甲烷充分溶解,形成有机相;另取水1 mL,加入烟酸(NA与SV的质量比为25:1),充分溶解形成水相。将水相以0.1mL/min匀速滴入高速旋转的有机相中,室温环境下继续搅拌,除去有机溶剂。离心除去游离药物后,过0.22 μm微孔滤膜,即得NA-SV-PEP-HDs溶液。同法制备SV-PEP-HDs。
1.3 分析方法的建立
1.3.1 NA分析方法的建立
线性曲线的绘制 取NA 0.0101 g,以水配成浓度为202 μg/mL的标准溶液,分别稀释成11.31,14.54,17.77,21.00,24.24,27.47,30.70 μg/mL的NA水溶液,依次检测262 nm处吸光度,绘制NA的线性曲线。
精密度及回收率测定 配制低、中、高浓度NA溶液,检测262 nm处吸光度,一日内平行测定5次,计算日内精密度;同一时间连续测定5日,计算日间精密度。取NA标准溶液适量,加入0.5 mL空白PEP-HDs溶液,以水稀释成低、中、高浓度的溶液,静置。检测262 nm处的吸光度A,计算回收率。
1.3.2 SV分析方法的建立
线性曲线的绘制 取SV 0.0105 g,用甲醇溶解,配成浓度为210 μg/mL的标准溶液,分别稀释成7.56,9.42,10.92,12.60,14.28,15.96,17.64 μg/mL的SV甲醇溶液,依次检测247 nm处吸光度,绘制SV的线性曲线。
精密度及回收率测定 配制低、中、高浓度SV溶液,检测247 nm处吸光度,一日内平行测定5次,计算日内精密度;同一时间连续测定5日,计算日间精密度。取SV标准溶液适量,加入0.5 mL空白PEP-HDs溶液,以甲醇稀释成低、中、高浓度溶液,静置。检测247 nm处吸光度A,计算回收率。
1.4 包封率与载药量的测定
采用离心滤膜过滤法测定包封率。取NA-SV-PEP-HDs溶液适量,10000 rpm离心10 min,上清液过0.22 μm微孔滤膜后,加适量乙腈超声;取一份以甲醇稀释,测定SV含量;再取一份以水稀释,测定NA含量,按公式(1)(2)计算SV,NA包封率与载药量。
(1)
(2)
其中,CSV-实测为实际测得NA-SV-PEP-HDs溶液中包封的SV的浓度,CSV-总为投入的SV的浓度;WSV为SV的总投药量,WPEP为载体PEP的总质量。CNA-实测,CNA-总,WNA同理。
2 NA-SV-PEP-HDs的质量评价
2.1 NA-SV-PEP-HD透射电镜观察及粒径分布、Zeta电位测定
根据最优处方和工艺制得NA-SV-PEP-HDs,采用透射电子显微镜观察其形貌;使用激光粒度分析仪测定NA-SV-PEP-HDs粒径大小,PDI及Zeta电位。
2.2 体外温敏性考察
采用试管倾斜法[9]进行体外温敏性考察。取储存于4 ℃条件下的PEP-HDs,NA-SV-PEP-HDs各3 mL于试管中,将温度计放入凝胶液面下三分之一处后,置于水浴锅内,缓慢升温。每隔1 min将试管从水浴锅中取出,将试管倾斜90°观察凝胶溶液的状态,当溶液转化为凝胶状态时,此时的温度为凝胶化温度。
2.3 体外释药考察
采用无膜溶出法进行体外释放考察[10]。取“1.2”项下制备的NA-SV-PEP-HDs溶液6份各2 mL,置于西林瓶中,将其放入38±0.5 ℃,50 r/min的恒温水浴振荡器中,预热10 min使凝胶溶液充分地凝胶化。沿西林瓶壁缓慢加入3.0 mL含0.5%Tween-80pH7.4 PBS的释放介质。分别于0,2,4,8,12,24,36,48 h后每隔1 d时,迅速倒出全部释放介质,另加入3.0mL等温释放介质,连续15 d。采用UV法测定SV,NA的含量,绘制NA-SV-PEP-HDs的体外释药曲线。
2.4 体内药效学研究
2.4.1 动物造模及给药
适应性喂养一周后,将其随机分为9组(n=8):正常组(NC),模型组(MC),阳性组(PC),SV-PEP-HDs低(L-SV),中(M-SV)、高剂量组(H-SV),NA-SV-PEP-HDs低(L-NA)、中(M-NA)和高剂量组(H-NA)。NC组灌胃生理盐水6.25 mg/(kg·d),其它组灌胃等剂量高脂乳剂,两周后,检测是否造模成功。造模成功后,PC组注射藻酸双酯钠6.25 mg/kg/d;SV及NA-SV联用低、中、高剂量组注射药量分别为0.5,1,2 mg/(kg·d)和1,2,4 mg/(kg·d);NC、MC组注射生理盐水。
2.4.2 Lee’s、肝脏指数
末次给药后,各组大鼠禁食24 h后进行称重,将大鼠注射4 %的水合氯醛0.35 mg/kg麻醉后,测定大鼠的体长(鼻尖到肛门);于大鼠腹主动脉迅速取出5 mL血液;分离出肝脏并称重。根据公式(3),(4)计算,其中L为大鼠的体长(cm),m为大鼠的重量(g),m1为肝重(g)。

(3)

(4)
2.4.3 肝脏组织病理学观察
取肝脏左叶部分组织,固定于4 %多聚甲醛溶液。一部分组织包埋后切片,进行HE染色;另取一部分进行油红O染色;采用电子显微镜,观察肝脏病理切片中肝细胞有无脂肪性变、炎症浸润或细胞病变。
2.4.4 血清血脂水平检测
将冻存的血清在4 ℃冰箱中解冻24 h,再经室温缓冲30 min,采用单试剂COD-PAP和GPO-PAP法对TC与TG含量进行测定,双试剂直接法测定HDL-C与LDL-C含量。根据试剂盒说明操作,采用酶标仪进行测定。
3 结果与讨论
3.1 方法学的建立
(1)线性曲线的绘制
以吸光度为纵坐标,浓度为横坐标绘制NA和SV线性曲线方程,分别为A=0.0268C-0.0272,r=0.999,结果表明,NA在11.31~30.70μg/mL范围内线性关系良好;A=0.0416 C-0.036,r=0.999,结果表明,SV在7.56~17.64μg/mL范围内线性关系良好,如图1所示。

图1(a)烟酸的线性曲线 (b)辛伐他汀的线性曲线
(2)日内精密度和日间精密度考察
实验得到三个浓度NA溶液的日内精密度RSD分别为1.15 %,0.75 %,0.64 %;日间精密度RSD分别为0.88 %,0.75 %,0.47 %日内及日间精密度的RSD值均小于2 %,符合方法学的要求。
实验得到三个浓度SV溶液的日内精密度RSD分别为1.84 %,1.57 %,0.78 %;日间精密度RSD分别为1.97 %,1.38 %,0.62 %日内及日间精密度的RSD值均小于2 %,符合方法学的要求。
(3)回收率考察
实验得到三个浓度为14.54,21.00,27.47μg/mL的NA溶液的回收率分别为99.98 %,100.59 %,100.32 %,回收率高,RSD值分别为1.3 %,0.7 %,0.95 %小于2 %,符合方法学的要求。
实验得到三个浓度为9.24,12.60,15.96μg/mL的SV溶液的回收率分别为100.47 %,100.13 %,100.06 %,回收率高,RSD值分别为1.03 %,0.73 %,0.56%小于2 %,符合方法学的要求。
3.2 NA-SV-PEP-HD透射电镜观察及粒径分布、Zeta电位测定
NA-SV-PEP-HDs表面圆整类球形,未见团聚现象,粒径分布相对均一,且平均大小在100 nm以内;平均粒径为(61.8±1.47)nm,粒度分布呈单峰,PDI为(0.203±0.098),平均电位为(-1.01±1.83)mV,如图2所示。

图2 (a)NA-SV-PEP-HDs透射电镜扫描图(b)NA-SV-PEP-HDs粒径(c)电位
3.3 包封率和载药量
计算得到3批NA-SV-PEP-HD中NA和SV的包封率为(95.8±0.50)%和(83.8±0.20)%,载药量为(12.31±0.36)%和(0.45±0.02)%。
3.4 体外温敏性
实验结果显示,NA-SV-PEP-HDs对体外的温度刺激响应性较为灵敏,且具有可视性,如图3所示。
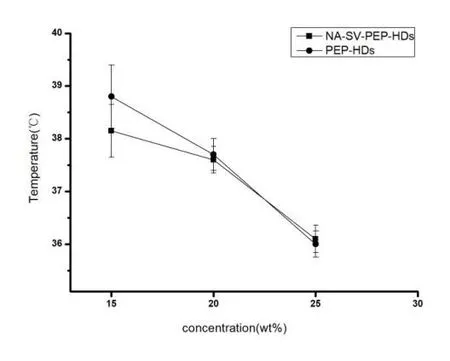
图3 体外温敏性测定结果(n=6)
3.5 体外释放
NA-SV-PEP-HDs中SV在前12 h内释放缓慢;12-48 h时释放速率增加,累计释放量达到30%;在216 h时,累计释放量达到80%,最终大约有92.99%的SV释放出来。相比SV而言,NA在第36 h有30%被释放,此后释放速率逐渐趋于平缓;第240 h时累计释放量达到80%;最终累计释放量为89.12%。实验表明,亲水性药物NA和疏水性药物SV药物的释放缓慢,均无突释效应,说明NA-SV-PEP-HDs达到缓释效果,如图4所示。
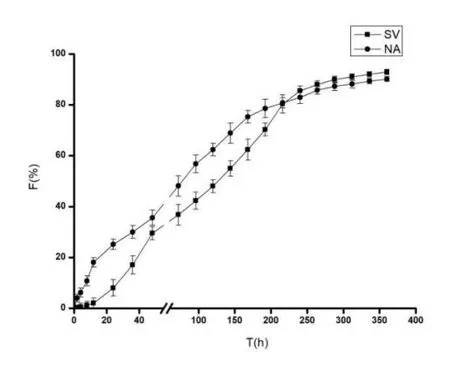
图4 NA-SIM-PPP-HDs在pH7.4 PBS
3.6 体内药效学研究
3.6.1 Lee’s,肝脏指数
与MC组相比,各治疗组Lee’s指数均显著降低;治疗药物对肝脏指数的影响极为明显(P<0.0001),且H-NA组最为显著;说明药物干预后,可有效缓解大鼠肥胖程度,如图5所示。

图5 (a)大鼠Lee’s指数测定结果(b)大鼠肝脏指数测定结果(n=6)
3.6.2 肝脏组织病理学观察
MC组大鼠肝脏颜色变浅、有明显的增肥增大;MC组HE染色可见小叶结构出现紊乱;油红O染色中脂肪滴的减少尤为明显。结果表明,高脂乳剂可成功建立高脂模型,通过药物治疗后,可逆性病变可以得到缓解,如图6-8所示。

图6 肝脏外观(由左至右依次为正常组、模型组、治疗组)

图7 肝脏病理切片HE染色

图8 肝脏病理切片油红O染色
下的体外释放情况(n=6)
3.6.3 血清血脂水平检测
各治疗组大鼠血清TC水平与MC组相比显著降低(**P<0.01);SV-PEP-HDs三剂量组TG均高于NA-SV-PEP-HDs对应剂量组,且H-NA组血清TG值低于PC组(*P<0.05,**P<0.01);相比MC组,PC,NA-SV-PEP-HDs三剂量组血清HDL-C水平均显著升高(*P<0.05,**P<0.01)。NA-SV-PEP-HDs三剂量组对血清LDL-C水平降低作用显著(*P<0.05),具有统计学意义,结果表明,药物干预各组对高脂血症均有治疗作用;且NA与SV联合比SV单药组的治疗效果更好,如图9所示。

图9 (a)TC测定结果(b)TG测定结果
(由左至右依次为正常组、模型组、治疗组)
(由左至右依次为正常组、模型组、治疗组)
(c)HDL-C测定结果(d)LDL-C测定结果(n=6)
4 结 论
本实验采用溶剂挥发法制备NA-SV-PEP-HDs,并对其进行基本理化性质的考察,证明体外温度刺激响应较为灵敏。体外释放结果显示NA-SV-PEP-HDs具有缓释作用;高脂血症模型组大鼠Lee’s指数均显著升高,肝脏指数明显减小,血脂水平出现异常,肝组织结构紊乱,说明高脂乳剂可以成功建立大鼠高脂模型。与MC组相比,各药物干预组大鼠的血清及肝匀浆液中TC,TG,LDL-C含量均有降低,HDL-C含量均有升高,表明SV-PEP-HDs和NA-SV-PEP-HDs对高脂血症均有治疗作用;且NA-SV-PEP-HDs对各项指标的改善作用更显著于SV-PEP-HDs,说明双载药温敏系统更有效的治疗高脂血症。
