抗CD47抗体Hu5F9真核表达载体构建与表达
2022-08-24张静静邢体坤宋路萍安文琪
范 蓓 张静静 邢体坤 刘 伟 王 斌 宋路萍 安文琪
1.华兰生物工程股份有限公司研发部,河南新乡 453000;2.河南晟明生物技术研究院有限公司重组细胞室,河南新乡453500;3.华兰基因工程有限公司质量控制部,河南新乡 453500;4.华兰基因工程有限公司研发部,河南新乡 453500
白细胞分化抗原47(cluster of differentiation,CD47)是一种膜蛋白,属于免疫球蛋白超家族,在正常细胞与肿瘤细胞中普遍表达。肿瘤细胞通过大量表达CD47,与巨噬细胞表面的抑制性免疫受体信号调节蛋白α(signal regulatory protein α, SIRPα)结合,抑制其吞噬作用,从而产生免疫逃逸,在肿瘤发生发展过程中表现出至关重要的作用。Hu5F9 是一种抗CD47 抗体,通过与CD47 结合,有效增强了巨噬细胞对癌细胞的吞噬作用,同时研究人员通过将互补决定区移植到人IgG4 支架上使其获得人源化改造,对人CD47 有较好的亲和力,并在体内多种肿瘤模型中表现出有效的抗肿瘤活性。哺乳动物细胞具有类似人源细胞的翻译后修饰,例如蛋白的糖基化等,因此相较于细菌、酵母、植物和昆虫等宿主细胞,哺乳动物细胞更适合表达重组蛋白药物。中国仓鼠卵巢细胞(Chinese hamster ovary cell,CHO)是最常用的哺乳动物表达系统,能够在无血清、无蛋白的条件下进行高密度悬浮培养,可以避免血清的复杂组分的影响,提升了生产的安全性、 稳定性及法规方面的便利性,更加适合大批量工业化生产应用。同时CHO 内源性蛋白分泌较少,也更利于分离纯化目的蛋白。目前,针对SIRPα-CD47 信号通路,已有多款药物正在研究开发中,其中以Hu5F9 进度最快,研究最为全面,国内也有多家企业布局CD47 项目。本研究选用CHO-S系统来表达Hu5F9 重组蛋白,旨在为CD47 抗体药物的研究开发提供一定的实验基础。
1 材料与方法
1.1 材料
pUC57-Hu5F9-H 和pUC57-Hu5F9-L 为生工 生物工程(上海)股份有限公司合成;pCGS3 空载质粒为华兰生物构建保存;CHO-S 细胞为本实验保存。
1.2 主要试剂
DH5α 大肠感受态(B528413)、琼脂粉(A505255)、Protein A 蛋白纯化试剂盒(C600048-0001)购自生工生物工程公司;细胞所用培养基(A29100-01、12309-019-1L)、转染试剂盒(A29129-1L、1962735)等购自Gibco 公司;蛋白胨(LP0044T)购自OXOID 公司;酵母粉(212750)购自BD公司;内切酶Hind Ⅲ(R0104V)、Pac I(R0547S)、BstB Ⅰ(R0519S)和Xho Ⅰ(R1064V)购自NEB 公司;高保真预混酶GXL Premix(R051S)、DNA 连接试剂盒(6022Q)购自Takara 公司;蛋白预制胶(M00653)、染色试剂盒(L00687R)、电泳液(M00138)、上样缓冲液(M00676、MB01015)购自金斯瑞公司;蛋白marker(26616)、Western blot 检测试剂(34577)购自赛默飞公司;Anti-Human IgG Fc specific(A0170-1ML)购自SIGMA 公司。
1.3 仪器设备
摇床(HYG-A)购自太仓实验设备厂;台式离心机(1-15PK)购自德国赛多利斯;洁净工作台(SWCJ-2FD)购自苏州安泰空气技术有限公司;PCR 反应扩增仪(S1000)购自BIO-RAD 公司;紫外仪(WD-9403C)、电泳仪(DYY-10C)、电泳槽(DYCP-31DN)购自北京六一生物科技有限公司; 蛋白染色仪(eStain L1)、快速湿转仪(eBlot 1)购自金斯瑞公司;凝胶成像系统(AlphaImager HP)、全自动成像分析系统购自ProteinSimple 公司;超微量分光光度计(NanoDrop ONE)Thermo Fisher 公司;垂直电泳槽(X Cell sure)购自Invitrogen 公司;金属浴(Thermo mixer)、离心机(5804R)购自Eppendorf 公司;细胞计数仪(Countstar Altair)购自上海睿钰公司;CO叠加式恒温振荡器(IS-RDS6C)购自CRYSTAL 公司。
1.4 基因合成
根据世卫组织公布的Hu5F9 重链和轻链的氨基酸序列(CAS:2169232-81-7),设计引入酶切位点、Kozak序列(GCCACC)和信号肽(MGWSCIILFLVATATGVHS),交由生工生物公司针对CHO 细胞进行密码子优化并合成碱基序列(pUC57-Hu5F9-H 和pUC57-Hu5F9-L)。
1.5 载体构建
表达载体为实验室保存的pCGS3 质粒,合成质粒与载体质粒经过限制性内切酶处理后回收目的基因及载体片段,将目的基因依次连接至pCGS3 载体质粒,并转化大肠杆菌感受态细胞,涂板倒置培养过夜,次日挑选阳性菌落提取质粒进行双酶切验证,并送生工生物公司进行基因测序。
1.6 细胞瞬时转染及培养
转染前1 天,对传代扩增CHO-S 细胞进行细胞计数,待细胞达到合适的密度时进行分种稀释并培养过夜。次日使用新鲜的表达培养基预热至37℃后将细胞进一步稀释,使用预冷试剂配制ExpiFectamineTM CHO/质粒DNA 复合物,室温孵育复合物1~5 min,缓慢加入到细胞悬液中,混匀后培养18~22 h 后,加入增强剂和辅料,继续培养5 d 后,第2 次添加辅料至培养瓶中继续培养,转染后8~10 d,在细胞活率≥75%时,收集细胞上清进行检测。
1.7 蛋白电泳及纯化
取适量样品加入上样缓冲液(还原/非还原),充分混匀后95℃孵育10 min,取预制胶上样进行电泳,结束后用蛋白染色仪快速染色脱色,置于凝胶成像系统中拍照。
将需纯化的蛋白样品加入超滤管中,重复离心收集蛋白浓缩液,将蛋白浓缩液与Binding/Wash buffer等比例混匀,用针头滤器过滤。将混匀的蛋白浓缩液加入纯化柱,收集流穿液,用Binding/Wash buffer 清洗柱子同样收集流穿液,使用超微量分光光度计测量流穿液中蛋白浓度,待流穿液吸光度接近基线时,用Elution buffer 洗脱蛋白并收集,取样测定浓度并进行SDS-PAGE 检测。
1.8 Western blot 鉴定
取适量样品加入上样缓冲液(还原/非还原),充分混匀后95℃孵育10 min,取预制胶上样进行电泳,结束后用蛋白染色仪快速染色脱色。取PVDF 膜放入甲醇中浸泡1 min,倒掉甲醇加入平衡液浸泡2 min,打开转膜夹,按照海绵垫-膜-凝胶-海绵垫的顺序放好,合上转膜夹,插入转膜仪进行转膜。
转膜结束后,将膜浸泡在5%脱脂奶粉中,4℃浸泡过夜,弃掉脱脂奶粉,加入洗涤液重复洗涤3 次,将膜浸泡在抗人源Fc 抗体稀释液中,摇床上缓慢摇晃孵育1 h,加入洗涤液,重复洗涤3 次,将配置好的显色液(A 液∶B 液=1∶1)加至膜上,避光反应5 min,晾至半干,使用全自动成像分析系统拍照保存图像。
2 结果
2.1 获取目的基因及载体
目的基因Hu5F9-H 长度为1392 bp,共编码463个氨基酸,分子量为50.9 kD,Hu5F9-L 基因长度为717 bp,共编码238 个氨基酸,分子量为25.9 kD。
合成质粒pUC57-Hu5F9-H 和pUC57-Hu5F9-L双酶切后回收的目的条带大小与预期符合(图1)。

图1 目的基因回收结果
2.2 真核表达载体的构建与验证
将酶切得到的目的片段回收后,先将Hu5F9-H连接至pCGS3 载体,进行双酶切验证及基因测序,验证结果正确后,再连接Hu5F9-L,同样进行酶切验证及基因测序,实验结果表明真核表达载体构建成功见图2、图3(封三)。

图2 双酶切验证

图3 测序峰图
2.3 目的基因的真核表达
将构建好的真核表达载体转入CHO-S 细胞中表达,培养数天后,取细胞上清进行SDS-PAGE检测(图4)。检测结果显示非还原条件下在180 kD附近出现特异性条带,下方有一条杂带,推测为轻链部分断裂。还原条件下在50 kD 和30 kD 处出现两条特异性条带,与Hu5F9 抗体的重链和轻链大小相符。
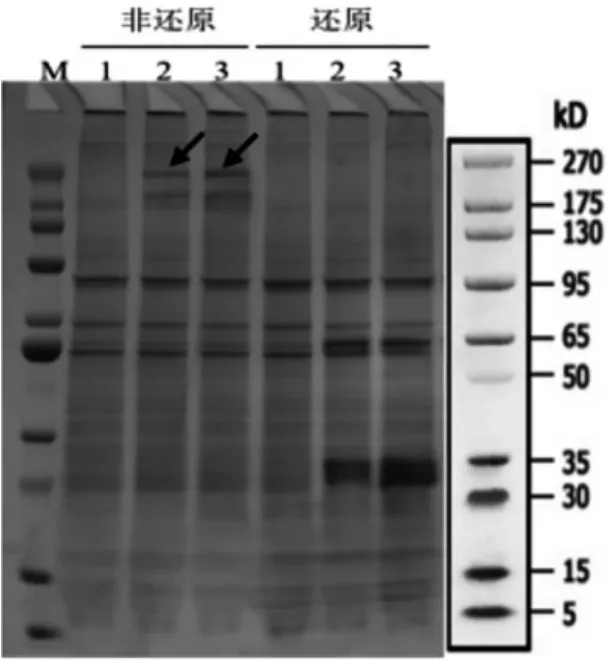
图4 SDS-PAGE 检测目的蛋白
2.4 纯化目的蛋白
利用Fc 标签纯化目的蛋白,经SDS-PAGE 检测发现,非还原条件下在180 kD 出现特异性条带,为Hu5F9 全抗分子,其下方存在多条特异性条带,分析抗体分子可能存在轻链不同程度的断裂。还原条件下在50 kD 和30 kD 出现两条特异性条带,分别对应抗体的重链和轻链,条带大小符合预期(图5)。
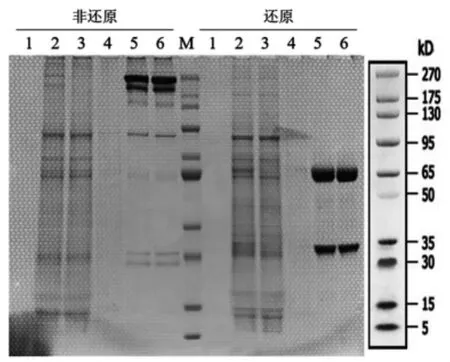
图5 蛋白纯化结果
2.5 重组蛋白Western blot 鉴定
利用重链上的人源Fc 标签进行Western blot 鉴定,发现非还原条件下,重、轻链聚合,全抗分子理论大小为153.6 kD,鉴定结果显示在80~180 kD 处有多条特异性条带,表明可能出现轻链不同程度的断裂。还原条件下,重、轻链解聚,重链单独与Fc 抗体结合,在55 kD 附近有单一条带,与重链大小相符(图6)。实验结果表明Hu5F9 重组蛋白在CHO-S 细胞中成功表达。
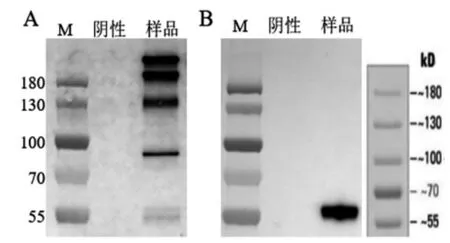
图6 Western blot 鉴定结果
3 讨论
巨噬细胞对靶细胞的吞噬作用受激活信号(FcγR、CRT、LRP-1)和抑制信号(SIRPα-CD47)的平衡调节,但癌细胞通过上调CD47 的表达,使大量的CD47 与免疫细胞表面的SIRPα 受体结合,通过传递出一种“不要吃我”的信号来逃避免疫系统。抗CD47抗体能阻断CD47-SIRPα 信号通路,激活巨噬细胞对肿瘤细胞的吞噬作用,同时能够增强抗原呈递细胞对肿瘤抗原的呈递作用,激活免疫T 细胞对肿瘤细胞的特异性杀伤,这种机制为靶向CD47 的肿瘤免疫治疗药物开发提供了充分的理论基础。
此前研究报告了一种新的抗CD47 抗体分子Hu5F9-G4,能够在体外有效地诱导巨噬细胞对原代人类急性髓性白血病(acute myeloid leukemia,AML)细胞吞噬作用,并在体内完全根除人AML 细胞,展现出极佳的抗癌治疗潜力。有研究报道,Hu5F9-G4 与利妥昔单抗联用,在治疗弥漫性大B 细胞淋巴瘤和滤泡性淋巴瘤的临床试验结果中表现出良好的抗肿瘤效果。曲妥珠单抗是一种靶向抗人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)单克隆抗体,用于治疗HER2 阳性乳腺癌,能够显著提高早期HER2 阳性乳腺癌患者生存率,但晚期患者容易产生耐药性而导致复发,而近期研究结果表明,Hu5F9-G4 与曲妥珠单抗联用能克服耐药性的限制,增强HER2 阳性乳腺癌的抗肿瘤疗效。
SIRPα-CD47 靶向药物正在成为癌症免疫治疗方向的热点,除了Hu5F9 外,还有多个抗体分子正在开发中,例如抗SIRPα 抗体TTI-621、CD47 拮抗剂ALX-148以及另一个抗CD47 抗体B6H12等,其中最具临床价值的还是Hu5F9,已有多个临床试验正在进行中。但是不断有研究表明,因CD47 在红细胞上的表达,使得Hu5F9 对红细胞具有一定的毒害作用,可能会导致一系列血液系统方面的不良反应,临床应用面临一定的安全风险。这些风险无疑限制了Hu5F9 的开发应用,目前临床试验大都通过与其他靶点药物联用,改进给药方式或者开发双特异性抗体等方法来避免大剂量直接给药,以减轻其不良反应。因此,如何平衡CD47 靶向药物的有效性和安全性仍需要进一步的研究。
尽管Hu5F9 仍存在一些问题,但其在抗CD47 抗体药物研发中仍极具参考价值,目前未见有Hu5F9真核表达方法等相关报告,本研究根据世界卫生组织公布的Hu5F9 氨基酸序列,构建真核表达载体,利用CHO-S 表达系统,在瞬时转染条件下成功地获得了抗CD47 抗体Hu5F9 的重组蛋白,为后续CD47 药物的开发研究工作提供实验依据。
