紫红笛鲷Cyp1a基因克隆、表达及其对一溴联苯醚和十溴联苯醚胁迫的响应
2022-08-23巩秀玉兰丽丽王学锋马胜伟陈海刚张林宝
张 喆,巩秀玉,兰丽丽,王学锋,马胜伟,陈海刚,张林宝
1. 中国水产科学研究院南海水产研究所/广东省渔业生态环境重点实验室/农业农村部南海渔业资源环境重点野外科学观测实验站/广东珠江口生态系统野外科学观测研究站,广东 广州 510300
2. 广州海关技术中心,广东 广州 510623
3. 南方海洋科学与工程广东省实验室,广东 湛江 524025
4. 广东海洋大学 水产学院,广东 湛江 524088
细胞色素P450酶是依赖血红素的多功能氧化酶,在内源物质合成及外源物质的代谢转化中发挥重要作用[1]。CYPs为超基因家族,广泛存在于微生物[2]、植物[3]和动物[4]体内。截至2017年,已有超过41 000条P450基因序列被克隆和命名[5]。CYPs包含许多家族,在无脊椎动物中已发现70多个CYPs家族[6]。CYP1~4家族在生物体I相解毒系统中发挥重要作用[7]。CYP1A亚家族作为CYP1家族的重要成员,可催化多种底物代谢。海洋鱼类Cyp1a基因的表达可被多氯联苯 (Polychlorinated biphenyls, PCBs) 和多环芳烃 (Polyaromatic hydrocarbons, PAHs) 等多种外源物质诱导,且其表达量与污染物含量显著相关[8],故常被用作环境监测的生物标志物。因此,CYPs基因序列的获得及应用对海洋环境监测和海洋生物保护有重要意义。
多溴联苯醚类物质 (Polybrominated diphenyl ethers, PBDEs) 具有亲脂性、持久性和生物蓄积性等与PCBs相似的性质[9],是我国近岸海域环境中典型的持久性有机污染物[10-11]。在209种PBDEs同系物中,BDE-209溴原子含量最高,是目前唯一仍可商业化使用的PBDEs,因此也是目前海洋环境中含量较高的PBDEs污染物[12]。BDE-3则是溴原子含量最低的PBDEs,环境中的BDE-3主要通过高溴原子PBDEs的光降解和生物降解产生,是PBDEs光降解最为丰富的产物之一[13-14]。PBDEs可以影响鱼类的生殖发育[15]、免疫[16]和行为[17]等。已有研究表明,BDE-47和BDE-99可以诱导斑马鱼 (Danio rerio)Cyp1a基因表达[18],大西洋鲑(Salmo salar) 肝脏细胞Cyp1a基因表达在 BDE-47胁迫下显著上调[19],而商业化五溴联苯醚 (Penta-BDE) 和八溴联苯醚 (Octa-BDE) 混合物则未对大西洋鲑Cyp1a表达产物7-乙氧基香豆素-O-脱乙基酶(EROD)活性产生影响[20]。可见鱼类Cyp1a基因的表达可受到PBDEs的影响,但不同PBDEs的作用机制不同。因此,分析不同溴代PBDEs对鱼类Cyp1a基因的影响,有助于深入探讨PBDEs的毒性机制。
紫红笛鲷 (Lutjanus argentimaculatus) 为广盐性鱼类,在印度太平洋地区广泛分布,是我国东南沿海重要的增养殖经济种类。2016年,其养殖产量和捕捞量分别达到 10 240 和9 815 t[21]。从数量和分布来看,其可作为我国东南沿海潜在的环境监测生物。鉴于此,本文以紫红笛鲷为实验生物,克隆获得Cyp1acDNA全长,对其氨基酸序列进行同源性分析及mRNA的组织表达分析。进而分析了不同浓度BDE-3和BDE-209胁迫对紫红笛鲷肝脏Cyp1a表达和EROD活性的影响,初步探讨了两种PBDEs胁迫对紫红笛鲷Cyp1a表达影响的异同。结果可充实海洋鱼类CYPs基因数据库,为深入探讨PBDEs对海洋生物的毒性机制提供科学依据。
1 材料与方法
1.1 实验动物及试剂
紫红笛鲷幼鱼体长 (8.29±0.53) cm、体质量(15.07±0.26) g,购自中国水产科学研究院南海水产研究所深圳试验基地。将鱼取回后,在实验条件下暂养 7 d,水温 (26.3±0.5) ℃,pH 8.1±0.2,盐度33.5±0.8,光照强度 600~700 lx,光周期为 12 L∶12 D。每天投喂人工配合饲料2次,并于第2次投喂1 h后换水,暂养期间保证实验用鱼日死亡率低于1%。实验用BDE-3 (CAS#101-55-3,纯度99%)购自美国Sigma-Aldrich公司,BDE-209 (CAS#1163-19-5,纯度>97%) 购自美国 AccuStandard 公司。实验用其他化学试剂均购自国药集团化学试剂有限公司,为国产分析纯。分子试剂及试剂盒除特殊标注外,均购自宝日医生物技术 (北京) 有限公司。
1.2 实验方法
1.2.1 紫红笛鲷组织样品采集
暂养结束后,随机选取7尾鱼进行解剖。其中1尾取其肝脏组织,液氮冷冻保存,用于Cyp1a基因的克隆;剩余6尾解剖后,分别取其肝脏、鳃、肾脏、脑、肠和肌肉组织,液氮速冻,−80 ℃保存,用于Cyp1a基因的组织表达分析。
1.2.2Cyp1a基因中间片段的获得
使用 TRIzol®Reagen t (Cat. # 15596026,Thermo Scientific,美国) 提取紫红笛鲷肝脏总RNA,并利用 Reverse Transcriptase M-MLV 进行 cDNA 的合成,具体方法参照试剂盒说明书。于GenBank数据库搜集石颌鲷 (Lithognathus mormyrus, AF264037.1)、金鲷 (Sparus aurata, AF011223.1)、真鲷 (Pagrus major, EU163982.1)、黑棘鲷 (Acanthopagrus schlegelii,DQ898145.1) 和门齿鲷 (Stenotomus chrysops, U14162.1)等近缘物种的Cyp1a核酸序列进行简并引物设计(表1)。
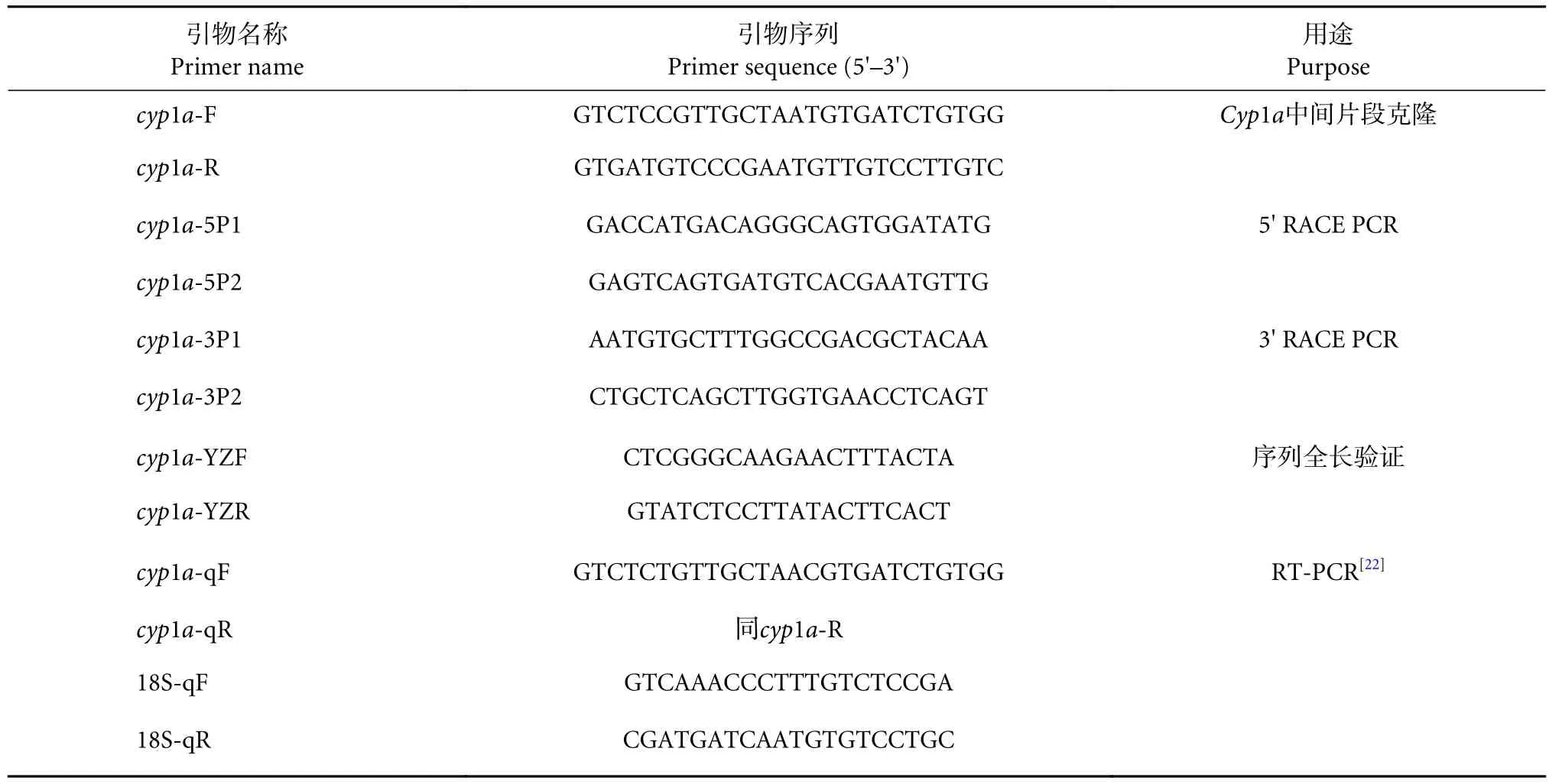
表1 实验所用引物Table 1 Primers used in experiment
以合成的cDNA为模板,以cyp1a-F和cyp1a-R为引物,进行Cyp1a基因中间片段的克隆。PCR反应体系的配制参照Taq酶使用说明书 (TaKaRaTaq™)。PCR 反应条件为:94 ℃ 变性 5 min;94 ℃变性 30 s,60 ℃ 退火 30 s,72 ℃ 延伸 30 s,35 个循环;72 ℃延伸10 min。PCR产物回收纯化后,送至生工生物工程 (上海) 股份有限公司测序,结果得到272 bp的Cyp1a基因中间片段。
1.2.3Cyp1a基因 cDNA 全长克隆
取紫红笛鲷肝脏组织提取mRNA后,利用SMARTer® RACE 5'/3' Kit (Clontech Laboratories,Inc.,美国) 进行第一链cDNA合成。根据克隆获得的中间片段设计 5'及 3' RACE 特异性引物 (表1)。参照试剂盒说明书配制PCR反应体系,利用巢式PCR (PCR反应条件参照说明书) 依次扩增得到Cyp1a基因5'和3'末端序列并进行测序,对测序的5'和3'序列进行拼接得到紫红笛鲷Cyp1acDNA全长序列。
1.2.4Cyp1a基因序列分析及系统进化树构建
使用 DNAMAN 软件 (Lynnon Biosoft,美国)查找Cyp1a开放阅读框,利用BlastP在GenBank中寻找同源序列,利用CLUSTAL方法进行多重序列比较。利用在线工具分别进行推导氨基酸分子量和等电点 (Prot-Param)、蛋白质磷酸化位点 (Net-Phos 3.1 Server)、糖基化位点 (NetNGlyc 2.0 Server)、蛋白质跨膜结构域预测 (TMHMM ser-vices 2.0) 和蛋白质三级结构预测 (SWISS-Model)。使用MEGA 7.0软件包[23],采用邻接法 (Neighborjoining) 构建系统进化树。
1.2.5Cyp1a基因组织表达分析
应用RT-PCR方法分析Cyp1a基因在紫红笛鲷各组织表达情况。将紫红笛鲷各组织分别提取mRNA 后反转录为 cDNA (PrimeScript™ RT reagent Kit),配制荧光定量反应液 (TB Green®Fast qPCR Mix),各试剂使用量参照试剂盒说明书。使用罗氏LC480荧光定量PCR仪进行不同组织基因表达分析,荧光定量PCR反应条件参照试剂盒说明书。PCR反应结束后,对扩增产物进行溶解曲线分析,同时取PCR产物进行2%琼脂糖凝胶电泳检测,并将PCR产物进行回收测序以确定产物为单一目的基因。
1.2.6 BDE-3 和 BDE-209 胁迫实验及样品采集
选择健康、规格整齐的紫红笛鲷幼鱼480尾用于胁迫实验,实验容器为500 L玻璃钢材质育苗桶。实验设置1个空白对照组 (CK组),1个溶剂对照组 (SCK 组)、3个 BDE-3胁迫组 (10、50和250 μg·L−1,分别命名为 E2、E3 和 E4 组)和 3 个 BDE-209 胁迫组 (10、50 和 250 μg·L−1,分别命名为T2、T3和T4组),在溶剂对照组中加入实验组同体积的DMSO。每组60尾鱼,设3个平行,每个平行20尾,PBDEs连续胁迫15 d,期间每天换水1次,早晚各投喂人工配合饲料1次。分别于胁迫的第3、第7 和第15 天取样。每个实验组、每个时间点随机取鱼6尾,将其肝脏样品分别取出后即刻用液氮速冻,−80 ℃保存,用于Cyp1a基因表达分析和EROD酶活性的测定。
1.2.7 紫红笛鲷肝脏Cyp1a表达及 EROD 活性分析
紫红笛鲷肝脏Cyp1a基因的RT-PCR分析方法同1.2.5。紫红笛鲷肝脏微粒体制备、微粒体酶蛋白的提取及EROD活性的测定参照余铭恩等[24],使用快速荧光光度法对EROD活性进行测定,单位以 nmol·(min·mg)−1表示。
1.3 数据处理
Cyp1a表达量分析采用△△Ct法[25]。实验数据均以“平均值±标准差 (SD)”表示,所得数据采用SPSS 13.0软件进行单因素方差分析 (One-way AVOVA),用Duncan's法对平均值进行多重比较,显著性水平为P<0.05。利用Excel 2010软件进行相关性分析和作图。
2 结果
2.1 紫红笛鲷 Cyp1a 基因序列分析
紫红笛鲷Cyp1a基因cDNA全长为2 540 bp(GenBank登录号:MH973703),开放阅读框为1 566 bp,编码 521 个氨基酸。cDNA 包含 144 个碱基的5'非编码区、830个碱基的3'非编码区及终止密码子TAG,并含有一个多聚腺苷酸信号 (AAT AAA) 和一个 poly (A) 尾。起始密码子 ATG 位于145—147位核苷酸,且在−3位置为嘌呤碱基 (A),+4位置为G,符合典型的kozak结构。因此,该cDNA编码一个全长蛋白质 (图1)。该基因所编码蛋白的推导分子量为59 255.32 ku,理论等电点为6.05,分子式为 C2 658H4 169N711O767S28。推导氨基酸在46—53有一个脯氨酸/甘氨酸丰富区 (PGPKPLP),在 308—326和 456—465分别为硬骨鱼类CYP1A特征序列(SDEKIVGIVNDLFGAGFDT) 和血红素蛋白结合核心区特征序列 (FGMGKRRCIG)。靠近血红素蛋白结合区附近,为CYPs的不变序列(PSSFNPDRF),位于氨基酸的429—437位。此外,在推导氨基酸时发现6个底物识别位点 (Substrate recognition sites, SRSs),分别位于氨基酸110—129、224—231、264—277、315—331、384—397和496—505位。蛋白质结构域分析显示,该序列有48个磷酸化位点,分别为27个丝氨酸 (Ser)、16 个苏氨酸 (Thr) 和 5 个酪氨酸 (Tyr),未发现糖基化位点、信号肽及跨膜结构,说明其为胞内产物。蛋白质二级结构预测结果表明,CYP1A蛋白存在52.02%的α-螺旋、5.76%的β-折叠和42.22%的无规则卷曲。蛋白质三级结构建模所用模板蛋白为人类细胞色素P450 1A1 (PBD登录号:4i8v),本序列与模板序列一致度为57.87%,其 GMQE (Global model quality estimation) 评分为0.76,表明该模型的可靠性较高,QMEAN评分为−0.37,表明待测蛋白与模板蛋白的匹配度较好(图2)。

图1 紫红笛鲷Cyp1a核苷酸序列及其推导氨基酸序列Fig. 1 Nucleotide and deduced amino acid sequence of Cyp1a of L. argentimaculatus
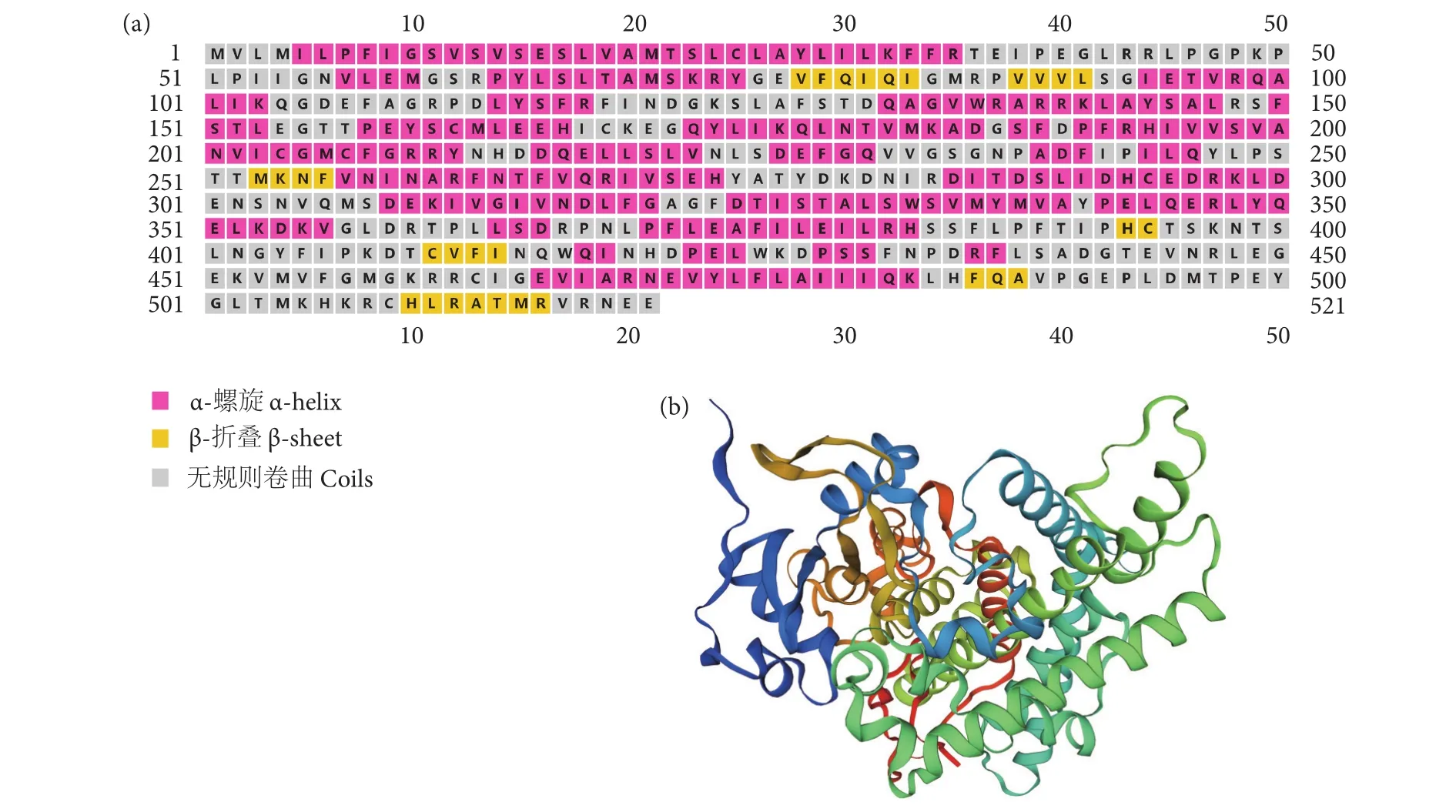
图2 紫红笛鲷CYP1A二级 (a) 和三级结构 (b) 预测Fig. 2 Prediction of secondary structure (a) and tertiary structure (b) of L. argentimaculatus CYP1A
2.2 同源性分析
多序列比对分析显示,紫红笛鲷CYP1A与花鲈 (Lateolabrax maculatus, QQL94697.1)、尖吻鲈 (Lates calcarifer, XP_018552995.1)、高体鰤 (Seriola dumerili, XP_022601069.1)、大西洋庸鲽 (Hippoglossus hippoglossus, XP_034430519.1)、狭鳞庸鲽(H. stenolepis, XP_035011139.1)、舌齿鲈 (Dicentrarchuslabrax, CAB63650.1)、龙胆石斑鱼 (Epinephelus lanceolatus, XP_033474241.1) 和褐菖鲉 (Sebastiscus marmoratus,APT40582.1) CYP1A蛋白质序列相似性分别为92.69%、91.94%、91.94%、91.75%、91.75%、91.68%、90.98%和90.60% (图3)。与上述序列血红素蛋白结合区等CYPs特征区域均高度保守。将该序列提交至国际P450命名委员会 (Standardized Cytochrome P450 Nomenclature Committee),被命名为紫红笛鲷Cyp1a基因。

图3 紫红笛鲷CYP1A推导氨基酸多重序列比较Fig. 3 Multiple sequence alignment of deduced amino acid sequence of CYP1A of L. argentimaculatus
由进化树分析结果可知,紫红笛鲷CYP1A与白梭吻鲈 (Sander lucioperca, XP_031137387.1) 进化地位最近,与龙胆石斑鱼、鞍斑杜父鲈鰧 (Cottoperca gobio, XP_029282397.1)、睛斑鳗狼鱼 (Anarrhichthys ocellatus, XP_031704348.1)、褐菖鲉、荫平鲉(Sebastes umbrosus, XP_037652197.1) 和许氏平鲉(S. schlegelii, AWN64552.1) 等硬骨鱼类聚为一支(图4)。
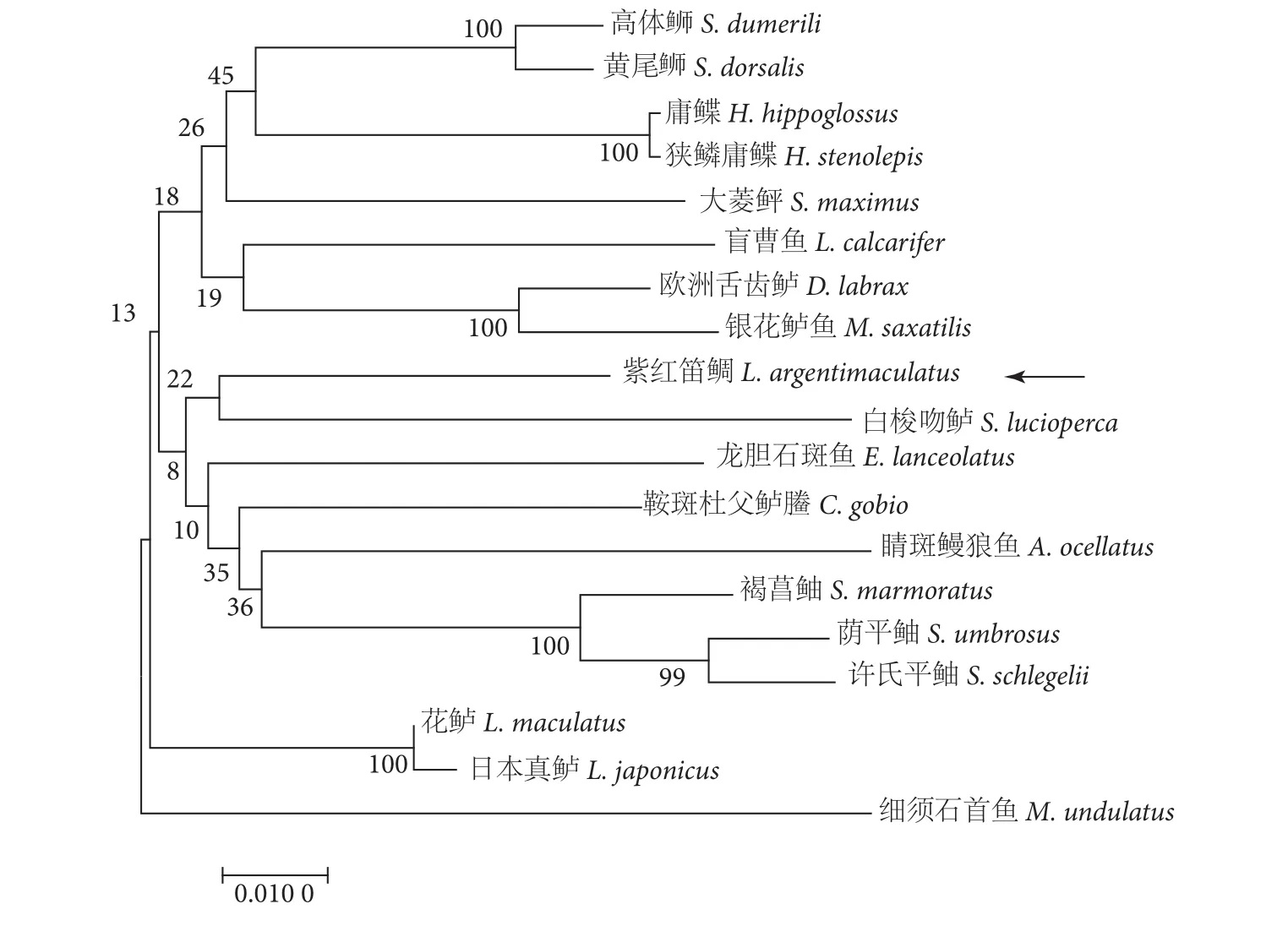
图4 紫红笛鲷CYP1A进化树分析Fig. 4 Phylogenetic analysis of L. argentimaculatus CYP1A
2.3 紫红笛鲷 Cyp1a 基因组织表达
图5为Cyp1a基因在紫红笛鲷的组织分布。结果表明,Cyp1a基因在实验采集的各组织中均有表达且存在组织表达差异。其中肝脏表达量最高 (P<0.05),其次为脑和鳃,肌肉组织中表达量最低 (P<0.05)。
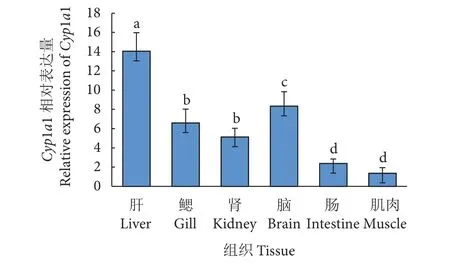
图5 Cyp1a mRNA在紫红笛鲷的组织表达注:不同字母代表存在显著性差异(P<0.05), 后图同此。Fig. 5 Tissue expression of Cyp1a mRNA in L. argentimaculatusNote:Different ltters represent significant dfference (P<0.05). The same case in fllowing figures.
2.4 BDE-3 和 BDE-209 对紫红笛鲷肝脏 Cyp1a 基因表达和EROD活性的影响
紫红笛鲷肝脏组织Cyp1a基因在BDE-3和BDE-209胁迫下的响应见图6。BDE-3胁迫7 d后,E3和E4组Cyp1a基因表达被显著抑制,分别为CK组的69.61%和45.48%。15 d时E3和E4组Cyp1a表达量仍显著低于对照组 (P<0.05)。与BDE-3不同,BDE-209胁迫7 d后,T4组Cyp1a基因表达显著上调。胁迫15 d,T3和T4组Cyp1a基因表达量分别为对照组的7.99和11.17倍 (P<0.05)。而低浓度 BDE-3 (E2 组) 和 BDE-209 (T2组) 则未对Cyp1a基因表达产生显著影响 (P>0.05)。
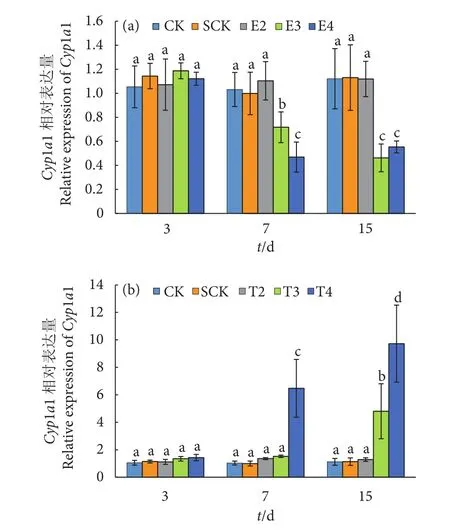
图6 BDE-3 (a) 和BDE-209 (b) 胁迫对紫红笛鲷肝脏Cyp1a基因表达的影响Fig. 6 Effects of BDE-3 (a) and BDE-209 (b) on Cyp1a expression in liver of L. argentimaculatus
与Cyp1a相似,整个胁迫实验期间,E2组EROD活性与对照组无显著差异 (P>0.05,图7)。胁迫7 d时,E3和E4组EROD活性显著下降 (P<0.05),分别为对照组的63.96%和72.24%。15 d时E4组EROD活性仍显著低于对照组,为对照组的78.29%,而E3组与对照组无显著差异 (P>0.05)。BDE-209则对紫红笛鲷肝脏EROD活性呈现诱导效应。胁迫7 d,T4组EROD活性显著升高,为对照组的1.37倍。胁迫15 d时,T3和T4组EROD活性均显著高于对照组 (P<0.05),分别为对照组的1.48和2.7倍。BDE-209胁迫3 d,各实验组与对照组EROD活性无显著差异 (P>0.05)。将各实验组Cyp1a基因表达量与EROD活性进行相关性分析,结果显示两者呈显著的正相关关系 (R2=0.590,P<0.001,图8)。
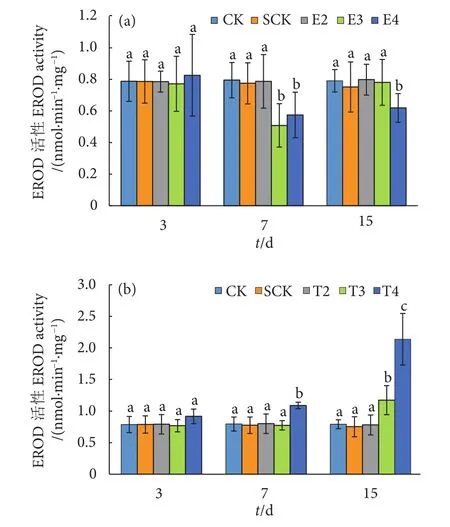
图7 BDE-3 (a) 和BDE-209(b) 胁迫对紫红笛鲷肝脏EROD活性的影响Fig. 7 Effects of BDE-3 (a) and BDE-209 (b) on EROD activities in liver of L. argentimaculatus
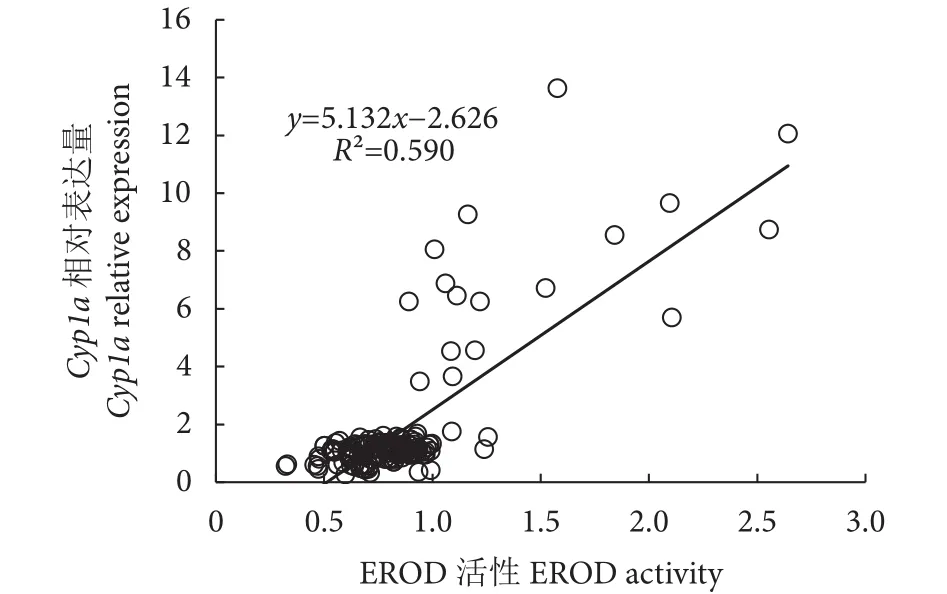
图8 Cyp1a基因表达量与7-乙氧基香豆素-O-脱乙基酶活性相关性分析Fig. 8 Correlation between Cyp1a relative expression and EROD activity
3 讨论
3.1 紫红笛鲷 Cyp1a 基因序列及组织表达
P450酶系可催化多样性底物,其中海洋鱼类CYP1A亚家族基因表达及酶活性的改变常被用作海洋污染物监测的早期预警信号,而鱼类Cyp1a基因的获得是实现其环境监测应用的基础。本实验首次克隆获得了紫红笛鲷Cyp1a基因cDNA序列全长,也是在其体内首次获得细胞色素P450基因。紫红笛鲷CYP1A序列具有CYPs核苷酸高度保守的血红素结合区序列 (FxxGxRxCxG)、不变序列 (PxxFxPE/DRF)[26]和硬骨鱼类CYP1A特征序列 (SDEKIVGIVNDLFGAGFDT)[27],有 6 个 SRS用于识别并结合底物,是典型的P450酶[28]。肝脏是环境污染物积累、生物转化和代谢的主要器官[29],Cyp1a基因在外源物质代谢中发挥重要作用,因而一般在肝脏中的表达量较高[30]。本研究表明,紫红笛鲷Cyp1a基因在肝脏中的表达量最高,其次是脑和鳃,肌肉中表达量最低。其组织表达模式与虹鳟 (Oncorhynchus mykiss)[31]和青鳉(Oryzias latipes)[32-33]等鱼类Cyp1a基因的组织表达模式相似,提示紫红笛鲷Cyp1a基因的功能与其他鱼类相似,主要参与外源物质的代谢,使其具有一定的组织表达特性。鉴于此,在后续实验中选择紫红笛鲷肝脏作为靶器官,用于评价BDE-3和BDE-209对Cyp1a基因表达的影响。7-乙氧基香豆素(7-ethoxyresorufin) 的脱乙基反应主要由CYP1A家族酶催化,因此EROD活性的上升可用来指征Cyp1a基因表达的上调[34]。本研究结果显示,PBDEs胁迫下,紫红笛鲷肝脏Cyp1a基因表达量与EROD活性呈显著正相关关系,这与以往研究结果一致[22],说明紫红笛鲷肝脏EROD活性可以反映Cyp1a基因的表达情况。鉴于此,在后续的讨论中将紫红笛鲷Cyp1a基因表达和EROD活性结果相结合进行分析讨论。
3.2 Cyp1a 和 EROD 对 BDE-3 和 BDE-209 胁迫的响应
鱼类Cyp1a基因表达和EROD活性受到环境有机物[35]、药物[36]和农药[37]等多种外源物质的影响。然而,有关PBDEs污染物对海洋鱼类Cyp1a基因及EROD的影响研究较为有限。本研究选择具有一定代表性的PBDEs污染物BDE-3和BDE-209,以分析紫红笛鲷Cyp1a基因对不同溴原子含量PBDEs胁迫的响应。结果表明,低浓度BDE-209 (10 μg·L−1) 对紫红笛鲷Cyp1a和 EROD 未产生显著影响。迟潇等[38]分析了BDE-47和BDE-153 对半滑舌鳎 (Cynoglossus semilaevis) EROD 活性的影响,发现只有当上述两种污染物浓度较高时(>500 ng·L−1),EROD 活性才被显著诱导,这与本研究结果一致。高浓度 (50~250 μg·L−1) BDE-209 胁迫7~15 d,紫红笛鲷肝脏Cyp1a表达量和EROD活性均显著升高,且呈现剂量-效应关系。这一现象在其他生物体内也有发现。0.2 mg·kg−1BDE-209口饲大鼠28 d,可以显著诱导其Cyp1a基因的表达[39]。Wang 等[40]的体外实验结果表明,0.01~0.1 μg·L−1BDE-209可以显著诱导莫桑比克罗非鱼 (Mossambica tilapia) 肝脏EROD活性。上述结果说明紫红笛鲷Cyp1a基因和EROD活性可以作为环境中较高浓度 (>50 μg·L−1) BDE-209 污染的潜在生物标志物。
BDE-3属于低溴代PBDEs,可以引起海洋生物的氧化损伤[41]。然而,与BDE-209相比,有关BDE-3对海洋鱼类毒性效应的研究较少,可供参考的数据非常有限。本研究发现,与BDE-209相反,高浓度 (50~250 μg·L−1) BDE-3 胁迫下,紫红笛鲷肝脏Cyp1a基因表达和EROD活性被显著抑制。较之低溴代的BDE-3,BDE-209因具有较高的疏水性和较低的挥发性,生物毒性较低[42],这可能是导致两者对紫红笛鲷Cyp1a表达和EROD活性影响存在差异的原因之一。由于较高的生物毒性,当BDE-3浓度较高时,会对生物体产生不利影响,此时生物体可能会自发产生抑制剂,EROD的催化功能被抑制,EROD活性下降,以起到对自身的保护作用[43-44]。与此同时,高浓度的BDE-3也可能对紫红笛鲷的肝脏组织造成损伤。Søfteland等[19]研究发现,BDE-47及PBDEs混合物胁迫大西洋鲑的肝脏细胞,其Cyp1a基因的表达被抑制,可能由上述污染物引起肝脏细胞凋亡所致。这也提示在今后的研究中,应对肝脏细胞损伤和凋亡等指标进行测定,以对PBDEs毒性机制进行更加全面和深入的探讨。与此同时,鱼类的性别、发育阶段及饲料等可以改变其体内的激素水平,进而影响Cyp1a基因的表达,在评价Cyp1a基因作为生物标志物时应充分考虑上述因素的影响[44],因此开展PBDEs对不同种类、不同发育阶段海洋鱼类的毒性效应研究,对于系统地评价PBDEs的毒性机制具有重要意义。
3.3 BDE-3 和 BDE-209 对 Cyp1a 和 EROD 影响的差异
BDE-3和BDE-209胁迫下,紫红笛鲷Cyp1a基因表达量和EROD活性变化存在明显差异,很可能与Cyp1a基因表达的调控通路有关。哺乳动物Cyp1a基因的表达与芳香烃受体基因 (Arylhydrocarbon receptor,AhR) 有关。AhR为配体激活型受体,外源物质可作为配体与AhR结合,从而诱导生物体Cyp1a基因的表达及EROD活性的增加[45-46]。有些PBDEs在分子和物理化学性质上与PCBs等二噁英类污染物相似[47],可以激活AhR的表达[42]。Yang等[43]发现BDE-99可作为AhR的瞬间配体诱导斑马鱼肝脏细胞Cyp1a基因的表达,而BDE-47则未对Cyp1a的表达产生影响。BDE-47、BDE-99 和 BDE-153 可以抑制鲤鱼 (Cyprinus carpio)肝脏细胞EROD活性,而BDE-100则未对EROD活性产生影响[48]。Whal等[49]发现商业化BDE-47中微量的溴化呋喃污染,也可能会诱导AhR基因的表达。可见由于PBDEs同系物溴原子含量及纯度的差异,使其对AhR的作用不尽相同,这可能是造成BDE-3和BDE-209对紫红笛鲷Cyp1a表达影响不同的原因之一。与此同时,与哺乳动物不同,鱼体内可能存在不止一个AhR基因。如在大西洋鳉鱼 (Fundulus heteroclitus) 体内发现 2 个AhR旁系同源基因 (AhR1和AhR2),两者在鱼体内可能发挥不同的功能[50]。不同鱼种体内的AhR基因与同一污染物的结合能力存在差别[51],即便被同一污染物胁迫,不同鱼类AhR及其下游基因的响应也会存在差异。目前,紫红笛鲷AhR基因的克隆并未见报道,因此其AhR基因的数量及功能尚不清楚。在今后的工作中可对紫红笛鲷AhR基因进行克隆及功能验证,以更好地解释其Cyp1a基因对不同PBDEs响应的差异。
4 结论
本研究首次克隆获得紫红笛鲷Cyp1a基因,该基因在肝脏组织中表达量最高。在BDE-3和BDE-209胁迫下,紫红笛鲷肝脏Cyp1a基因表达和EROD活性分别显著下调和上调,且存在剂量-效应。本研究结果提示不同PBDEs污染物对紫红笛鲷Cyp1a基因表达影响的作用机制可能存在差异,为评价PBDEs对海洋鱼类的毒性机制提供科学依据。
