获得性免疫缺陷综合征合并慢性阻塞性肺疾病危险因素分析
2022-08-23唐莉歆周恩竹钟城垚
唐莉歆, 周恩竹, 钟城垚, 万 秋
随着抗反转录病毒治疗(ART)的广泛应用,获得性免疫缺陷综合征(AIDS)已从一种致死性疾病转变为需要终身治疗的慢性传染病,目前AIDS患者的预期寿命已接近一般人群[1],中国正面临着一个庞大的老年AIDS群体[2]。AIDS的疾病谱已由机会性感染逐渐转变为非AIDS相关性疾病,其中慢性阻塞性肺疾病(COPD)是AIDS人群中常见的肺部共病,来自北美和欧洲20年的研究报告指出AIDS患者中COPD患病率在3.4%~40%以上[3]。我国COPD发病率较高,40岁以上人群COPD的平均患病率为13.7%[4]。对AIDS患者相关肺疾病的发病机制研究,认为免疫、免疫相关炎性反应、感染等病理机制导致肺功能病变程度更重,ART与COPD发病也存在关联[5],但很多危险因素尚不明确,早期和快速的肺功能下降不能仅靠吸烟和其他传统危险因素来解释,且AIDS合并COPD患者的发病年龄较轻,预后差[6-9]。为进一步了解二者的相关性,就AIDS合并COPD患者的临床特点及危险因素进行分析。
1 材料与方法
1.1 病例来源
回顾性分析2020年1月—2021年8月于重庆市公共卫生医疗救治中心收治住院,确诊为AIDS的208例患者。AIDS诊断符合中华医学会感染病学分会制定的《中国艾滋病诊疗指南(2018年版)》[10]。根据肺功能检查结果,结合COPD的诊断标准及严重程度,参照2021年版GOLD指南[11]进行分级,并分为AIDS合并COPD组(60例)和AIDS组(148例)。
1.2 资料收集
收集患者临床资料:①性别、年龄、体重、吸烟史、患有慢性基础疾病(高血压、冠心病、糖尿病)、AIDS病程时间;②启动ART前和ART 4周后人类免疫缺陷病毒(HIV)RNA定量、巨细胞病毒感染、CD4+细胞计数、CD8+细胞计数、细胞因子检测等检验结果;③影像学检查、心脏彩超、肺功能检查。
1.3 统计学分析
采用SPSS 23.0统计软件进行数据分析,正态分布的计量资料以表示,采用t检验;非正态分布计量资料以中位数(M)四分位数(P25,P75)描述,采用秩和检验;计数资料采用例(百分数)表示,采用χ2检验。以P<0.05为差异具有统计学意义。采用logistic分析AIDS合并COPD的危险因素,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组资料比较
AIDS组与AIDS合并COPD组患者在性别构成、体重、合并高血压、冠心病、糖尿病、AIDS病程时间,差异均无统计学意义(P均>0.05)。在实验室检查结果中,CD8+细胞计数、血清IL-2、IL-6、IL-17A、IL-10、肿瘤坏死因子α及干扰素γ水平,影像学示肺动脉压、右心房、右心室等方面,差异均无统计学意义(P均>0.05)。与AIDS组比较,合并COPD组患者更年轻、CD4+细胞计数更低,有吸烟史、巨细胞病毒感染、影像学提示支气管扩张、肺气肿的比例更高,差异具有统计学意义(P均<0.05),同时血清IL-4水平、ART前后血浆HIV RNA载量均高于AIDS组,差异具有统计学意义(P均<0.05)。见表1。
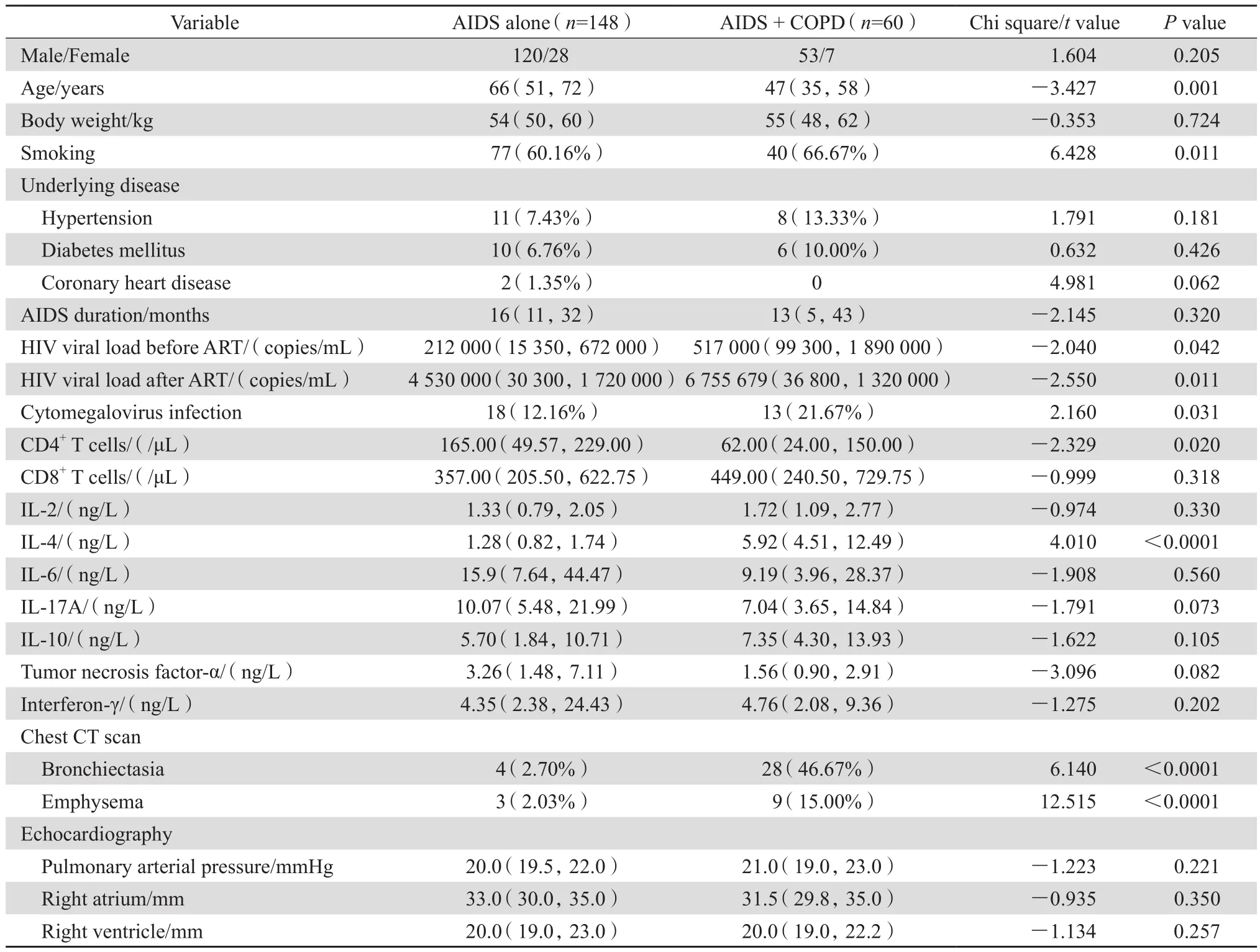
表1 患者临床资料分组比较Table 1 Clinical data of AIDS patients compared in terms of chronic obstructive pulmonary disease
2.2 AIDS合并COPD病程时间比较
临床资料比较发现AIDS病程时间在AIDS组与AIDS合并COPD组差异无统计学意义。进一步将AIDS合并COPD组患者(60例)根据患病先后,分为AIDS首发疾病组(49例)、COPD首发疾病组(11例),分别记录患者AIDS病程时间、COPD病程时间并进行统计分析显示, COPD中位病程时间在AIDS为首发疾病组[9(2, 13)个月]与COPD为首发疾病组[46(10,124)个月]差异有统计学意义,且以AIDS为首发疾病组COPD病程时间明显缩短(P<0.05),AIDS中位病程时间在以AIDS为首发疾病组[14(4,48)个月]与COPD为首发疾病组[8(5,11)个月]差异无统计学意义(P>0.05)。将两病合并患者中,患COPD与患AIDS病程相差时间再次进行分析发现,两组病程相差时间差异有统计学意义(P<0.05),见表2。
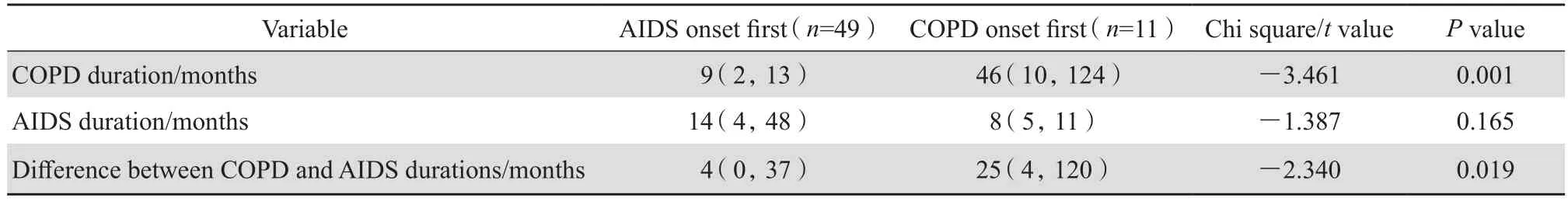
表2 AIDS合并COPD组病程时间比较Table 2 Duration of AIDS and COPD compared between patients in terms of disease onset [M( P25, P75)]
2.3 AIDS合并COPD危险因素的多变量logistic回归分析
AIDS组和AIDS合并COPD组临床资料单因素分析显示,年龄、吸烟史、ART前后血浆HIV RNA载量、血清IL-4水平、巨细胞病毒感染、影像学示支气管扩张、肺气肿、CD4+细胞计数在两组间差异有统计学意义。在多因素分析中,同时纳入ART前后血浆HIV RNA载量,因两者相关性太强未能显示出统计学意义。将其余有统计学意义的单因素作为自变量,进行logistic分析显示,CD4+细胞计数、血清IL-4水平、支气管扩张为AIDS合并COPD的独立危险因素,见表3。
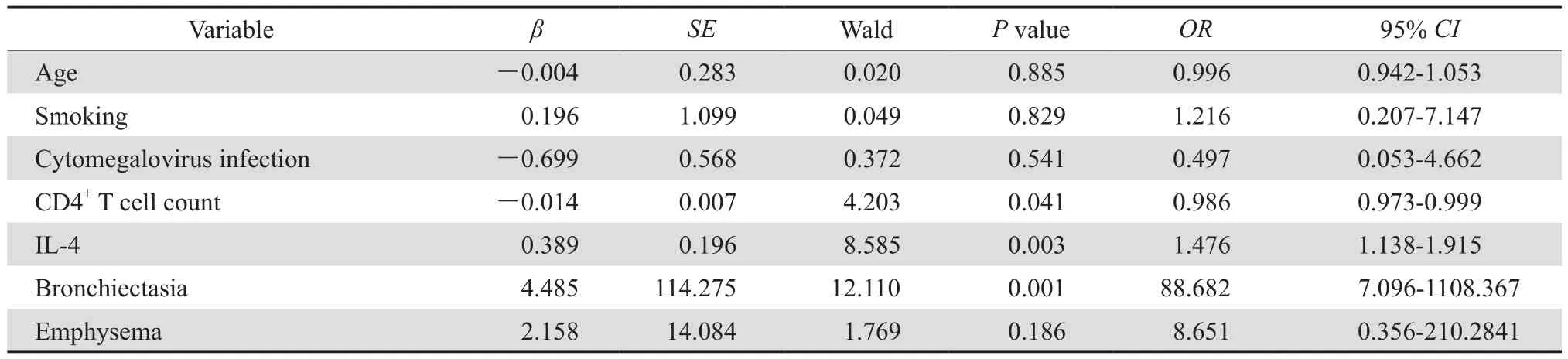
表3 AIDS合并COPD危险因素的多因素logistic回归分析Table 3 Multivariate logistic regression analysis of risk factors for COPD in AIDS patients
2.4 AIDS合并COPD气流受限与ART前后血浆HIV RNA病毒载量的相关性
根据ART前、ART后4周血浆HIV RNA载量分为病毒抑制失败组(ART后HIV RNA载量下降≤1 log10拷贝/mL)、病毒抑制成功组(ART后HIV RNA载量下降>1 log10拷贝/mL),将资料分别按照COPD气流受限程度(GOLD分级)与病毒载量高低进行统计分析。结果发现不同严重程度气流受限在ART前后病毒载量上存在差异,中度气流受限(GOLD 2级)与重度气流受限(GOLD 3级)组相比,在病毒抑制成功组中度气流受限所占比例更高(20例,52.63%),在病毒抑制失败组重度气流受限所占比例更高(15例,75.00%)(P<0.05)。与轻中度气流受限(GOLD 1~2级)相比,病毒抑制失败组(GOLD 3~4级)气流受限更重(16例,76.19%)(χ2=5.015,P=0.025),见表4。

表4 HIV病毒载量与慢阻肺气流受限程度(GOLD分级)的相关性Table 4 Correlation between HIV viral load and pulmonary airflow limitation (GOLD stage)
3 讨论
AIDS合并COPD发生率不同地区差异较大,北美和欧洲AIDS患者中COPD患病率从3.4%到40%以上[3],国内目前缺乏相关流行病学资料。本研究结果显示,与AIDS组相比,合并COPD的AIDS住院患者的年龄较AIDS组更年轻、CD4+细胞计数更低,有吸烟史、合并巨细胞病毒感染,影像学提示支气管扩张、肺气肿的比例更高,差异均具有统计学意义,同时血清IL-4水平、ART前HIV RNA载量及ART后4周HIV RNA载量均高于AIDS组,差异均具有统计学意义,与国外报道一致[5,12-13]。两组患者在性别、体重、有无基础疾病(高血压、糖尿病、冠心病)、AIDS病程时间、心脏彩超检测值(肺动脉高压、右心房、右心室)等方面,差异均无统计学意义。将AIDS合并COPD患者的病程时间进行比较,发现患AIDS病程时间在AIDS首发疾病组与COPD首发疾病组差异无统计学差异,COPD病程时间在两组间差异具有统计学意义,进一步将患COPD与患AIDS病程相差时间再次进行比较发现两组病程相差时间差异有统计学意义(P<0.05)。时间数据显示,患COPD病程时间在AIDS首发疾病组明显短于COPD首发疾病组,其两病病程相差时间也得出同样结果,说明AIDS本身对肺结构及功能的破坏加速了COPD发病,本研究显示,以AIDS为首发疾病明显缩短了患COPD病程时间,缩短了患COPD与患AIDS病程相差时间。国外多项研究也表明HIV感染者合并COPD的发病年龄较轻[6-9],这可能与此类人群肺功能早期和快速下降等有关。AIDS人群发生COPD,系统炎症导致气道重塑可能是危险因素之一,低度系统炎症导致气道炎症和组织结构重塑,这是COPD发病的关键组成部分[5],气道损伤导致气体交换异常也可能是该类患者危险因素之一,发生在肺泡-毛细血管连接处的损伤,如微生物易位、巨细胞病毒感染或急性肺炎,可以导致AIDS患者气体交换不成比例的缺陷,也增加了AIDS并发COPD的风险[13-14],AIDS患者中微生物易位也可能与巨细胞病毒的亚临床感染有关[15]。另HIV载量在血浆中往往与炎性细胞因子水平有关,AIDS和COPD相关的慢性炎症有共同的途径,包括炎症小体激活增加、基质金属蛋白酶 (MMP)的产生、组织纤维化、氧化应激的易感性以及肺免疫细胞的持续激活或功能障碍,促进局部和全身炎症[5,16]。本研究发现,对于AIDS合并COPD的危险因素,不同研究结果之间有所差异,与国外报道不同[17-18],本研究纳入了几种常见的AIDS合并COPD的共患病,在高血压、糖尿病、冠心病、肺动脉高压等方面,两组差异并无统计学意义,在右心房、右心室检测值上也未显示出统计学意义。文献报道患有COPD的AIDS人群通常患有肺动脉高压,而不断恶化的肺动脉压力往往加重气流阻塞或扩散损害[19-20]。高冠状动脉钙化评分、冠状动脉钙化概率、冠心病与较高死亡率之间也存在相关性[19]。这可能与地域差异相关,北美、欧洲等冠心病、高血压、糖尿病的发病率较高,出现心肺并发症的概率较大;本研究纳入AIDS合并COPD样本量有限,肺动脉高压及右心检测值异常病例数较少,不能得出以上结论。
对AIDS组和AIDS合并COPD组临床资料进行单因素分析显示ART前后血浆HIV RNA载量均有统计学意义,在多因素logistic回归分析中,同时纳入ART前后血浆HIV RNA载量,结果显示两者相关性太强,未能在多因素logistic回归中出现统计学差异,可在今后的研究中,扩大样本量,解决该矛盾。在校正年龄、吸烟史、ART前后血浆HIV RNA载量、巨细胞病毒感染、影像学提示肺气肿混杂因素后,多因素logistic回归分析结果显示,CD4+细胞计数降低、血清IL-4水平升高、影像学提示支气管扩张为AIDS合并COPD的独立危险因素。本研究还发现,COPD严重程度与AIDS治疗效果存在一定相关性。根据治疗效果,即ART前、ART后4周血浆的HIV RNA载量[10],将所有患者分为病毒抑制失败组、病毒抑制成功组,按照COPD气流受限程度(GOLD 1~4级)与病毒载量高低进行统计分析。结果发现不同严重程度气流受限在ART前后病毒载量上存在差异,中度气流受限(GOLD 2级)与重度气流受限(GOLD 3级)组相比,在病毒抑制成功组中度气流受限所占比例更高,在病毒抑制失败组重度气流受限所占比例更高(P<0.05);与轻中度气流受限(GOLD 1~2级)相比,病毒抑制失败组气流受限更重(P<0.05)。这或许验证了HIV病毒载量在血浆中持续异常,参与了炎性细胞因子活动,导致肺免疫细胞的持续激活或功能障碍,促进了气道炎症和气道组织结构重塑,从而使COPD的气流受限加重。
总之,本研究结果显示,AIDS合并COPD患者的生活质量更差,AIDS对肺结构及功能的破坏加速了COPD发病,缩短了患COPD病程时间,造成早期快速的肺功能损害,增加死亡风险;CD4+细胞计数、血清IL-4水平、支气管扩张为AIDS合并COPD的独立危险因素;ART效果与COPD严重程度存在一定的相关性。本次研究样本量有限,未能深入分析探讨危险因素及其余相关因素,仍需进一步进行大样本前瞻性研究。
