lncRNA SNHG1调控PI3K/AKT/NF-κB信号通路对小鼠心肌缺血/再灌注损伤的影响*
2022-08-23李小玲阳承艳李洋洁王丽娜陈润奇
杨 涛,李小玲,阳承艳,李洋洁,王丽娜,陈润奇
(广西桂林市人民医院重症医学科,桂林 541002)
急性心肌梗死(AMI)是危害人类健康及生命的心血管疾病之一[1]。溶栓治疗或经皮冠状动脉介入治疗(PCI)是治疗AMI的有效方法[2]。然而,遭受一定时间缺血的组织细胞恢复血流(再灌注)后,组织损伤反而加重,甚至发生不可逆损伤,这一过程称为心肌缺血/再灌注损伤(MIRI)[3]。MIRI 严重影响缺血性心脏疾病患者的预后,且其机制复杂多样,主要包括钙超载、炎症、氧化应激和线粒体功能障碍[4-7]。因此,明确MIRI发病机制、探索新的治疗靶点对AMI的治疗及预后具有重要意义。
长链非编码RNA(lncRNA)是一类真核生物中长度大于200 nt的非编码RNA分子,它们本身不编码蛋白,而是以RNA 的形式在多种层面上(表观遗传调控、转录调控以及转录后调控等)调控基因的表达水平[8]。近年来研究发现,lncRNA 在肿瘤、神经疾病、心血管疾病的发生和发展过程中发挥重要的生物学功能[9]。小核RNA宿主基因1(SNHG1)是由11 号染色体上作为18s 核糖体RNA 重要组成部分的UHG 基因转录而来的lncRNA。研究显示,敲除lncRNA SNHG1可抑制过氧化氢(H2O2)诱导的心肌细胞凋亡[10]。抑制SNHG1 可促进心肌细胞增殖和血管生成,降低心肌梗死后心肌细胞凋亡,改善心功能[11]。但lncRNA SNHG1 在MIRI 中的作用及机制尚不清楚。本研究旨在探讨下调lncRNA SNHG1表达对MIRI小鼠心肌细胞凋亡的影响及其可能机制。
1 材料与方法
1.1 实验动物 SPF 级10~12 周龄C57BL/6J 小鼠18 只,体重20~25 g,购自北京维通利华实验动物技术有限公司,许可证号:SYXK(京)2019-0010。小鼠分笼饲养,自由摄食、饮水,饲养环境温度(25±2)℃,湿度40%~70%。本实验动物处置符合动物伦理学要求。
1.2 实验分组 将18只小鼠随机分为3组,分别为假手术(Sham)组、MIRI组、SNHG1小干扰RNA(si-SNHG1)组,每组6 只。si-SNHG1 组小鼠通过左前胸壁小切口暴露心脏,将100µL 携带si-SNHG1 的腺病毒(滴度为1.0×109pfu/只,由广州瑞博生物公司提供)从左室心尖部向主动脉根部注射,主动脉和肺动脉交叉钳夹20 s。排出空气和血液后,关闭胸腔。注射腺病毒5 d后建立MIRI模型。
1.3 MIRI小鼠模型的建立 用2.5%戊巴比妥麻醉小鼠,仰卧固定于小动物手术台上,连接心电图,行气管插管后连接HX-300S 动物呼吸机,潮气量250 mL/min,呼吸频率120 次/min。沿胸骨左缘第3、4 肋间开胸,打开心包,于左心耳下方2 mm 处穿丝线结扎左冠状动脉前降支。观察小鼠心电图变化,以ST 段抬高作为判断结扎成功的标准。结扎45 min 后松开结扎线,恢复心肌血流供应,再灌注2 h。Sham组仅开胸不结扎。
1.4 心功能检测 再灌注2 h后,应用MyLab 30CV超声系统及10 MHz 线性超声换能器,对各组小鼠进行心脏超声检查。麻醉后将小鼠置于加热垫上并取左侧卧位,用刮毛刀刮除胸部毛发,测量射血分数(EF)、左室短轴缩短率(FS)和心率。由两位实验室技术员双盲法操作,取两者均数。
1.5 实时荧光定量聚合酶链式反应(RT-qPCR)检测心肌组织SNHG1表达 Trizon法提取总RNA,测定RNA 纯度和浓度,逆转录为cDNA,行PCR 扩增。PCR 反应体系:2×ULtraRT one step Buffer 12.5 μL,RNA 1 μg,上、下游引物各1 μL,ULtraRT one step EnzymeMix 0.5 μL,加入无RNA 酶的双蒸水至25 μL。PCR 反应条件:95 ℃预变性2 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s,共40 个循环。引物序列如下:SNHG1上游:5’-CCTAAAGCCACGCTTCTTG-3’,下游:5’-TGCAGGCTGGAGATCCTACT-3’;GAPDH上游:5’-ACCCAGAAGACTGTGGAGG-3’,下游:5’-TTCTAGACGGCAGGTCAGGT-3’。以GAPDH为内参,采用2-ΔΔCT法计算SNHG1mRNA相对表达量。
1.6 心肌病理学观察 心功能检测后将小鼠深度麻醉处死,迅速取出心脏,切下部分心肌组织,置于4%多聚甲醛中固定24 h,脱水,石蜡包埋,5 μm厚连续切片,行苏木精—伊红(HE)染色。光学显微镜下观察心肌组织病变情况并拍照。
1.7 2,3,5-三苯基四唑氯化(TTC)染色检测心肌梗死面积 取新鲜心肌组织,去除心房和大血管,冰PBS 清洗,滤纸吸干水分,置于-20 ℃冰箱中冷冻30 min 后,自心尖起每隔2 mm 垂直于心脏长轴将心脏切成薄片。置于1%TTC溶液(Sigma-Aldrich,美国)中,37 ℃水浴20 min。完成染色后,将心肌薄片置于显微镜下(放大10 倍)观察,拍照。利用Image J 软件测量左心室面积(LV)、缺血面积(AAR,TTC 染为砖红色)和梗死面积(IS,TTC 染色呈灰白色)。梗死面积(%)=IS/AAR×100%。
1.8 TUNEL染色检测心肌细胞凋亡 将心肌组织切片放在60 ℃烤箱中烘烤30 min,二甲苯脱蜡,乙醇脱水,蛋白激酶K 孵化30 min;PBS 冲洗后,加入TdT和Lucifase标记的dUTP,37 ℃下反应1 h;用二氨基联苯胺(DAB)作为底物反应10 min,然后用苏木精进行核染色,在荧光显微镜下拍照、计数。凋亡细胞核为棕黄色,正常细胞核呈蓝色。
1.9 Western blotting 法检测Cleaved caspase-3 和PI3K/AKT/NF-κB蛋白表达 心肌组织中加入蛋白裂解液(含PMSF),于冰上裂解,BCA法测定蛋白浓度;SDS-PAGE 电泳分离蛋白,将蛋白转移至PVDF膜上;加入一抗PI3K(1∶200)、磷酸化(p-)PI3K-p85(1∶300)、AKT(1∶300)、p-AKTser473(1∶300)(Affinity Biosciences,美国)和Cleaved caspase-3(1∶200)、NFκB(1∶300)、p-NF-κB-p65(1∶300)、GAPDH(1∶1 000)(Cell Signaling Technology,美国)4 ℃孵育过夜,TBST 漂洗3 次,每次10 min;加入HRP 山羊抗兔IgG二抗(1:10 000,Cell Signaling Technology,美国)37 ℃下孵育1 h,TBST 漂洗3 次,每次10 min。采用ECL 化学发光法显示蛋白条带,Image-Pro Plus 6.0进行灰度分析。
1.10 统计学方法 所有数据均采用SPSS 26.0 统计软件进行统计分析。计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠心肌组织中lncRNASNHG1表达水平比较 与Sham 组比较,MIRI 组lncRNASNHG1相对表达量升高(P<0.05);与MIRI 组比较,si-SNHG1组lncRNASNHG1相对表达量降低(P<0.05),见图1。
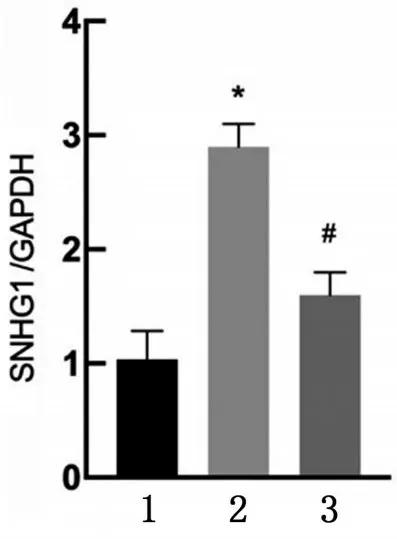
图1 各组小鼠心肌组织中lncRNA SNHG1表达水平比较
2.2 lncRNA SNHG1 表达下调对MIRI 小鼠心功能的影响 3 组小鼠心率比较,差异无统计学意义(P>0.05);与Sham组比较,MIRI组小鼠心室扩大,心壁变薄,下调SNHG1 可改善MIRI 诱导的小鼠心室壁结构异常变化;MIRI 组小鼠EF%和FS%较Sham 组下降(P<0.05);与MIRI 组比较,si-SNHG1组FS%和EF%升高(P<0.05),见图2。

图2 各组小鼠心功能指标比较
2.3 lncRNA SNHG1 表达下调对MIRI 小鼠心肌梗死面积的影响 MIRI 组小鼠心肌梗死面积大于Sham 组(P<0.01);与MIRI 组比较,si-SNHG1 组小鼠心肌梗死面积减小(P<0.01),见图3。
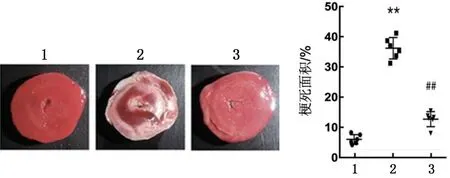
图3 各组心肌梗死面积比较
2.4 lncRNA SNHG1 基因下调对MIRI 小鼠心肌病理损伤的影响 Sham组心肌细胞横纹和闰盘清晰,心肌纤维结构清晰,排列完整紧密,染色均匀,细胞核完好,无细胞坏死现象;MIRI组组织结构不连续,细胞排列紊乱,细胞核溶解和皱缩明显,心肌纤维撕裂,细胞核深染;si-SNHG1组心肌细胞排列较为完整,坏死细胞减少,见图4。
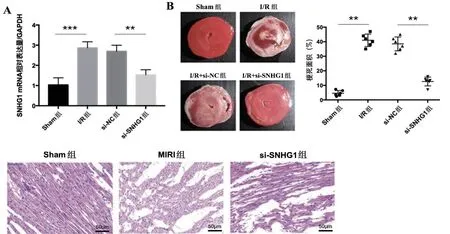
图4 各组心肌组织HE染色图(×400)
2.5 LncRNA SNHG1对MIRI小鼠心肌细胞凋亡的影响 与Sham 组比较,MIRI 组心肌细胞凋亡率升高(P<0.01);与MIRI 组比较,si-SNHG1 组心肌细胞凋亡率降低(P<0.01),见图5。

图5 各组心肌细胞凋亡率比较(×200,比例尺=25 μm)
2.6 LncRNA SNHG1对小鼠心肌组织Cleaved caspase-3 蛋白表达的影响 与Sham 组比较,MIRI 组Cleaved caspase-3 蛋白表达上调(P<0.001);与MIRI组比较,si-SNHG1组Cleaved caspase-3蛋白表达下调(P<0.001),见图6。
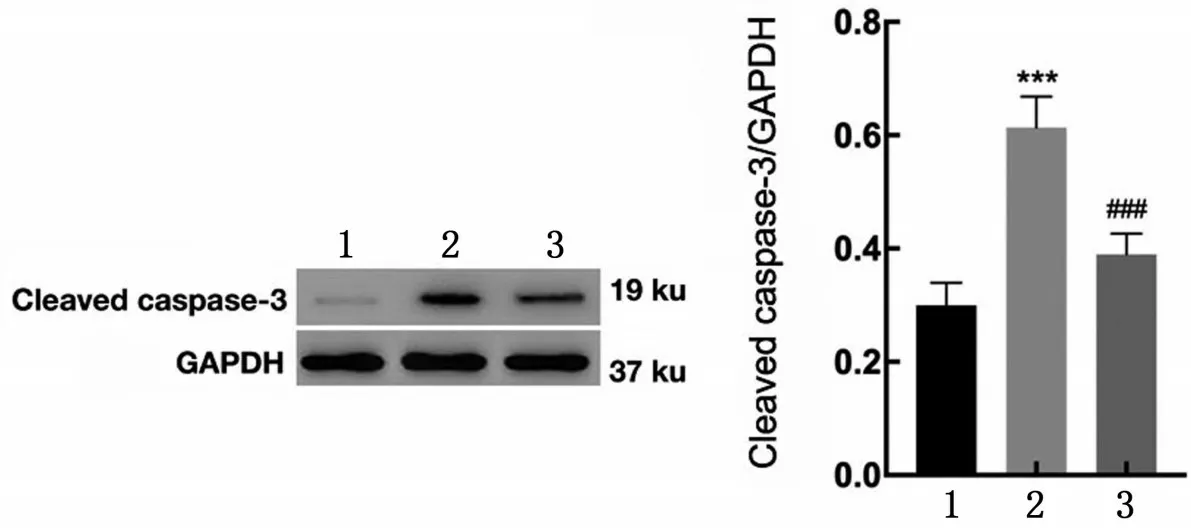
图6 LncRNA SNHG1对小鼠心肌组织凋亡相关基因表达的影响
2.7 各组PI3K/AKT/NF-κB 信号通路蛋白表达比较 3 组间心肌组织PI3K 和AKT 蛋白表达水平无明显差异(P>0.05)。与Sham 组比较,MIRI 组p-PI3K和p-AKT表达水平降低,NF-κB蛋白表达升高(P<0.05);与MIRI 组比较,si-SNHG1 组p-PI3K 和p-AKT表达水平升高,而NF-κB蛋白表达降低(P<0.05),见图7。
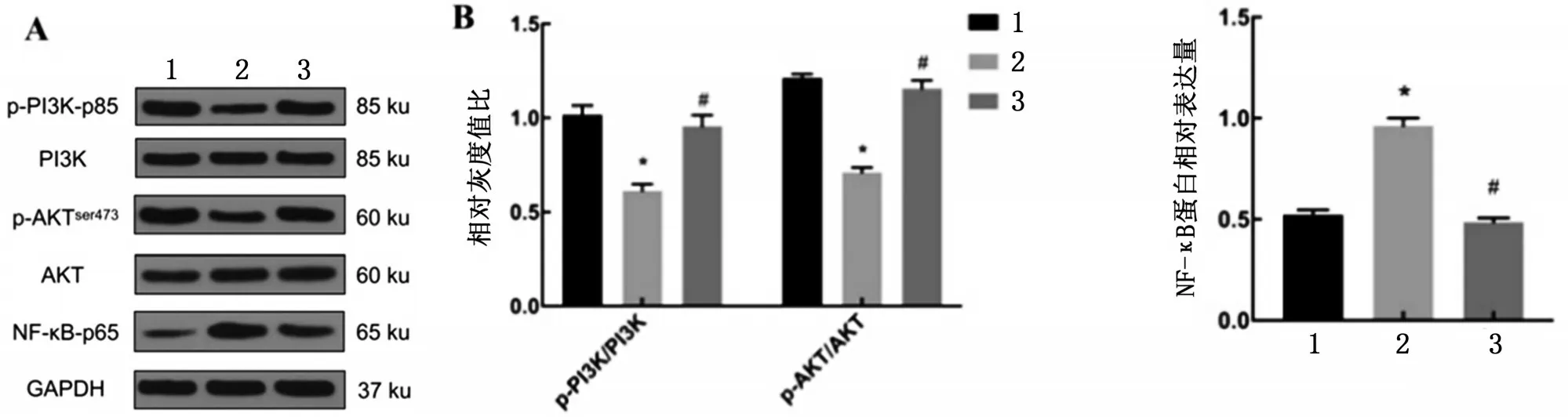
图7 各组PI3K/AKT/NF-κB信号通路蛋白表达比较
3 讨论
本研究结果显示,MIRI 组SNHG1 表达水平升高,心肌组织损伤程度和梗死面积增加,si-SNHG1组小鼠心肌SNHG1 表达降低,心肌损伤程度和梗死面积明显减小。TUNEL 染色结果显示,si-SNHG1 逆转了MIRI 对心肌细胞凋亡的促进作用,并明显下调心肌组织中凋亡蛋白Cleaved caspase-3表达。提示SNHG1表达水平与MIRI引起的心肌细胞凋亡和心脏功能损伤相关。
在MIRI 过程中涉及到多种信号通路,其中PI3K/AKT 通路在减轻MIRI 中发挥重要作用,该通路持续激活可抑制缺血性损伤诱导的细胞凋亡[12]。PI3K是一种具有丝/苏氨酸激酶活性的细胞内磷脂酰肌醇激酶,由二聚体、调节亚基(p85)和催化亚基(p110)组成。生理状态下,AKT 以失活状态存在,当受到外界刺激时,激活的PI3K 可引起AKT 的Ser47和Thr308残基发生磷酸化,AKT激活。此外,炎症反应亦是MIRI 的重要病理生理过程,心肌细胞凋亡和炎症反应与NF-κB 通路的激活密切相关[13]。NF-κB 是AKT 的重要下游元素,PI3K/AKT通路主要通过抑制下游转录因子NF-κB 来调控细胞凋亡进程。Luan 等[12]报道,PI3K/AKT 激活可抑制NF-κB表达,减轻MIRI诱导的心肌损伤,抑制心肌细胞凋亡和炎症反应。此外,lncRNA 对心肌细胞的凋亡调控也发挥了重要的作用。研究发现,抑制lncRNA Gpr19可通过miR-324-5p/Mtf1轴抑制心肌细胞凋亡和氧化应激,从而减轻AMI后的再灌注损伤[14]。抑制lncRNA SNHG1 亦能减弱H2O2对心肌细胞活性和凋亡的影响[10]。本研究结果显示,siRNA 干扰SNHG1 表达可显著上调心肌组织中PI3K/AKT 磷酸化水平,并抑制NF-κB 蛋白表达。提示干扰lncRNA SNHG1 表达可能通过激活PI3K/AKT 信号通路,抑制NF-κB 表达,减少心肌细胞凋亡,缩小心梗面积,改善心功能。
综上,干扰lncRNA SNHG1 表达可以通过激活PI3K/AKT 并抑制NF-κB 信号转导,抑制心肌细胞凋亡显著减轻MIRI诱导的心肌损伤。SNHG1可能是MIRI治疗的潜在靶点。
