BPIV3 NP蛋白的原核表达及其对BPIV3灭活疫苗免疫增强作用的研究
2022-08-23王宇琛田广原周雅坪赵红梅孙雅婕赵逢淼卞宇晨于佳梁郝永清
王宇琛,田广原,周雅坪,郭 婷,赵红梅,孙雅婕,赵逢淼,卞宇晨,于佳梁,郝永清
(内蒙古农业大学,兽医微生物学与免疫学实验室,呼和浩特 010018)
牛副流感病毒3型(Bovine parainfluenza virus type 3,BPIV3)在世界范围内分布,是引起犊牛和成年牛呼吸道疾病综合征(BRDC)的主要病原之一[1]。发病牛精神萎缩,食欲不振,伴随着严重的呼吸道症状。一些发病的牛体温升高,甚至呼吸困难[2]。感染BPIV3的牛肺脏组织会出现渐进式的损伤,并引起免疫抑制,在不合理的饲养或长途运输刺激的情况下会导致细菌或支原体的继发感染,大大增加牛的死亡率[3]。目前疫苗接种是预防和控制该疾病的重要措施。BPIV3疫苗在中国尚未使用[4],因此迫切需要开展相关疫苗研究,以有效预防和控制BPIV3感染。
BPIV3是副黏病毒亚科(Paramyxovirinae)呼吸道病毒属(Respirovirus)的单分子负链RNA病毒,具有血凝素和神经氨酸酶活性,其基因组至少编码6种蛋白,包括NP、P、M、F、HN和L蛋白[5-6]。其中NP蛋白为核衣壳蛋白,约含515个氨基酸,单体呈螺旋状结构,大量的NP蛋白构成中空管道状结构,即病毒的核衣壳[7]。病毒被NP蛋白包裹,避免了核酸酶对病毒RNA的降解。NP蛋白含有2个结构域:与RNA结合的N-端结构域,高度保守;C-端结构域,裸露于核衣壳表面,含有对蛋白酶敏感的磷酸化位点和抗原结合位点。因此,NP蛋白具有较好的免疫原性,可刺激机体产生相应的免疫应答[8]。
本试验设计针对NP基因的特异性引物,原核表达BPIV3 NP蛋白并将其与BPIV3灭活疫苗共同免疫新西兰白兔,以此验证NP蛋白是否对BPIV3灭活疫苗具有免疫增强作用,以期为研制新型的BPIV3疫苗产品提供依据,为BPIV3灭活疫苗的免疫方法优化提供思路。
1 材料与方法
1.1 材料
BPIV3(病毒滴度为3.162×107TCID50/mL)、pET-32a(+)质粒、牛肾细胞MDBK(CSTR:19375.09.3101BOVGNO7)均保存于内蒙古农业大学兽医学院微生物学与免疫学实验室。2~3月龄2.5 kg健康雄性新西兰白兔购自呼和浩特周边养殖场。
AxyPrep总RNA小量制备试剂盒、AxyPrep DNA凝胶回收试剂盒、AxyPrep质粒DNA小量试剂盒(康宁生命科学有限公司);Ni-IDA蛋白纯化试剂盒及BCA法蛋白质浓度测定试剂盒(增强型)、脱脂乳(生工生物工程(上海)股份有限公司);EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒、大肠杆菌BL21(DE3)感受态细胞(北京全式金生物技术有限公司);T4 DNA连接酶、DNA聚合酶、限制性内切酶(TaKaRa公司);山羊源BPIV3标准阳性血清(VMRD公司);辣根过氧化物酶(HRP)标记的兔抗山羊IgG、HRP标记的山羊抗兔IgG(北京博奥森生物技术有限公司)。
1.2 NP蛋白生物信息学分析及引物设计与合成
根据GenBank公布的BPIV3NP基因组序列(登录号:KU198929.1),利用DNAStar对BPIV3NP基因的抗原性、亲水性及表面可及性进行分析,筛选主要抗原域。根据生物信息学分析结果,选择NP基因优势片段,通过Primer Premier 5.0软件设计1段针对NP基因抗原优势片段的特异性引物,同时加入EcoRⅠ、XholⅠ酶切位点(下划线处)及保护性碱基,引物序列为:F:5′-CGGAATTCCGG-TTAGAGGCATTTAGACAAGACG-3′;R:5′-CC-CTCGAGGGTCACGTGCCACTGCTTGACCTAG-TT-3′,引物由生工生物工程(上海)股份有限公司合成。
1.3 NP基因扩增及表达载体的构建
利用总RNA小量制备试剂盒及EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix提取BPIV3基因组总RNA并反转录为cDNA,PCR扩增NP基因。PCR反应体系50 μL:5×Prime STAR Buffer (Mg2+Plus)10 μL,上、下游引物(10 μmol/L)各1 μL,dNTP Mixture (2.5 mmol/L)4 μL,PrimeSTAR HS DNA Polymerase (2.5 U/μL)0.5 μL,cDNA模板1 μL,ddH2O 32.5 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火45 s,72 ℃延伸1 min,共32个循环;72 ℃终延伸10 min;4 ℃保存。PCR产物进行1.0%琼脂糖凝胶电泳检测,将目的片段用DNA凝胶回收试剂盒回收后获得NP基因并送至生工生物工程(上海)股份有限公司测序。
利用限制性内切酶EcoRⅠ和XholⅠ对测序结果正确的NP基因及pET-32a(+)表达质粒进行双酶切,经1.0%琼脂糖凝胶电泳回收后通过T4 DNA连接酶16 ℃过夜连接,连接产物转化大肠杆菌BL21(DE3)感受态细胞,然后涂布于氨苄抗性的LB固体培养基上,过夜培养后通过菌落PCR筛选阳性菌落,扩大培养阳性菌落后提取质粒,进行双酶切鉴定,对酶切正确的质粒进行测序,最后获得重组质粒并命名为pET-32a-NP。
1.4 重组蛋白的诱导表达及可溶性分析
将阳性菌液1∶100接种于含氨苄抗生素的LB液体培养基中,在37 ℃、180 r/min的恒温培养箱中培养至D450 nm值为0.6~0.8时,加入终浓度为1 mmol/L的IPTG,37 ℃、180 r/min诱导表达4 h;将诱导表达后的菌液8 000 r/min离心10 min,弃上清,用PBS重悬,反复3次。超声波破碎后,12 000 r/min离心10 min并分离上清和沉淀,将其与pET-32a(+)空质粒进行SDS-PAGE,观察重组蛋白质的表达情况并分析其可溶性。
1.5 重组蛋白包涵体溶解
将诱导表达菌液4 ℃、8 000 r/min离心10 min后将菌体沉淀按10∶1的比例用含8 mol/L尿素的Tris-HCl缓冲液重悬,冰上超声破碎至清亮(250 W,超声4 s,间歇5 s,功率35%)后4 ℃、12 000×g离心15 min,收集上清,将沉淀用含8 moL/L尿素的Tris-HCl缓冲液重悬,继续超声5 min,4 ℃、12 000×g离心20 min,取上清,获得裂解的包涵体。
1.6 重组蛋白的纯化
将已裂解的重组蛋白包涵体用0.45 μL滤器过滤,按照Ni-IDA蛋白纯化试剂盒说明书纯化蛋白,用Bingding Buffer平衡Ni层析柱,将过滤后的蛋白加入层析柱,冰上结合 1 h,用Washing Buffer和Elution Buffer洗层析柱,分别收集洗脱后的液体,进行SDS-PAGE鉴定。
1.7 重组蛋白包涵体的复性
将透析袋在大体积的2% NaHCO3和1 mmol/L EDTA(pH 8.0)中煮沸10 min,用蒸馏水清洗干净,然后再将透析袋在1 mmol/L EDTA(pH 8.0)中煮沸10 min,彻底清洗透析袋。采用梯度透析法将重组蛋白复性。
1.8 重组蛋白Western blotting检测
纯化后的重组蛋白包涵体经SDS-PAGE分析后,14 V 30 min转移至PVDF膜上,用5%脱脂乳37 ℃封闭4 h;用TBST缓冲液洗涤5次,每次10 min;加入山羊源BPIV3阳性血清(1∶2 000)作为一抗,4 ℃过夜孵育;用TBST缓冲液洗涤5次,每次10 min;用HRP标记的鼠抗山羊IgG(1∶6 000)作为二抗,在室温摇床孵育2 h;用TBST缓冲液洗涤5次,每次10 min;用ECL显色。
1.9 重组蛋白对BPIV3灭活疫苗免疫原性的影响
用BCA法蛋白浓度测定试剂盒测定浓缩后的蛋白。用0.3%甲醛灭活病毒滴度为3.162×107TCID50/mL的BPIV3,制备灭活疫苗。将8只新西兰白兔分成4组,每组2只,分别为灭活疫苗组、NP蛋白组、灭活疫苗和NP蛋白混合组和弗氏佐剂对照组。各免疫组免疫剂量如表1所示,注射体积均为1 mL,对照组为500 μL PBS与500 μL佐剂混合注射。首免采用弗氏完全佐剂1∶1混合,14 d后进行二免,并更换为弗氏不完全佐剂,免疫途径为肌内注射,免疫前称量体重保证试验稳定性,从首免前采血后每隔7 d采集血液分离血清。

表1 免疫分组及免疫剂量
1.10 间接ELISA方法测特异性抗体滴度
将BPIV3 NP蛋白稀释到4 μg/mL后包被于96孔酶标板上,每孔100 μL,4 ℃过夜包被,弃液,洗涤5次,每次2 min;将1% BSA溶液作为封闭液加入到96孔板中,每孔100 μL,37 ℃放置2 h,洗涤,烘干;将制备好的免疫前血清和免疫后7、14、21和28 d的血清从1∶2开始倍比稀释到1∶224,同时设立稀释度为1∶100的阳性和阴性对照,每孔100 μL,37 ℃反应1 h,洗涤;加100 μL 1∶5 000稀释的酶标二抗,于37 ℃反应1 h,洗涤;每孔加入100 μL 20% TMB显色液,避光反应10 min后加入50 μL终止液,用酶标仪测定D450 nm值。
1.11 血清中和试验测中和抗体滴度
将采集的血液样品于4 ℃静置过夜,3 000×g离心5 min,吸取上清即为待检血清。将血清2倍倍比稀释到2-8,放置于56 ℃水浴锅灭活30 min。将病毒稀释到100 TCID50/200 μL,病毒稀释液与血清稀释液按1∶1等量混合均匀,37 ℃培养1 h,接种于96孔细胞培养板中,每个稀释度的血清样品接4孔,每孔200 μL,设立只接毒的阳性对照和阴性对照。置于37 ℃恒温培养箱中,逐日观察细胞病变。
2 结 果
2.1 NP基因主要抗原域
用DNAStar软件中的Protean筛选出基因编码靠近C-端的193-368位氨基酸序列为主要抗原域,含有抗原结合位点,平均抗原指数在0.4~1.7之间,亲水指数为0~1.5,亲水性和表面可及性较高(图1)。
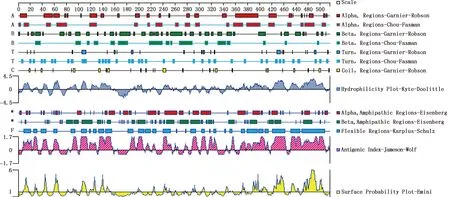
图1 BPIV3 NP 基因主要抗原域分析Fig.1 Analysis of major antigenic domains of BPIV3 NP gene
2.2 NP基因扩增
提取BPIV3基因组总RNA,对NP基因抗原区片段进行RT-PCR扩增,获得大小为525 bp的目的片段(图2),与试验预期相符。

M,Trans2K DNA Marker;1~4,NP基因;5,阴性对照M,Trans2K DNA Marker;1-4,NP gene;5,Negative control图2 BPIV3 NP基因RT-PCR扩增结果Fig.2 Results of RT-PCR amplification of BPIV3 NP gene
2.3 NP基因重组表达载体的构建及鉴定
将鉴定为阳性的pET-32a-NP重组质粒进行双酶切,通过1.0%琼脂糖凝胶电泳检测,得到大小约为5 900和525 bp的2条片段(图3),符合预测结果,说明重组质粒构建成功。
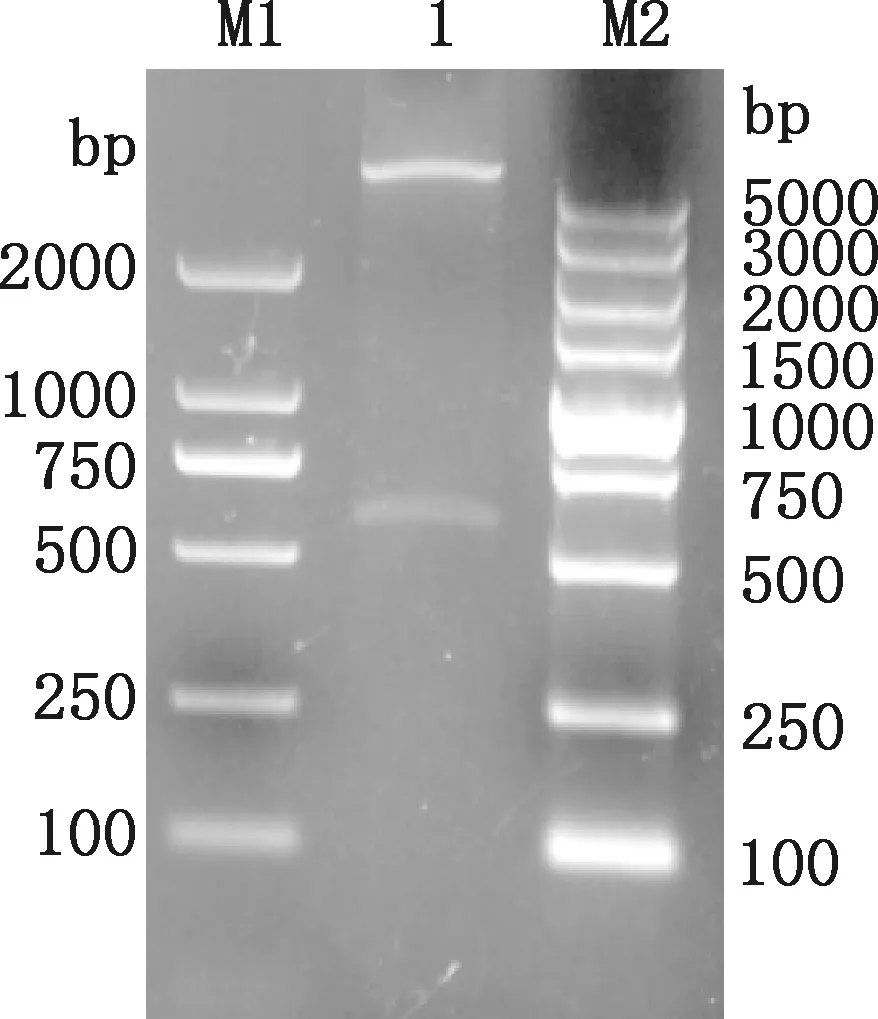
M1,Trans2K DNA Marker;1,pET-32a-NP;M2,DL5000 DNA Marker图3 重组质粒pET-32a-NP双酶切鉴定Fig.3 Identification of recombinant plasmid pET-32a-NP by double digestion
2.4 重组质粒的诱导表达及可溶性分析
SDS-PAGE结果显示,与pET-32a(+)空质粒对照相比,重组质粒诱导表达沉淀在约50 ku处出现条带(图4),大小与预期相符,说明该蛋白以包涵体形式表达。

M,Blue Plus Protein Marker;1,诱导前pET-32a(+)空质粒;2,诱导后pET-32a(+)空质粒;3,诱导前重组质粒上清;4,诱导前重组质粒沉淀;5,重组质粒诱导表达上清;6,重组质粒诱导表达沉淀M,Blue Plus Protein Marker;1,pET-32a(+)empty plasmid before induction;2,Induced expression of pET-32a(+)empty plasmid;3,Recombinant plasmid supernatant before induction;4,Recombinant plasmid precipitation before induction;5,Induced expression supernatant of recombinant plasmid;6,Induced expression precipitation of recombinant plasmid图4 重组蛋白表达鉴定结果Fig.4 Expression and identification results of recombinant protein
2.5 重组蛋白的纯化
SDS-PAGE结果显示,蛋白在经过4次50 mmol/L咪唑的洗脱液洗脱后在第1次Elution Buffer洗脱时的目的蛋白量最大且纯度较高,蛋白分子质量大小约为50 ku(图5),证明重组蛋白纯化成功。

M,Blue Plus Protein Marker;1,流穿液;2~5,Washing Buffer第1~4次洗脱;6~9,Elution Buffer第1~4次洗脱M,Blue Plus Protein Marker;1,Flow through liquid;2-5,The 1st to the 4th elution of Washing Buffer,respectively;6-9,The 1st to the 4th elution of Elution Buffer,respectively图5 重组蛋白纯化SDS-PAGE 分析Fig.5 SDS-PAGE analysis of recombinant protein purification
2.6 重组蛋白Western blotting鉴定
用纯化后的重组蛋白进行Western blotting鉴定,在约50 ku处出现特异性条带(图6),证明重组蛋白与山羊源BPIV3阳性血清发生反应,具有反应原性。

图6 Western blotting检测重组蛋白反应原性Fig.6 Detection of reactogenicity of recombinant protein by Western blotting
2.7 重组蛋白的蛋白定量
用BCA法蛋白质浓度测定试剂盒(增强型)测得纯化浓缩后的蛋白浓度为400 μg/mL。
2.8 间接ELISA方法测抗体滴度
由图7可知,新西兰白兔血清抗体效价在首免后7 d达到第一次高峰,免疫组抗体效价在1∶27到1∶29之间,在二免前,NP蛋白组的抗体效价最高,达到1∶212;从二免开始,抗体效价持续升高,在首免后28 d时,灭活疫苗和NP蛋白混合组抗体效价超过NP蛋白组(1∶217),达到1∶218,灭活疫苗组抗体效价为1∶211,对照组均无变化。
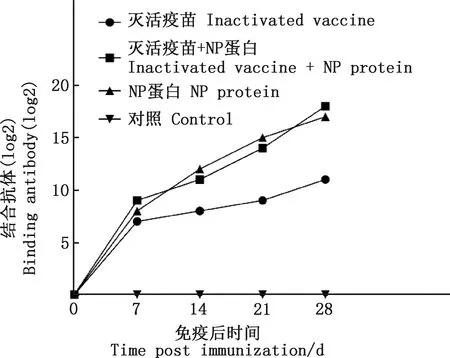
图7 新西兰白兔血清抗体滴度变化Fig.7 Changes of serum antibody titer of New Zealand White rabbits
2.9 血清中和试验测中和抗体滴度
由图8可知,免疫组的中和抗体效价持续增高,对照组无变化,在首免后28 d时,灭活疫苗组、灭活疫苗和NP蛋白混合组及NP蛋白组的中和抗体效价分别为1∶23.32、1∶24.98和1∶24.48,混合疫苗组的中和抗体效价高于其他免疫组。

图8 新西兰白兔血清中和抗体滴度变化Fig.8 Changes of serum neutralizing antibody titer in New Zealand White rabbits
3 讨 论
自1959年Reisinger等[9]从美国犊牛肾脏首次分离到BPIV3后,英国、法国、加拿大、澳大利亚也都相继有BPIV3感染的报道[10],目前BPIV3已呈世界性分布。研究表明,BPIV3已在中国内蒙古、山西、山东、黑龙江等地存在[11],说明BPIV3在国内的流行非常普遍并且很严重[12]。但目前国内对BPIV3的研究还相对较少,因此亟需开展相关研究以便对BPIV3感染实施有效防控。BPIV3在第一次被发现后就有相关学者开始研究相关疫苗[13],20世纪60~70年代研制出了灭活疫苗,免疫后牛表现出全身性的或局部性的体液免疫[13-15],在20世纪60年代也研制出了弱毒疫苗,但有毒力返强等安全性问题,之后通过改进,弱毒疫苗的安全性大大提高[16-17],在国外针对BPIV3的灭活疫苗和弱毒苗已逐渐商品化[18]。也有人利用复制缺陷型的痘病毒作为表达载体来表达BPIV3的糖蛋白,肌内注射或滴鼻都可诱导产生中和抗体[19]。
NP蛋白是BPIV3中含量最高的蛋白,同时是BPIV3的主要抗原成分,具有很好的反应原性和免疫原性,与F和HN蛋白相比,NP蛋白高度保守同时与抗原的生成和蛋白酶磷酸化等具有重要的关系[8],因此,本试验选择NP蛋白作为BPIV3灭活疫苗的辅助蛋白,同时NP蛋白的成功表达也为以NP蛋白为抗原建立间接ELISA方法检测未知抗体打下坚实的基础。
本研究采用大肠杆菌表达系统,其具有操作简单、成本低、周期短、表达量高等优点,是获得外源表达蛋白的首选方案[20]。但研究发现当外源基因在大肠杆菌中高效表达时,有时会导致二硫键不能正确进行配对,过多蛋白间的非特异结合从而导致形成不可溶的包涵体[21]。为获得有活性的目的蛋白,则需使用变性剂对包涵体进行变性溶解再进行复性操作,最后经透析去除变性剂[22],得到目的蛋白。本试验中NP蛋白呈包涵体形式表达,可能是在设计引物时,部分序列的亲水性不高,导致整个蛋白呈包涵体形式表达,同时NP蛋白纯化过程也是试验的一个难点,不同浓度咪唑的洗脱液对NP蛋白的洗脱效率都不高,50 mmol/L咪唑的洗脱液虽能有效将杂蛋白洗脱,但NP蛋白也损失严重,因此,NP蛋白的可溶性表达及纯化的条件还需进一步研究。
正黏病毒科与副黏病毒科的区分是以其核酸是否分节为标准,查阅相关资料后发现有人通过表达属于正黏病毒科的流感病毒的NP蛋白,将其免疫小鼠后,并没有降低受感染小鼠的病毒初始复制率,也没有检测到中和抗体,但其启动了对A型流感病毒的交叉反应性细胞毒性T细胞反应(CTL),NP蛋白对机体的保护作用可能由交叉反应性CTL介导[23];也有免疫研究表明,同为副黏病毒科呼吸道病毒属的仙台病毒,其NP蛋白刺激机体产生的IgG抗体远高于HN和F蛋白,可诱导保护性免疫,特别是在攻毒感染后期[24]。因本次试验并未做攻毒试验,因此暂不能确定单独免疫NP蛋白是否可有效保护机体免受病毒侵袭,以及NP蛋白进入机体后具体介导体液免疫反应,还是通过激活宿主体内T细胞产生细胞免疫而保护机体。
为验证免疫组之间抗体水平差异是否为NP蛋白辅助BPIV3灭活疫苗产生,本试验通过BPIV3的不同疫苗对新西兰白兔进行免疫,运用间接ELISA和血清中和试验来测定血清中的抗体,试验结果表明新西兰白兔在免疫28 d后各免疫组都能产生特异性抗体和中和抗体。灭活疫苗组、NP蛋白组及灭活疫苗和NP蛋白混合组的特异性抗体效价分别达到1∶211、1∶217和1∶218,中和抗体滴度分别达到1∶23.32、1∶24.48和1∶24.98。灭活疫苗和NP蛋白混合组的特异性结合抗体和中和抗体效价虽然在二免前不如NP蛋白组,但二免14 d后抗体效价在3组中都是最高的。综上表明,少量NP蛋白的加入便可增强BPIV3灭活疫苗的免疫水平,相关文献如E2蛋白也可增强牛病毒性腹泻(BVDV)灭活疫苗的免疫效果[25]。因此,在灭活疫苗中加入保护性抗原很可能是提高灭活疫苗免疫效果的一种新方式,为BPIV3及伴随的BRDC的防控提供新的方法策略。
4 结 论
本试验成功表达了纯度较高的BPIV3 NP蛋白,将其与BPIV3灭活疫苗共同免疫新西兰白兔,结果证明NP蛋白的加入可大幅提高BPIV3灭活疫苗的免疫水平。
