pH值对槲皮素纳米银粒子结构及催化降解染料性能的影响
2022-08-22邢铁玲陈国强张雪根
张 俊, 姚 平,, 邢铁玲, 陈国强, 张雪根
(1.苏州经贸职业技术学院 a.纺织服装与艺术传媒学院; b.江苏省高端纺织智造工程研究中心,江苏 苏州 215009;2.苏州大学 a.纺织与服装工程学院; b.现代丝绸国家工程实验室,江苏 苏州 215023; 3.盛虹集团有限公司,江苏 吴江 215228)
纳米银材料因其物理化学性质稳定而在抗菌、催化、电学、生物材料等方面有着广泛的应用[1]。纳米银粒子的常见制备方法包括物理法、化学法和生物法[2-3],其中绿色环保且价格低廉的生物法受到了广泛的关注[4-5]。在生物法制备纳米银的过程中,植物多酚类物质的选择和使用至关重要。槲皮素作为最常见的黄酮类化合物,具有多种生物活性和抗氧化性能,在癌症、心血管疾病的临床治疗方面起着重要作用。根据槲皮素的化学结构可知(图1[6]),槲皮素分子结构中存在五个羟基,预期可以利用羟基弱的还原性制备纳米银粒子[7]。目前,有关槲皮素纳米银粒子的制备研究基本未见。
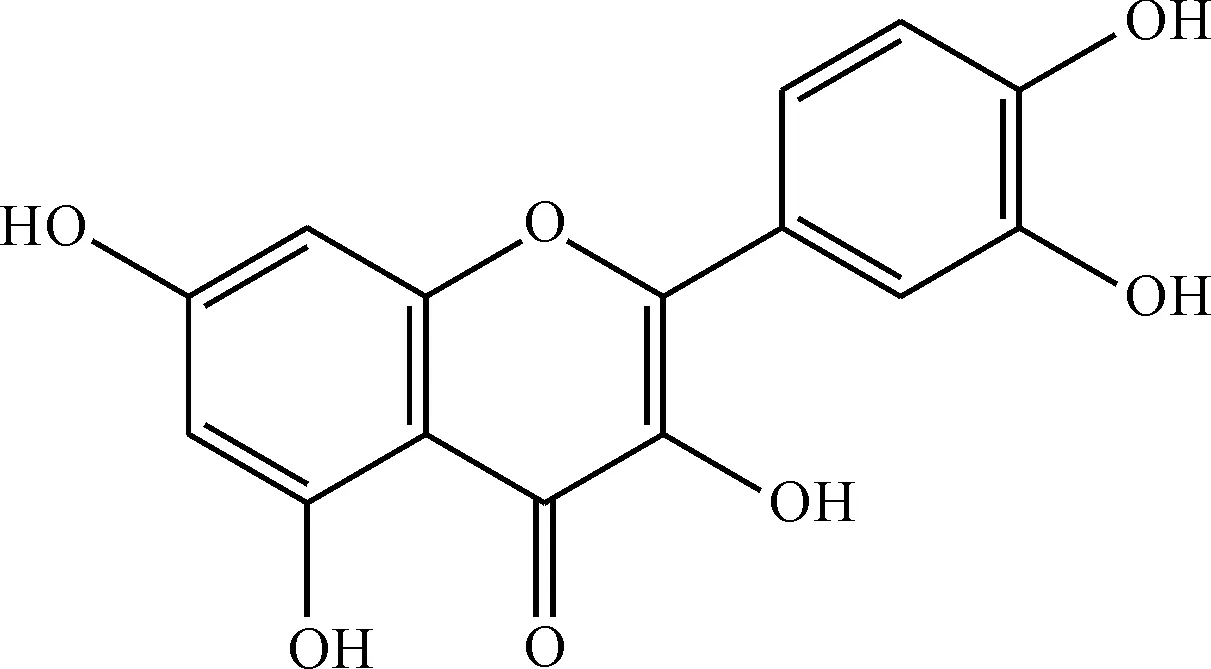
图1 槲皮素的化学结构Fig.1 Chemical structure of quercetin
本文以槲皮素为生物还原剂来制备纳米银粒子,通过测定槲皮素纳米银溶液的紫外-可见吸收光谱曲线确定纳米银粒子的成功制备,并使用透射电子显微镜来确定槲皮素纳米银粒子的形貌特征。此外,由于溶液的pH值会极大地影响纳米银粒子的结构,本文拟在不同pH值条件下制备槲皮素纳米银粒子,并以直接橙26和直接红23染料为目标降解染料,讨论不同pH值条件下制备的槲皮素纳米银粒子催化性能的差异,为后续研究提供理论依据和实践基础。
1 材料和方法
1.1 试剂与测试仪器
实验所用试剂:硝酸银(AR,99.8%)、硼氢化钠(98%)和槲皮素(95%)(上海阿拉丁生化科技股份有限公司),调节溶液pH值所用氢氧化钠(国药集团化学试剂有限公司),目标降解染料直接橙26和直接红23的相关信息如表1所示,实验用水为去离子水(市售)。
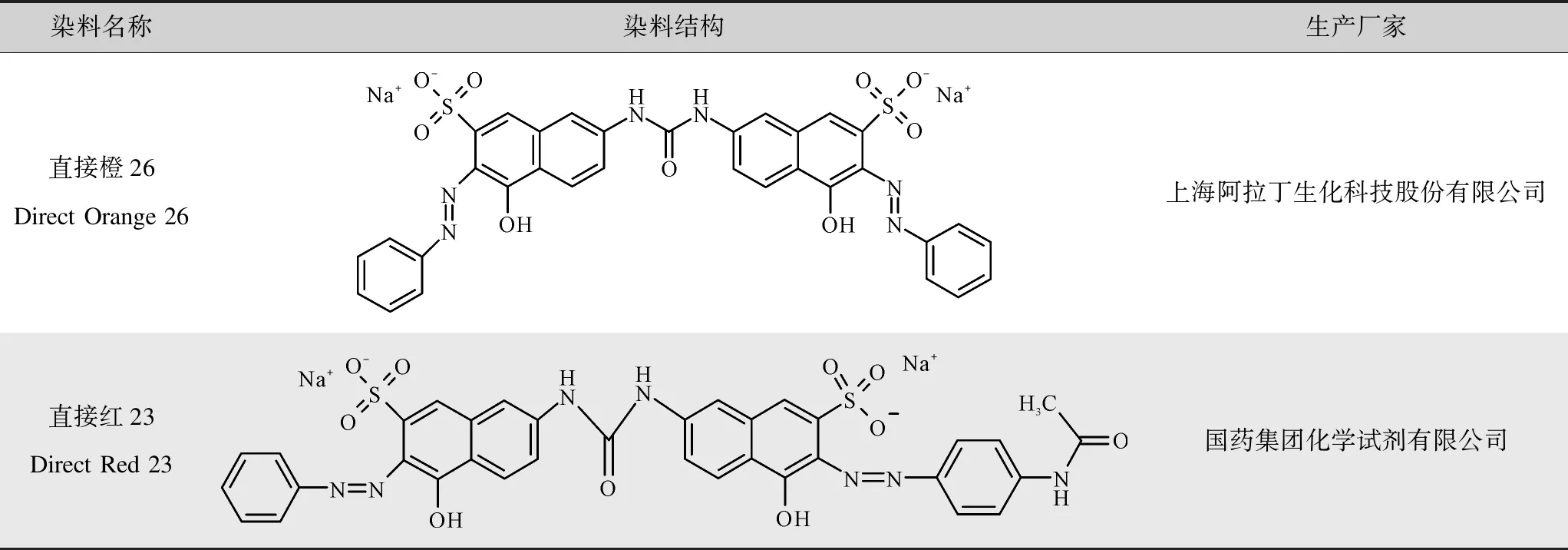
表1 实验所用染料情况Tab.1 Dyes used in the experiments
实验所用测试仪器:TU1900紫外-可见分光光度计(北京谱析标准技术有限公司),BSA224S万分之一电子分析天平(德国赛多利斯公司),S220-K SevenCompact台式pH值计(梅特勒-托利多集团),Zetasizer Nano ZS马尔文激光粒度仪(英国Malven仪器有限公司),TECNAI G2 F20 200 kV场发射透射电子显微镜(美国FEI公司)。
1.2 实验方法
1.2.1 槲皮素纳米银粒子的制备
配制一定摩尔浓度的硝酸银溶液(0.001 mol/L),加入2.0 mL经过滤的热槲皮素饱和溶液(90 ℃条件下在100 mL蒸馏水中加入0.20 g槲皮素制备),使用0.10 g/L氢氧化钠溶液调节溶液pH值至设定的pH值,用振荡水浴锅持续振荡反应溶液,反应温度为95 ℃,反应时间为90 min。此外,分别把不同pH值所制备的槲皮素纳米银粒子记为QP1(pH 6.085)、QP2(pH 6.503)和QP3(pH 7.012)。
1.2.2 槲皮素纳米银粒子的表征
采用TU1900紫外-可见分光光度计测定槲皮素纳米银溶液的紫外-可见吸收光谱曲线(测试波长范围为200~700 nm),以确定纳米银粒子的成功制备;采用TECNAI G2 F20 200 kV场发射透射电子显微镜实现对槲皮素纳米银粒子的可视化展现,从而确定槲皮素纳米银粒子的形貌特征;采用Zetasizer Nano ZS马尔文激光粒度仪确定不同pH值条件下制备的槲皮素纳米银粒子的平均粒径和粒径分布情况。
1.2.3 槲皮素纳米银粒子对直接染料的催化降解测试
分别配制一定体积的直接橙26染料和直接红23染料溶液(质量浓度为100 mg/L),每次准确移取3.0 mL染料溶液至石英比色皿中,依次加入0.05 mL的硼氢化钠溶液(0.2 mol/L)和0.05 mL的槲皮素纳米银溶液,使用TU1900紫外-可见分光光度计间隔3 min或5 min测定混合溶液的紫外-可见吸收光谱曲线,从而确定染料的催化降解性能,实验的测定温度为24 ℃(室温)。
2 结果与分析
2.1 槲皮素纳米银粒子的制备
首先在溶液pH值为6.085的条件下制备槲皮素纳米银粒子,并测定槲皮素和槲皮素纳米银溶液的紫外-可见吸收光谱曲线,结果如图2所示。从图2可以看到,槲皮素纳米银溶液在416 nm处存在一个明显的吸收峰,由于槲皮素溶液在300~700 nm波长范围不存在明显的吸收峰(图2(a)),所以基本可以判定416 nm处的吸收峰为槲皮素纳米银粒子的表面等离子体共振(Surface Plasmon Resonance,SPR)峰,其吸光度值为1.917。本课题组先前分别使用杜仲提取物、葡萄籽提取物和茶多酚制备出纳米银粒子,三种纳米银粒子的SPR峰分别为422 nm(葡萄籽纳米银)[8]、430 nm(茶多酚纳米银)[9]和436 nm(杜仲纳米银)[10]。贵金属纳米粒子存在SPR峰,其形成归因于纳米颗粒表面导电电子与电磁波相互作用引起的共振振荡,通过检测紫外-可见区约410 nm处的SPR峰吸收带可证实AgNPs的形成[11]。实验所得槲皮素纳米银粒子SPR峰的数值与其相近,基本可以确定已成功制备出槲皮素纳米银粒子。
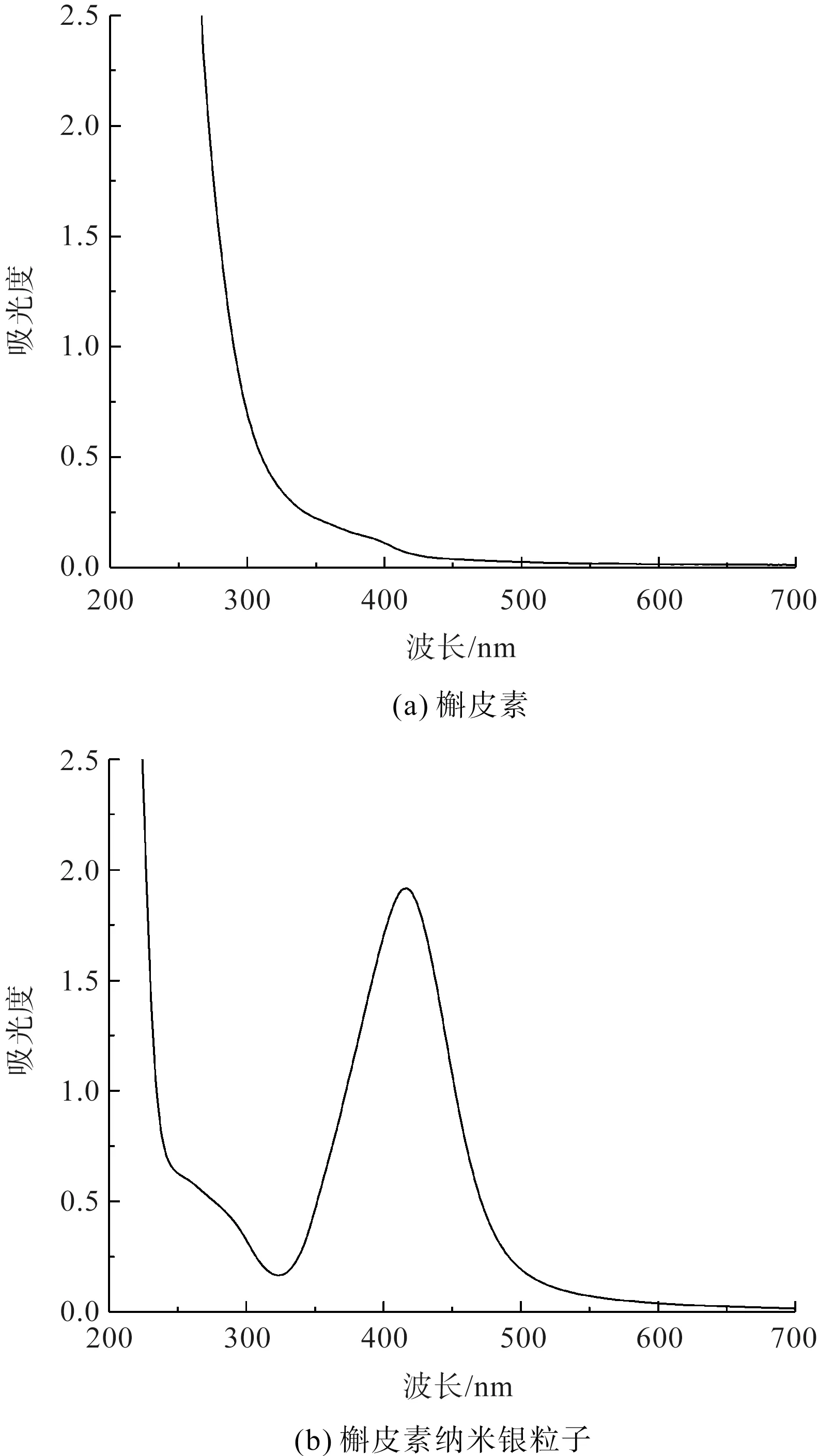
图2 槲皮素和槲皮素纳米银粒子溶液的紫外-可见吸收光谱曲线Fig.2 UV-Vis absorption spectrum curve of quercetin and quercetin AgNPs solution
实验还使用透射电子显微镜来观察槲皮素纳米银粒子的形貌特征,结果如图3所示。从图3可以清晰看到均匀分散的槲皮素纳米银粒子,并且槲皮素纳米银粒子的形貌近似为圆球状,这进一步证明成功制备了槲皮素纳米银粒子。实验测定了槲皮素纳米银粒子的粒径分布和平均粒径,结果表明所制槲皮素纳米银粒子的平均粒径为87.54 nm,而粒子直径基本分布在10~100 nm。
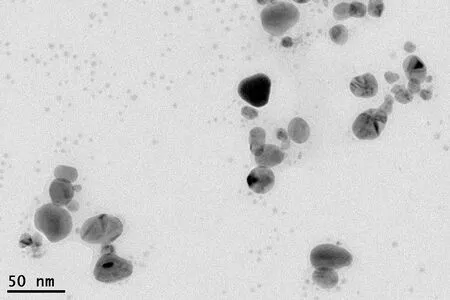
图3 槲皮素纳米银粒子的TEM图Fig.3 TEM image of quercetin AgNPs solution
2.2 溶液pH值对槲皮素纳米银粒子粒径及制备效率的影响
为了讨论溶液pH值对槲皮素纳米银粒子结构的影响,实验分别在pH值为6.085、6.503和7.012的条件下制备了三种槲皮素纳米银粒子,并测定了三种槲皮素纳米银粒子的紫外-可见吸收光谱曲线,结果如图4所示。从图4可以看出,三种槲皮素纳米银粒子的SPR峰基本都在400~420 nm,具体数值分别为416 nm(pH 6.085)、418 nm(pH 6.503)和405 nm(pH 7.012),同时,在SPR峰处三种槲皮素纳米银粒子的吸光度值分别为1.917(pH 6.085)、2.322(pH 6.503)和3.613(pH 7.012)。通过上述分析可知,在不同pH值条件下,均能成功制备出槲皮素纳米银粒子。从纳米银绿色制备的反应进程来看,酸性条件有可能使植物多酚发生质子化而导致其与银离子产生静电相斥;当溶液呈中性或碱性条件时,植物多酚发生电离从而可以更有效吸附银离子使其发生还原[12],因此在pH值为7.012时能够制备出更多的槲皮素纳米银粒子。
式(8)中:k为湍动能。由图11可知,整个工作段内轴向湍流强度≪1%,湍流强度沿水流方向逐渐减弱并趋于定值0.26%。
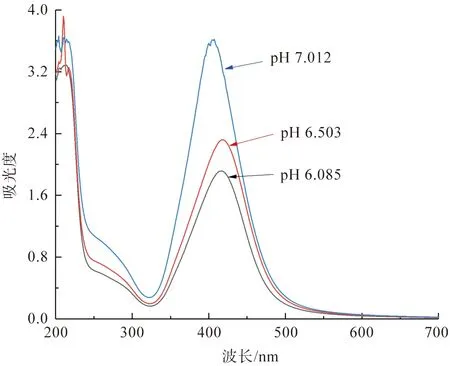
图4 不同pH值条件下制备的槲皮素纳米银粒子溶液的紫外-可见吸收光谱曲线Fig.4 UV-Vis absorption spectra of quercetin AgNPs solutionsbiosynthesized under different pH values
由于纳米银粒子的浓度、粒径分布和平均粒径等参数都会影响其催化性能,为了便于后续催化降解实验的分析讨论,本文采用激光粒度仪分别测定了三种槲皮素纳米银粒子溶液的粒径分布和平均粒径,结果如图5所示。从图5可知,三种槲皮素纳米银的粒径分布范围主要在10~100 nm,而三种槲皮素纳米银粒子的平均粒径分别为87.54 nm(QP1)、71.70 nm(QP2)和59.78 nm(QP3)。综合图4和图5可以初步判断,溶液pH值不仅影响纳米银粒子的制备效率,同样会影响所制备的纳米银粒子的粒径分布和平均粒径数值。随着溶液pH值得不断增加,槲皮素纳米银粒子的粒径分布范围在变大,最小粒径已下降至10 nm以下,平均粒径也呈下降趋势,因此在较高pH值条件下(pH 7.012)制备的槲皮素纳米银粒子具有更高的产率、更小的平均粒径及更广泛的粒径分布范围。
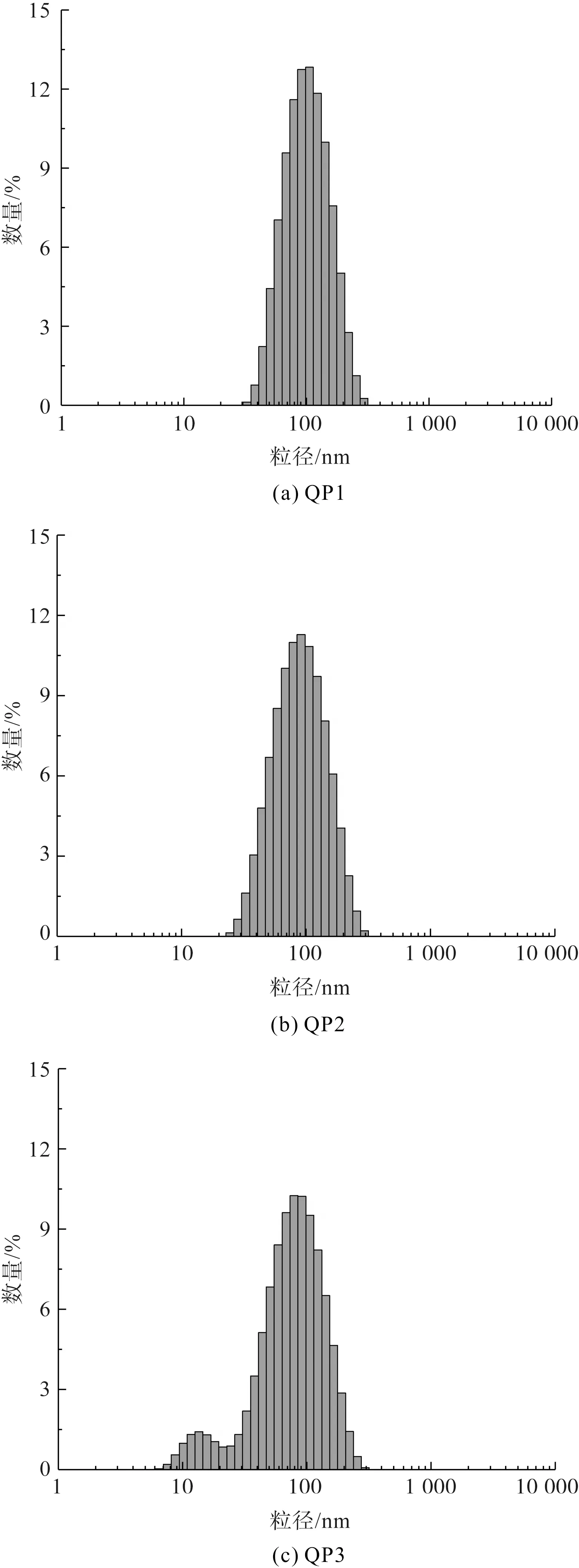
图5 不同槲皮素纳米银粒子的粒径分布Fig.5 Particle size distributions of different quercetin AgNPs
2.3 不同槲皮素纳米银粒子对直接橙26染料的催化还原降解
首先选定直接橙26染料为目标降解物进行催化降解实验,所用还原剂为硼氢化钠。在无纳米银催化剂和添加QP1、QP2及QP3三种槲皮素纳米银催化剂条件下,进行目标物的降解实验,结果如图6所示。从图6可以看到,直接橙26染料在200~800 nm波长存在三个明显的吸收峰,分别位于494、305 nm和240 nm,其中494 nm处的吸收峰为直接橙26染料的特征吸收峰[10]。因此,实验以直接橙26染料溶液在494 nm处吸光度的变化来表征直接橙26染料催化降解性能。本文采用下式计算染料的降解百分率R:
(1)
式中:At表示反应时间为tmin时染料在最大吸收波长处的吸光度,A0表示初始染液在最大吸收波长处的吸光度。
在不添加纳米银催化剂的条件下(图6(a)),经30 min反应后,直接橙26染料溶液在494 nm处的吸光度值从1.349下降到1.299,降解百分率仅为3.7%。这说明,在没有纳米银催化剂的条件下,硼氢化钠还原剂无法有效地降解直接橙26染料。在添加槲皮素纳米银粒子的条件下(图6(b)~(d)),直接橙26染料溶液在494 nm处的吸光度值发生了不同程度的下降,说明槲皮素纳米银粒子实现了对直接橙26染料的催化还原降解。另外,从图6(b)~(d)也可以看到,在QP1、QP2和QP3的催化作用下,三种直接橙26染料溶液在494 nm处吸光度值的下降速率和最终下降幅度存在明显的差异。在QP3催化条件下,直接橙26染料的在494 nm处吸光度值的下降速率最快,这表明QP1、QP2和QP3的催化性能存在明显的差异。
从图6(b)~(d)还可以清晰地看到,经过30 min的催化降解后,三种直接橙26染料溶液在400 nm左右产生了新的吸收峰,根据先前的研究结论可知,三种直接橙26染料溶液在400 nm处产生的新吸收峰可判定为发生偏移的槲皮素纳米银粒子SPR峰[10]。此外,随着反应溶液pH值的增加,纳米银催化染料后,产生的新吸收峰(400nm附近)所对应的吸光度值也逐渐增加,吸光度值分别为0.326(394 nm,QP1)、0.583(392 nm,QP2)和0.986(391 nm,QP3),这主要是由于纳米银粒子制备时最终的有效浓度QP3>QP2>QP1。
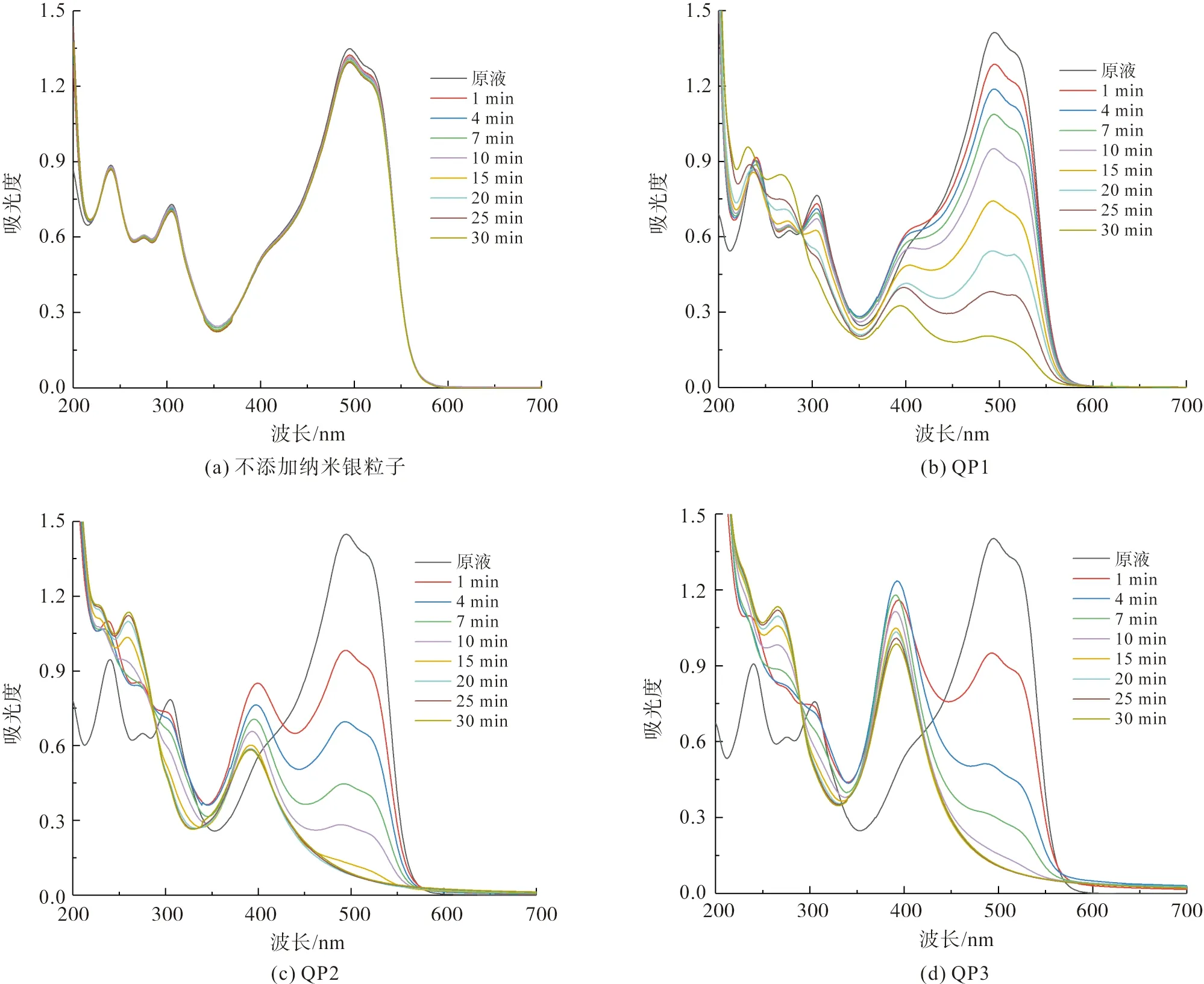
图6 不同pH值条件下制备的槲皮素纳米银粒子对直接橙26染料的催化还原降解性能Fig.6 Catalytic reductive degradation of Direct Orange 26 dye catalyzed by different quercetin AgNPs biosynthesized under different pH values of solutions
不同pH值条件下制备的槲皮素纳米银粒子对直接橙26染料的降解曲线如图7所示。图7中At/A0可以间接表示直接橙26染料溶液的降解情况,其中A0表示直接橙26染料溶液在494 nm处的初始吸光度值,At表示反应时间为tmin时,直接橙26染料溶液在494 nm处的初始吸光度值。从图7可以看出,经过30 min的反应后,槲皮素纳米银粒子对直接橙26染料溶液的降解百分率分别为85.6%(QP1)、93.2%(QP2)和91.3%(QP3),即QP2和QP3催化作用下,槲皮素纳米银粒子对直接橙26染料的降解百分率要高于QP1。
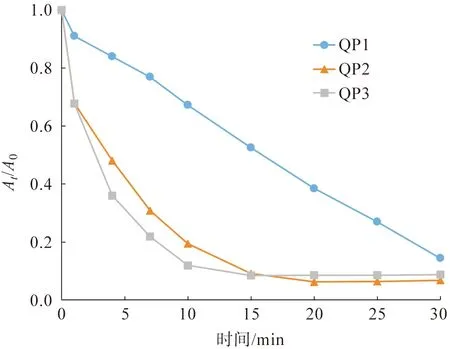
图7 不同pH值条件下制备的槲皮素纳米银粒子对直接橙26染料的催化降解曲线Fig.7 Catalytic degradation curves of Direct Orange 26 dye catalyzed by different quercetin AgNPs biosynthesized under different pH values of solutions
为了进一步量化直接橙26染料的催化降解情况,实验使用假一级动力学方程进行模拟。
-ln(At/A0)=kt
(2)
根据实验数据作图,槲皮素纳米银粒子的-ln(At/A0)与时间的关系如图8(a)所示。而从图8(b)可知,槲皮素纳米银粒子的动力学常数分别为0.054 5 min-1(QP1,R2=0.974 2)、0.151 0 min-1(QP2,R2=0.990 2)和0.187 8 min-1(QP3,R2=0.976 3),其中,随着反应溶液pH值的增加,假一级动力学常数逐渐增加,QP3时达到最高,并表现出优异的催化效率。
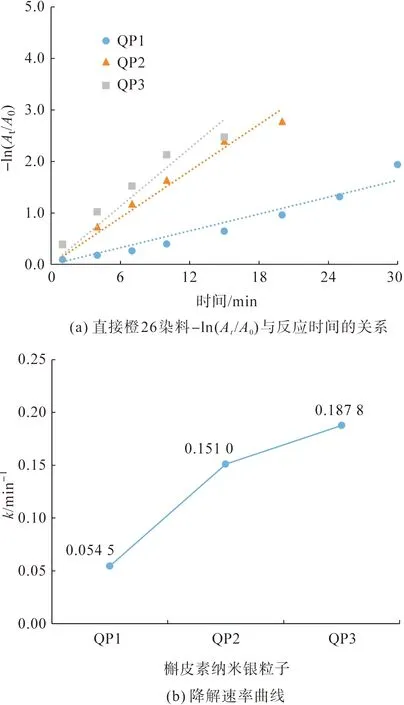
图8 不同pH值条件下制备的槲皮素纳米银粒子对直接橙26染料的催化降解速率Fig.8 Catalytic degradation rates of Direct Orange 26 dye catalyzed by different quercetin AgNPs biosynthesized under different pH values of solutions
结合图4和图5可知,这主要是因为随着溶液pH值的不断增大,参与催化降解反应的槲皮素纳米银粒子不断增加,粒径不断减小。
2.4 不同槲皮素纳米银粒子对直接红23染料的催化还原降解
根据前期研究结果可知[9],在纳米银粒子的催化作用下,硼氢化钠主要针对直接橙26染料中的偶氮基(或亚氨基)进行还原加氢而使其断裂,进而破坏了直接橙26染料大分子结构,因此染料结构中偶氮基(或亚氨基)的数量多少也会影响该染料催化降解的速度。在直接橙26染料催化降解实验的基础上,本文选择直接红23染料为目标降解物进行相关实验。从表1可知,直接红23染料和直接橙26染料的结构基本相同,而直接红23染料比直接橙26染料多一个乙酰氨基,因此两个染料发生的催化还原降解反应会存在一定的差异。
实验采用不同槲皮素纳米银粒子对直接红23染料进行催还还原降解研究,结果如图9所示。图9(a)为不添加纳米银催化剂的染料催化还原降解结果,其中直接红23染料存在三个吸收峰,分别位于506、305 nm和244 nm处,而可见光范围的506 nm处吸收峰为直接红23染料的特征吸收峰。因此,实验以直接红23染料溶液在506 nm处吸光度的变化来表征直接红23染料发生降解的程度。在不添加纳米银催化剂的条件下(图9(a)),经过60 min的反应后,直接红23染料溶液在506 nm处的吸光度值从2.152下降至2.057,降解百分率仅为4.4%。这说明,在不存在纳米银催化剂的条件下,硼氢化钠也无法有效对直接红23染料进行还原降解[7]。
在添加槲皮素纳米银的条件下(图9(b)~(d)),直接红23染料溶液在506 nm处的吸光度值发生持续的下降,说明槲皮素纳米银粒子实现了对直接红23染料的催化还原降解。同时,从不同槲皮素纳米银催化降解直接红23染料的紫外-可见吸收光谱曲线可以看出,特征吸收峰的下降速度和幅度存在较大的差异,这说明不同pH值条件下制备的槲皮素纳米银粒子在催化性能上存在一定的差异。
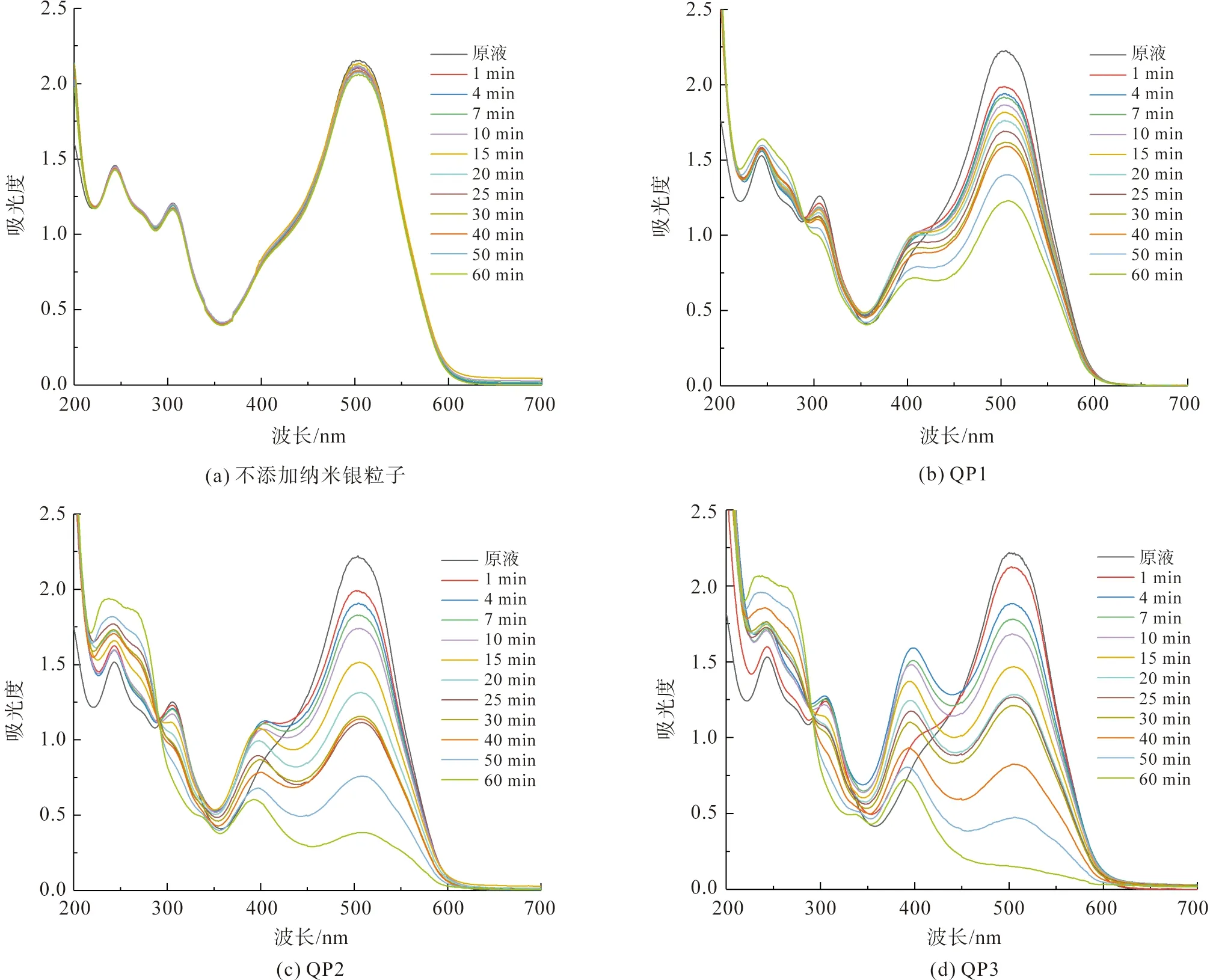
图9 不同pH值条件下制备的槲皮素纳米银粒子对直接红23染料的催化还原降解性能Fig.9 Catalytic reductive degradation of Direct Red 23 catalyzed by different quercetin AgNPs biosynthesized under different pH values of solutions
直接红23染料在QP1、QP2和QP3催化下的降解曲线如图10所示。从图10可知,经过60 min的反应后,直接红23染料的降解百分率分别为45.0%(QP1)、82.6%(QP2)和93.2%(QP3),三者之间的差异要明显高于催化降解直接橙26染料时的结果(反应时间30 min),其中QP3仍然具有较好的催化效果。
使用假一级动力学方程来模拟直接红23染料的催化降解过程,所得结果如图11所示。从图11可得,三种槲皮素纳米银粒子的反应速率常数分别为0.010 0 min-1(QP1,R2=0.957 8)、0.024 1 min-1(QP2,R2=0.963 4)和0.033 1 min-1(QP3,R2=0.927 1),QP3的催化效率最高。
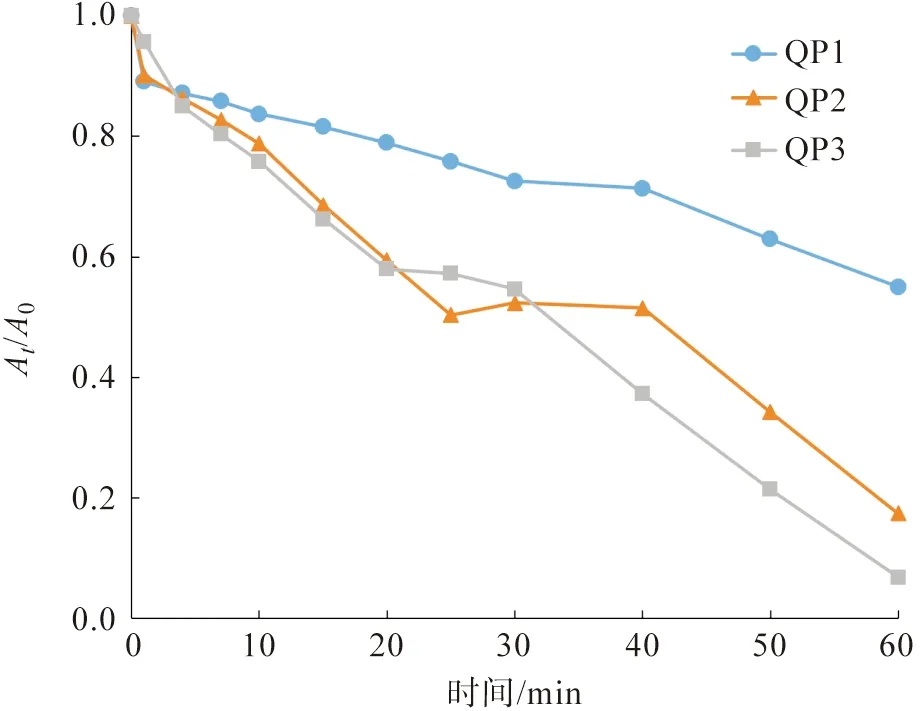
图10 不同pH值条件下制备的槲皮素纳米银粒子对直接红23染料的催化降解曲线Fig.10 Catalytic degradation curves of Direct Red 23 dye catalyzed by different quercetin AgNPs biosynthesized under different pH values of solutions
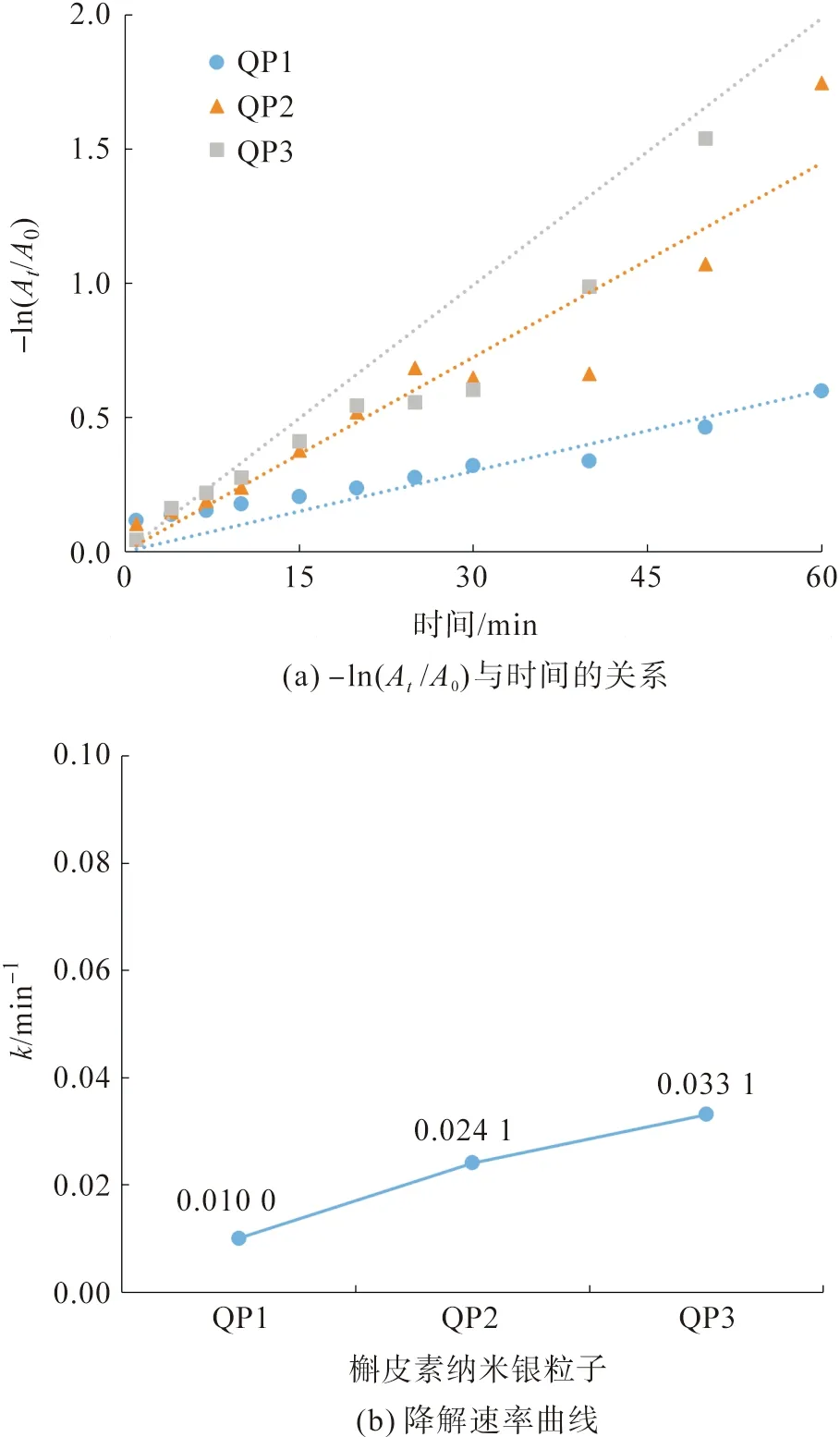
图11 不同pH值条件下制备的槲皮素纳米银粒子对直接红23染料的催化降解速率Fig.11 Catalytic degradation rate of Direct Red 23 dye catalyzed by different quercetin AgNPs biosynthesized under different pH values of solutions
以QP3为例,对比槲皮素纳米银粒子对直接橙26染料和直接红23染料的催化降解情况可知:在相同的反应条件下,当染料结构中存在更多可以发生催化降解的基团时,染料的降解速率会发生明显的下降,直接红23染料的反应速率常数只有直接26染料的17.6%,为后续降解实验提供一定的理论基础和实践经验。
3 结 论
本文进一步拓展了槲皮素的用途,经过对实验结果的相关分析,可以得到以下结论:
1) 以槲皮素为生物还原剂成功制备了槲皮素纳米银粒子,其SPR峰在416 nm附近,通过TEM图可知槲皮素纳米银粒子的形貌特征近似为圆形,而槲皮素纳米银的粒径基本分布在10~100 nm。
2) 硼氢化钠无法有效催化降解直接橙26染料和直接红23染料,经过30 min和60 min反应后,直接橙26染料和直接红23染料的降解百分率仅有3.7%和4.4%。
3) 在一定的反应时间下,槲皮素纳米银粒子对直接橙26染料和直接红23染料的降解百分率最高,均可达到93.2%。在不同pH值条件下制备的槲皮素纳米银粒子对直接橙26染料和直接红23染料的催化降解性能存在一定的差异,其中在pH 7.012的环境下制备的槲皮素纳米银粒子对两种染料的催化降解效率和反应速率更好。

《丝绸》官网下载

中国知网下载
