γ-干扰素释放试验联合FadD9重组蛋白对重症肺结核患者的诊断及死亡预后的预测价值
2022-08-22刘静李龙马喜迎
刘静 李龙 马喜迎
重症肺结核是呼吸内科常见疾病之一,其发病率和死亡率均较高[1]。普通肺结核防治不当极易进展为重症肺结核,患者常会由于多器官衰竭而死亡,因此,对重症肺结核患者进行早期诊断和防治,能有效改善患者预后,减轻患者和社会负担。目前,临床诊断中,结核分枝杆菌(mycobacterium tuberculosis,MTB)培养通常被认为是诊断结核病的金标准,且是检验MTB耐药性的关键步骤[2]。然而,MTB培养是一个相对缓慢的过程。目前用于诊断MTB感染的方法有酶联免疫斑点试验(ELISPOT)、酶联免疫吸附实验(ELISA)和γ-干扰素释放试验(interferon-gamma release assay,IGRA)等,这些方法的敏感性和特异性无法兼顾,均存在一些检测缺陷[3]。研究者需要面对的首要难点是筛选和优化可用于MTB感染诊断的抗原[4]。目前,培养滤液蛋白10 (culture filtrate protein-10,CFP-10)和早期分泌靶抗原6(early secretory antigenic target-6,ESAT-6)是常用的诊断方法的核心抗原,但不同人群的检测结果有时不一致[5]。因此,筛选更多可用于临床鉴别的MTB候选抗原是提高MTB诊断精确度的关键。fadD9是一种MTB脂质代谢相关基因,具体功能尚需确认[6]。已有研究报道[7],FadD9蛋白在活动性结核病诊断中具有一定潜力。然而,未有研究探讨FadD9蛋白在重症肺结核诊断中的诊断价值以及对预后的预测价值。因此,本研究通过基因表达和蛋白纯化获得FadD9重组蛋白,并分析其在诊断重症肺结核患者MTB感染中的潜在价值,以期为临床研究提供理论依据。
资料与方法
1 临床资料 选取2018年1月~2021年2月我院收治的127例重症肺结核患者(重症肺结核组),74例非重症肺结核患者(非重症肺结核组),选取同期与结核病患者有1年以上密切接触史患者36例(密接组)及我院体检健康者92例(对照组),对照组不曾与结核病患者密切接触过,且无结核病史及临床结核症状。
重症肺结核组纳入标准:(1)年龄≥18周岁;(2) 符合《肺结核基层诊疗指南(2018年)》[8]中重症肺结核患者诊断标准。重症肺结核组排除标准:(1) 临床资料不全;(2)自行出院或中途转院者;(3)合并癌症、病毒性肝炎等可引起肝肾损害的疾病;(4)入院24 h内死亡。本研究已经我院伦理委员会批准(伦理证书编号:[2019]-088),受试者签署知情同意书。
2 FadD9重组蛋白制备、鉴定及评估
2.1 FadD9重组蛋白的制备和鉴定:fadD9基因序列(基因ID:888574)从美国国立生物技术信息中心网站上获取。以MTB H37 Rv基因组为模板,用fadD9基因的上下游引物(上游引物:5'-CACCCTAGGTACA GCTAGTTGCTAGTCGCTGACTG-3',下游引物:5'-ATATTCGAAAGTGTCGTCGGGCTCGTCAGCGTC-3')进行聚合酶链式反应(polymerase chain reaction,PCR)。PCR产物连接到pET28a载体中,对重组表达质粒进行测序,并转入大肠埃希菌(DE3)中,涂在LB培养基上(含50 μg/mL卡那霉素),37 ℃过夜,随机挑选单个菌落,进行扩大培养。待菌液浊度达到0.6(600 nm处吸光度)时继续进行诱导培养3 h,12000×g离心1 min,收集菌体并见超声裂解,4 ℃ 12000×g离心10 min,收集上清液,纯化,获得FadD9重组蛋白,再使用10%十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)鉴定纯度。
2.2 FadD9抗原免疫原性评估:选取C57BL/6小鼠8只,每组4只。FadD9免疫组注射弗氏佐剂50 μL和FadD9蛋白50 μL(美国Sigma公司)的混合物,阳性对照组注射Ag85a蛋白50 μL和50 μL弗氏佐剂的混合物,阴性对照组注射等体积的磷酸盐缓冲液(PBS)。分别于第1、3、5周对2组小鼠进行免疫注射,第1次免疫注射弗氏完全佐剂,第2、3次使用弗氏不完全佐剂。首次免疫8周后提取小鼠血清和脾脏淋巴细胞,并使用ELISA检测脾细胞FadD9重组蛋白的特异性IgG抗体水平及脾细胞的肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、白细胞介素-2(interleukin 2,IL-2)、γ-干扰素(interferongamma,IFN-γ)。
2.3 血清中FadD9重组蛋白与特异性抗体的反应水平:以FadD9重组蛋白和Ag85A蛋白为抗原,以重症肺结核组、密接组和对照组的血清样本分别按1∶100进行稀释,作为一抗。以过氧化物酶标记的山羊抗人IgG(美国CMCTAG公司)作为二抗,按1∶3000稀释。检测3组抗原抗体特异性反应水平。
2.4 FadD9重组蛋白联合IGRA检测细胞免疫水平:将FadD9重组蛋白作为抗原与重症肺结核组和非重症肺结核患者的血样本37℃共孵育24 h后,进行IGRA,试剂盒(ELISA)购自北京万泰生物药业股份有限公司,检测FadD9重组蛋白的细胞免疫水平。
3 观察指标 记录阴性对照组、阳性对照组和抗原FadD9重组蛋白免疫后小鼠血清中的IgG(H+L)效价来评估C57BL/6小鼠经FadD9免疫后的血清抗体水平;记录FadD9免疫组和阳性对照组小鼠脾细胞的IL-2、IFN-γ和TNF-α水平及FadD9重组蛋白免疫后小鼠血清中的IgG抗体水平来评估FadD9抗原免疫原性;记录重症肺结核组、密接组和对照组的FadD9重组蛋白和Ag85A蛋白特异性抗体水平;记录并统计重症肺结核患者预后,并依据预后死亡情况分为:存活组和死亡组;记录存活组和死亡组患者的性别、年龄、BMI、病变范围、APACHE Ⅱ评分、初始治疗规律性、居住地区、COPD、肺部感染、基础疾病、窒息、呼吸衰竭、肺性脑病、器官损害数目、肺心病、血清白蛋白浓度、耐多药结核菌、血红蛋白浓度、IGRAs、FadD9重组蛋白的血清抗体水平。
4 统计学方法 采用SPSS软件(Version 21.0)进行统计学分析。画图采用R软件(Version 3.6.2)。计量资料使用(±s)表示,首先采用单因素方差进行多组间分析,若差异有统计学意义,则采用事后LSD-t检验进行两组间比较;计数资料采用频数(百分比)表示,采用χ2检验进行分析。统计重症肺结核患者的存活率,据此分为存活组和死亡组,比较2组患者的一般临床资料,并采用Cox比例风险回归筛选出影响重症肺结核患者死亡的危险因素,纳入并建立Nomogram预测模型,计算一致性指数(C-index)。分别使用受试者工作特征曲线(receiver operating characteristic curve,ROC)、校准曲线、临床决策曲线对Nomogram预测模型的区分度、校准度和临床有效性进行评价。P<0.05表示差异具有统计学意义。
结果
1 FadD9重组蛋白的制备、鉴定及免疫原性评估 将FadD9重组蛋白进行纯化后,经10% SDS-PAGE鉴定,蛋白纯度大于95%。抗原激起的体液免疫水平通过抗原免疫后小鼠血清中的IgG(H+L)效价进行评估。与阳性参照抗原Ag85A蛋白相比,FadD9重组蛋白的A值变化与其基本一致,且均高于阴性对照组。FadD9重组蛋白的血清抗体滴度达1∶12800,与参照抗原Ag85A蛋白接近。见图1。
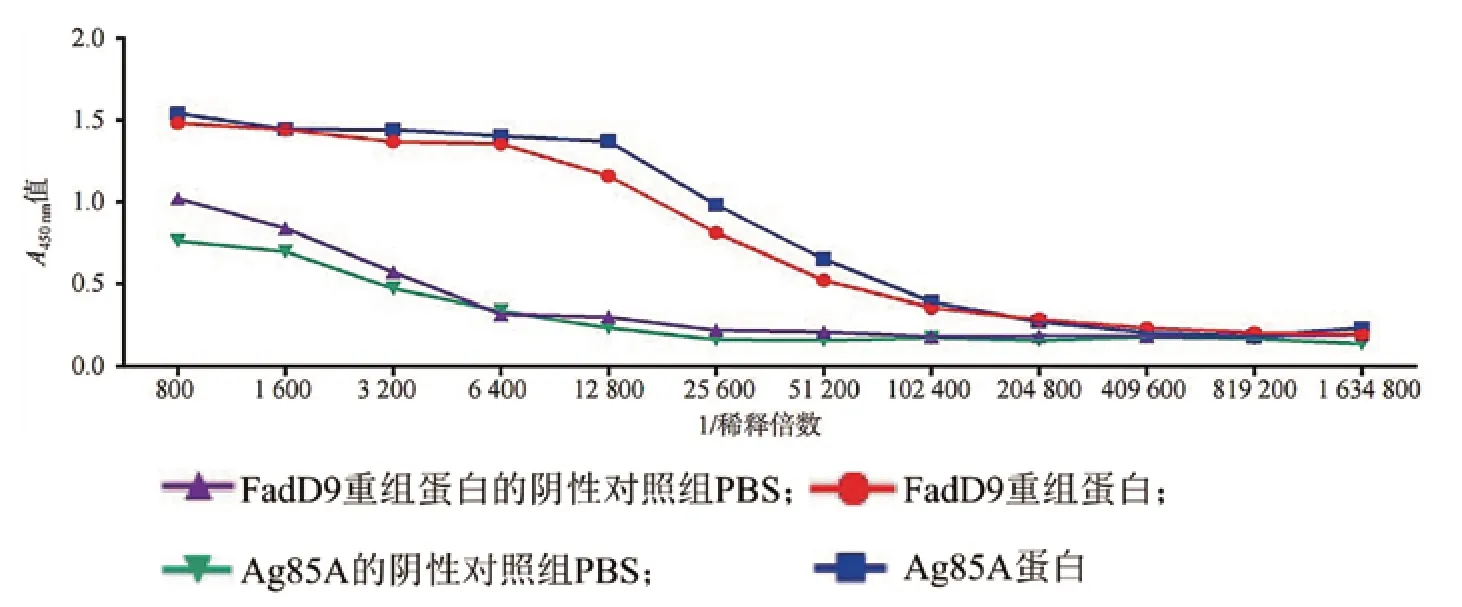
图1 C57BL/6小鼠经FadD9免疫后的血清抗体水平
比较FadD9免疫组和阳性对照组小鼠脾细胞的IL-2、IFN-γ和TNF-α水平,结果发现,FadD9免疫组IL-2、TNF-α和IFN-γ水平分别为126.95、225.87、395.92 pg/mL,三者比例为1.00∶1.78∶3.12。阳性对照组分别为163.30、188.67、329.86 pg/mL,三者比例为1.00∶1.16∶2.02。
2 FadD9重组蛋白的特异性抗体水平评估 比较重症肺结核组、密接组和对照组的FadD9重组蛋白和Ag85A蛋白特异性抗体水平,结果发现,重症肺结核组抗FadD9抗体水平明显高于密接组和对照组,差异有统计学意义(F=12.306,P<0.001),密接组和对照组间差异无统计学意义(t=1.208,P>0.05)。3组间的抗Ag85A抗体水平差异均无统计学意义(F=2.467,P>0.05)。见图2。
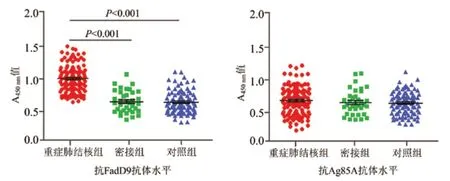
图2 FadD9重组蛋白的特异性抗体水平评估
3 重症肺结核患者中存活组和死亡组一般临床资料比较 127例重症肺结核患者经治疗最终存活93例(存活组),死亡34例(死亡组),死亡率36.56%(34/127)。比较2组患者的一般临床资料,结果发现,2组患者的性别、饮酒、年龄、吸烟、病变范围差异均无统计学意义(P>0.05);2组的BMI、APACHE Ⅱ评分、初始治疗规律性、COPD、肺部感染、呼吸衰竭、窒息、肺心病、器官损害数目、多重耐药结核菌、血清白蛋白浓度、IGRA、FadD9重组蛋白的血清抗体水平差异均有统计学意义(P<0.05)。见表1。
表1 重症肺结核患者中存活组和死亡组一般临床资料比较[±s,n (%)]

表1 重症肺结核患者中存活组和死亡组一般临床资料比较[±s,n (%)]
项目 存活组(n=93) 死亡组(n=34) t/χ2 P男/女 63/3025/90.3920.531 年龄(岁) 61.42±10.6762.75±11.090.6150.539 BMI(kg/m2) 21.73±3.2617.28±2.717.107 <0.001 饮酒 – – 0.0370.848 是2910––否6424––吸烟 – – 1.3900.238 是4119––否5215––病变范围(肺野, 个) 4.16±0.594.22±0.630.4980.619 APACHE Ⅱ评分(分) 15.10±2.4521.37±3.1811.752 <0.001 初始治疗规律性 – – 4.8430.028 否1411––是8023––居住地区 – – 0.1520.696 农村 3414 – –城市 5720 – –COPD – –9.7740.002 有1612––无7722––基础疾病 – – 2.9930.084 有2214––无7122––肺部感染 – – 14.370 <0.001 有5131––
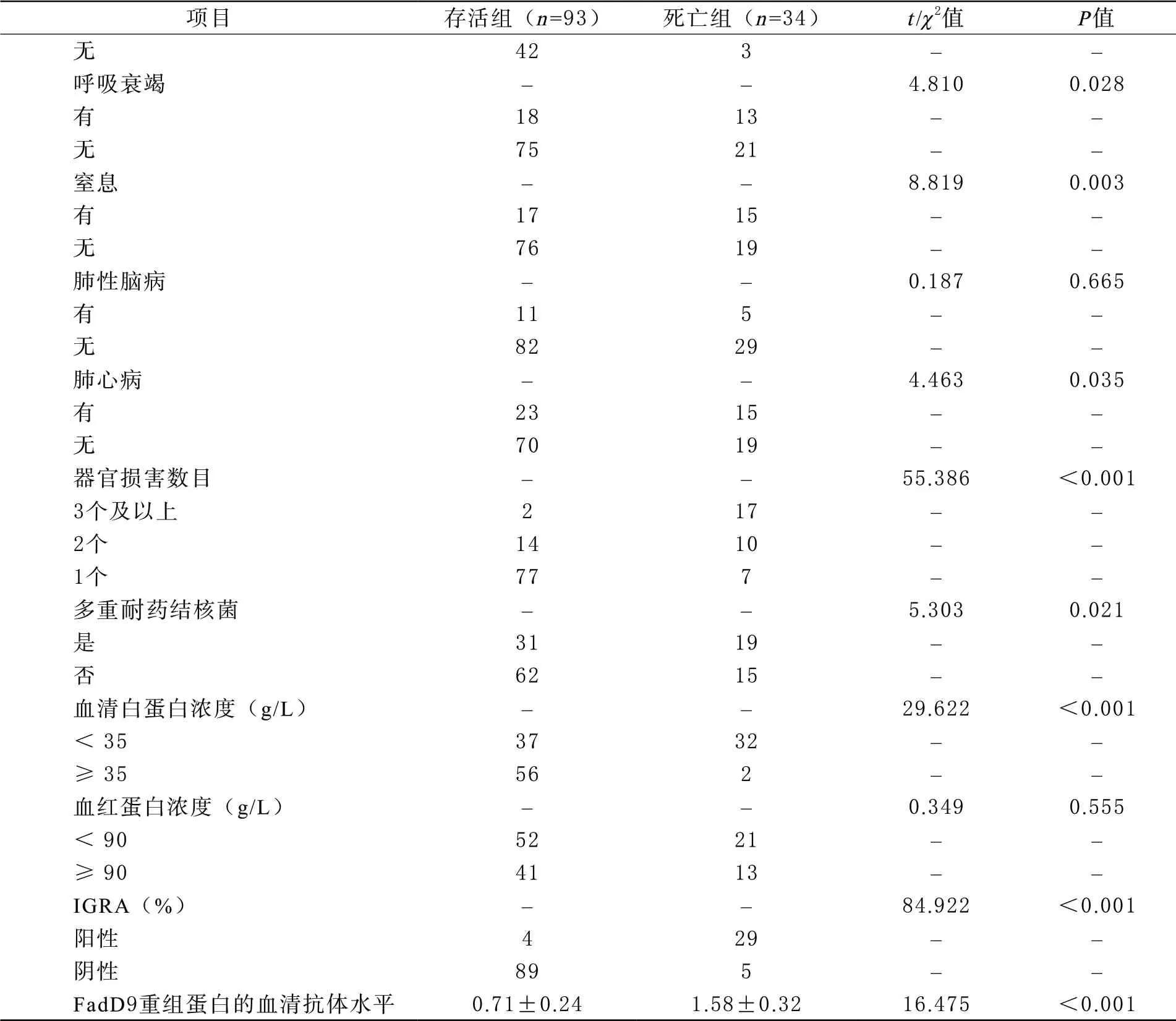
续表1
4 重症肺结核患者死亡危险因素的Cox比例风险回归分析 以重症肺结核患者的生存状态(1=死亡,0=截尾)为因变量,将以上差异有统计学意义的变量作为自变量纳入Cox比例风险回归分析,采用逐步回归法,结果显示,BMI、APACHE Ⅱ、COPD、肺部感染、呼吸衰竭、肺心病、器官损害、多重耐药结核菌、低血清白蛋白浓度、IGRA、FadD9重组蛋白抗体水平均是重症肺结核患者死亡的危险因素(P<0.05),见表2。
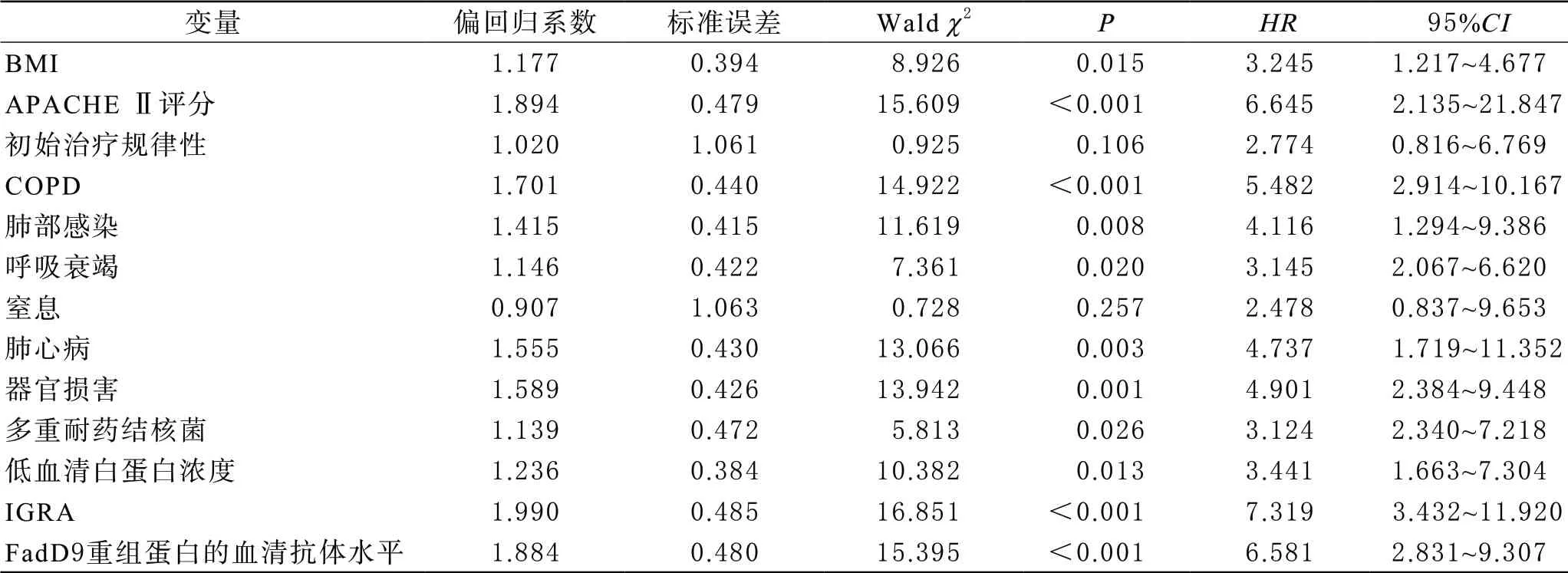
表2 重症肺结核患者死亡危险因素的Cox比例风险回归分析
5 Nomogram模型建立 将危险因素作为预测因子构建Nomogram模型,并进行内部数据验证。结果显示,内部数据验证结果显示,C-index为0.742(95%CI:0.684~0.845)。见图3。
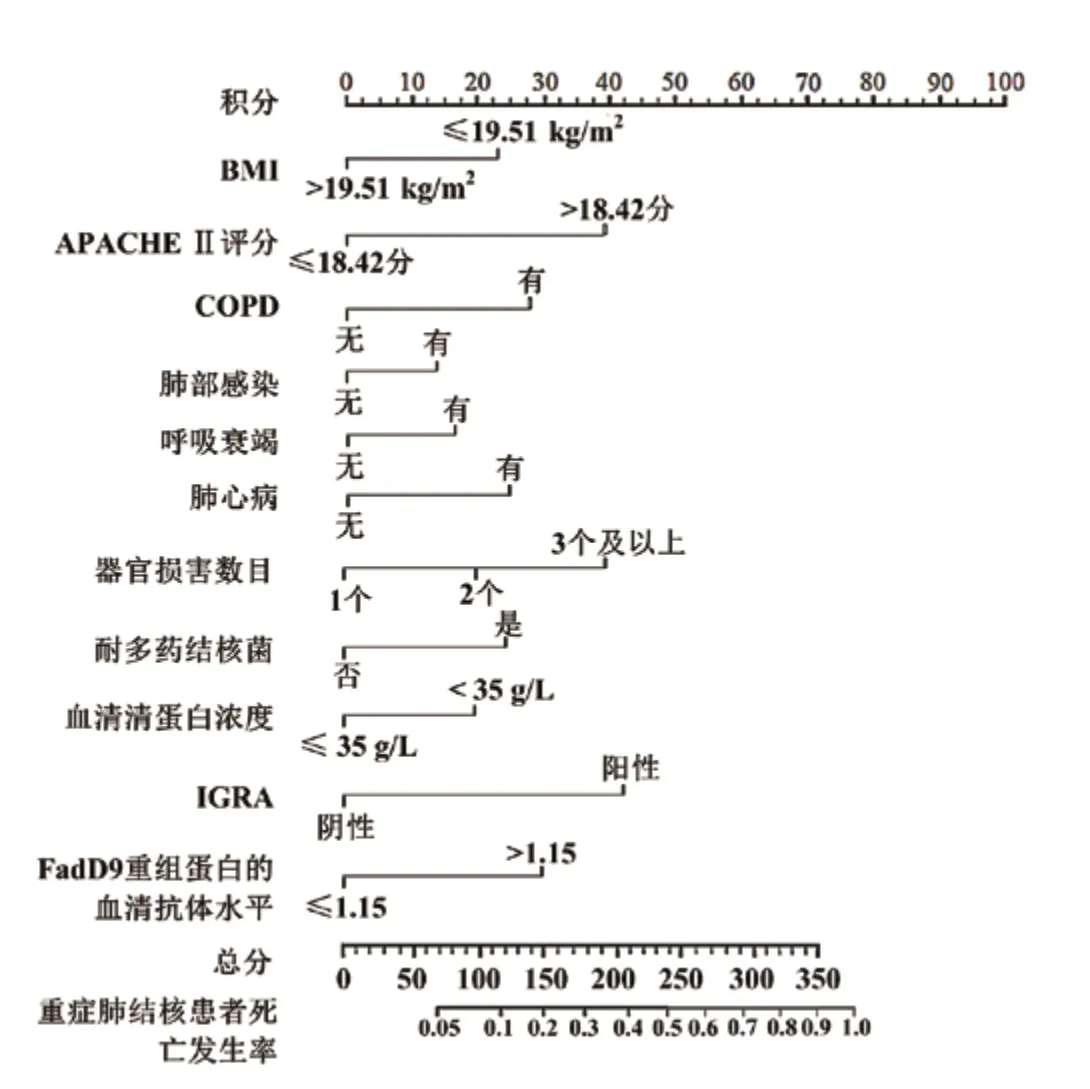
图3 预测重症肺结核患者死亡的Nomogram模型
6 ROC曲线评价Nomogram模型的预测效能 采用ROC曲线评价Nomogram模型预测重症肺结核患者死亡的Nomogram模型的效能,结果如表3和图4所示,Nomogram模型的曲线下面积为0.802(95%CI:0.764~0.840,P<0.001),灵敏度、特异度及约登指数分别为85.42%、74.05%和0.595,具有较高的预测效能。

表3 ROC曲线评价模型的预测效能
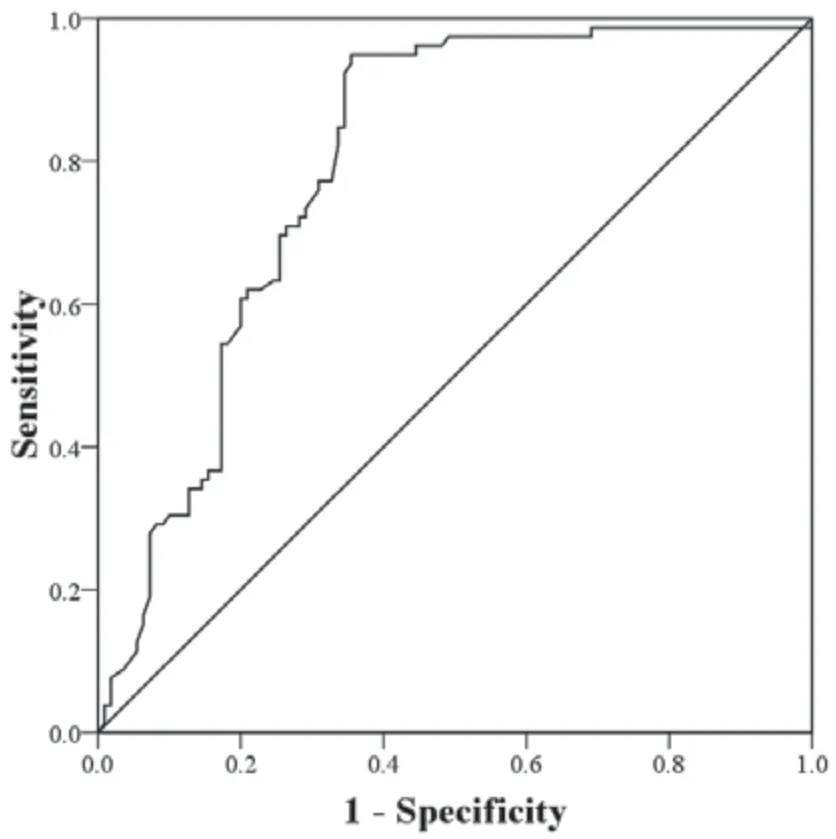
图4 ROC曲线分析Nomogram模型的预测效能
7 Nomogram模型的准确度及有效性评价 Nomogram模型的校准度和有效性分别采用校准曲线和临床决策曲线进行评价,结果如图5所示,当事件发生率为36%和84%时,模型预测和观察值完全一致,当事件发生率<37%时,预测高估风险;当事件发生率在37%~83%时,预测低估风险;当事件发生率在78%~100%时,预测高估风险。整体上看Nomogram模型预测重症肺结核患者死亡的准确度较好。临床决策曲线可以看出,Nomogram模型的净获益值较高,有效性较好。
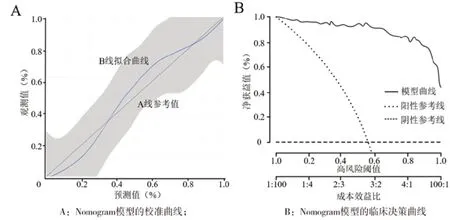
图5 Nomogram模型的准确度和有效性评价
8 IGRAs和FadD9重组蛋白诊断重症肺结核的效能 将FadD9重组蛋白作为抗原与重症肺结核组和非重症肺结核组的全血样本37 ℃孵育24 h左右,进行IGRA。ROC曲线分析显示,FadD9重组蛋白诊断重症肺结核的曲线下面积为0.748,最佳临界值为0.352,敏感性为97.33%,特异性为72.51%。见表4、图6。

表4 IGRAs和FadD9重组蛋白诊断重症肺结核的效能
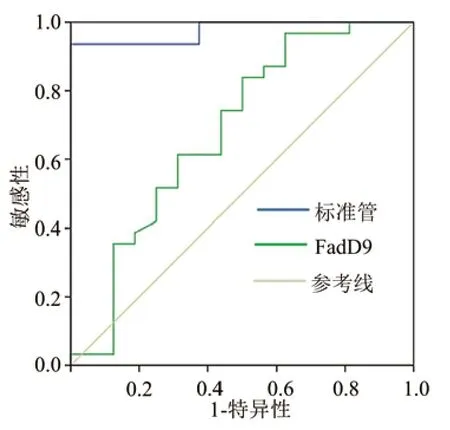
图6 IGRAs标准管和FadD9重组蛋白诊断重症肺结核的ROC曲线
讨论
病原学检查是目前结核病的诊断金标准,但由于潜伏感染、痰培养阴性结核病及重症肺结核患者逐渐增多,且MTB生长缓慢等,限制了病原学检查的即时性和准确性[9]。相比较而言,免疫学检查更加快速,且特异性和灵敏性更高,已被广泛应用于临床实践中[10]。目前,临床上诊断MTB感染的主要免疫学方法有ELISPOT、ELISA和IGRA等。其中IGRA已被广泛应用于临床应用中,既往不同研究显示[11],IGRA对结核病的敏感性为83%~100%,本研究IGRA单独诊断重症肺结核患者的敏感性为94.51%,与既往研究基本一致。IGRA基于MTB感染后体内记忆T细胞增多,在特定抗原刺激下,记忆T细胞增殖,IGRA针对细胞免疫,检测IFN-γ的分泌量。IGRA使用的核心抗原为CFP-10和ESAT-6,对活动性肺结核诊断有效性较高[12]。但无法较好地区分潜伏性肺结核和活动性肺结核,只适用于MTB感染的辅助诊断,因此,临床迫切需要运用新型抗原检测来预警肺结核病变阶段和预后结局等。
FadD9可能与脂质降解相关。在小鼠模型中研究发现,FadD9抗原可诱导Th1型细胞分泌IFN-γ、TNF-α和IL-2[13]。IFN-γ作为控制MTB感染的重要细胞因子,也是IGRA的效应因子,IFN-γ的分泌量是IGRA诊断成功的基础[14]。TNF-α可在MTB感染部位招募到更多免疫细胞,从而抑制MTB在机体内的传播。IL-2可促进细胞毒性T淋巴细胞增殖。这些细胞因子均可提示FadD9重组蛋白在宿主-病原体作用过程中发挥关键细胞免疫作用。本研究制备的FadD9重组蛋白激发的小鼠特异性抗体水平与阳性参照接近,提示在MTB感染者体内,FadD9重组蛋白可同时促发较高水平的细胞和体液免疫反应。此外,重症肺结核组FadD9抗体水平高于密接组和对照组,而密接组和对照组受试者间差异无统计学意义,提示FadD9重组蛋白可用于重症肺结核患者的血清学诊断试验。本研究进一步通过ROC曲线分析发现,FadD9重组蛋白诊断重症肺结核的AUC为0.748,提示FadD9重组蛋白具有用于IGRA的潜力。
以往有研究发现[15],重症肺结核病死率为19.1%。也有研究报道[16],重症肺结核病死率高达30.4%,高于相关研究。本研究以我院呼吸科重症肺结核患者统计发现,重症肺结核病死率为26.77%(34/127),与以往研究结果接近。本研究进一步通过构建Cox比例风险回归模型分析预测重症肺结核死亡风险的影响因素,结果发现,APACHE Ⅱ、COPD、肺心病、呼吸衰竭、肺部感染、BMI低、低血清白蛋白浓度、器官损害、多重耐药结核菌、IGRA、FadD9重组蛋白均是预测重症肺结核患者死亡的可能危险因素。本研究127例重症肺结核患者存活组中,4例IGRA结果阳性,89例结果阴性;死亡组中,29例IGRA结果阳性,5例结果阴性。此外,2组的FadD9重组蛋白的血清抗体水平差异有统计学意义。提示IGRA和FadD9重组蛋白的血清抗体水平可以很好区分重症肺结核患者预后。临床常采用APACHE Ⅱ评分评估重症肺结核患者预后[17]。本研究也发现,死亡组患者的APACHE Ⅱ分值明显高于存活组,APACHE Ⅱ分值较高可能预示着病死率较高。这与国内研究报告相符[18]。重症肺结核伴COPD、肺心病并发症,易引起严重的呼吸功能障碍,发生呼吸衰竭,机体缺氧和二氧化碳潴留,导致机体生理功能及代谢紊乱,病死风险增加。也有研究报道重症肺结核伴气胸、COPD、肺心病等并发症或合并症患者的致死率增加[19],与本研究结果一致。肺结核为慢性消耗性疾病,患者免疫功能低下,易并发肺部感染等疾病,引起组织水肿,导致呼吸功能无力等症状,死亡风险增加[20]。器官损害数目多的重症肺结核患者更易发生多器官功能衰竭,预后不良,与以往研究结果一致[21]。多重耐药结核菌感染患者致病菌毒性较强,且对两种以上一线抗结核药物耐药,高耐药性导致难以控制MTB繁殖,病情极易加重,最终导致患者病死率增加[22]。
列线图作为一种图表工具,可直观展示统计模型,并得到目标事件的数值概率,量化风险更加精确。已有研究报道,列线图可以预测肝细胞癌患者腹腔镜肝切除术后复发风险[23]、老年早期胃癌患者内镜黏膜下剥离术后复发风险[24]、宫颈上皮内瘤变患者宫颈环形电切术后复发风险[25]等。本次研究将列线图模型应用于预测临床重症肺结核患者死亡预后发生风险,结果发现,Nomogram模型C-index值为0.742(95%CI:0.684~0.845),表明其区分度高,具有较好的预测价值,在一定程度上可作为临床重症肺结核患者死亡预后辅助预测工具,但由于本研究样本量容量有限,Nomogram模型的临床实践价值还需要更多的临床数据进行验证。
综上所述,IGRA可有效诊断重症肺结核,FadD9重组蛋白可作为IGRA新型抗原组合的候选成分,用于诊断重症肺结核的敏感性较高。本研究构建的Nomogram模型在一定程度上可作为临床重症肺结核患者死亡辅助预测工具。本研究不足:纳入病例数较少,且未对FadD9重组蛋白与CFP-10和ESAT-6进行对比分析,因此后续会增加样本量,进一步探讨相比于CFP-10和ESAT-6,FadD9重组蛋白作为IGRA核心抗原的优势。
利益冲突所有作者均声明不存在利益冲突
