A20在调节性T细胞IL-2信号通路中的作用研究*
2022-08-22陈富强曲莉莉
陈富强 曲莉莉
调节性T细胞(regulatory T cell,Treg)是免疫抑制性CD4+T细胞的一个特殊亚群,调节免疫系统保持对自身抗原的耐受性,并通过抑制对宿主有害的过度和异常免疫反应来预防自身免疫性疾病[1],抑制Th1和Th2细胞的分化和增殖,并在感染、代谢性疾病、组织修复和癌症中充当炎症的负调节因素[2],分子标记包括CD4、CD25、CTLA-4、GITR、LAG-3、CD127和Foxp3等。新的功能学研究发现CD4+Treg在一些疾病中并不能起到抑制免疫反应的作用,反而能够促进炎症损伤或抑制组织重塑,表明其存在功能异质性[3]。泛素与其他蛋白质共价结合,涉及泛素活化酶、E2-共轭酶和E3泛素配体的活性。A20(TNFAIP3,Tumor necrosis factor α-l induced protein 3)作为一种泛素编辑酶,通过Toll样受体(Toll-like receptor,TLR)途径调节细胞因子(如TNF-α和IL-1)或病原体诱导的炎症信号通路,能将K63连接的泛素链从NF-κB信号通路中的特定靶位移走,从而负调节NF-κB信号通路的激活[4],是人类炎症和自身免疫疾病,包括类风湿关节炎(RA)、系统性红斑狼疮(SLE)、炎症性肠病(IBD)、银屑病、I型糖尿病、冠状动脉疾病、风湿性心脏病等的易感位点[5]。大多数Treg细胞在胸腺中发育,少数由外周CD4+T细胞诱导产生。泛素化是一种蛋白质翻译后修饰方式,在NF-κB激活中发挥重要作用[6]。然而,A20在T细胞,特别是调节性T细胞中的作用仍不清楚。本研究主要探讨A20的表达与Treg细胞增殖和凋亡的关系。
材料与方法
1 材料 IL-2购自R&D公司;A20flox/flox小鼠、CD4–cre小鼠购自上海南方模式生物科技股份有限公司,均饲养在恒温(25~27℃)、恒定湿度(45%~55%)无特殊病原菌(SPF级)环境中(该动物实验遵循国际动物实验福利指南《关于动物伦理与福利的作者指南共识》,已获得审查机构的批准(伦理审批件文号鲁血伦审字[2022]2号));RPMI 1640培养基购自Gibco生物公司;小牛血清购自Hyclone生物公司;PCR试剂盒购自TaKaRa生物公司;免疫磁珠细胞分离试剂盒购自BD公司,LD分离柱、MS分离柱、MidiMAC分选器购自MACS 公司;FACSCanto Ⅱ流式细胞仪购自美国BD公司。
2 方法
2.1 条件性敲除小鼠A20基因:将A20flox/flox小鼠与CD4–cre小鼠杂交,得到在CD4+T细胞中A20基因敲除的CD4–cre A20flox/flox小鼠作为实验组(A20 cKO),A20flox/flox小鼠作为对照组(图1)。
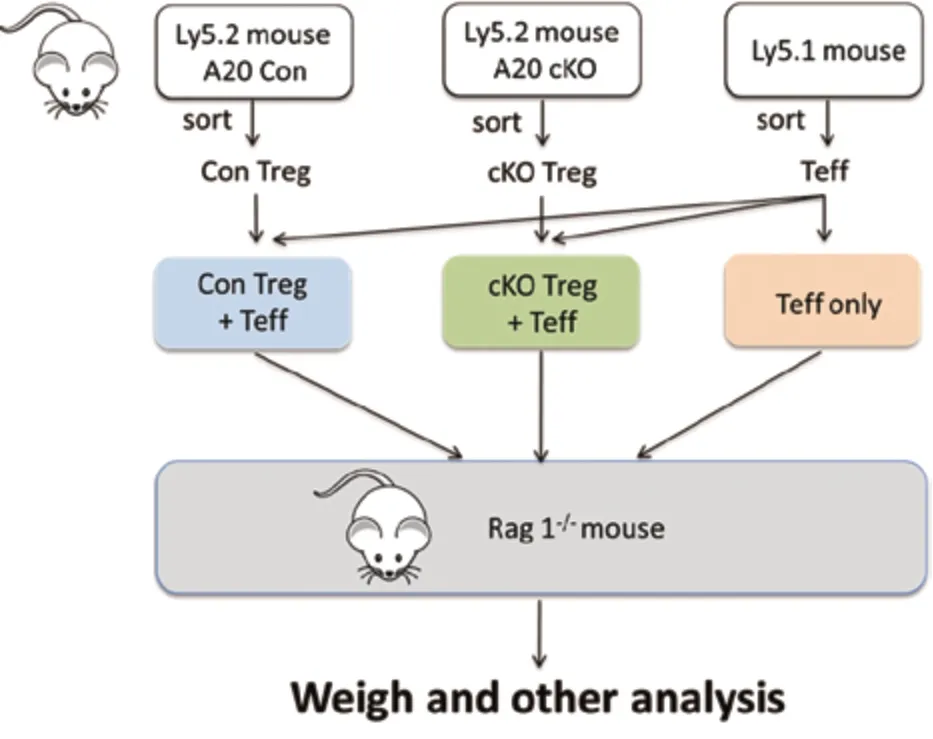
图1 A20基因条件敲除Treg细胞抑制能力分析实验
2.2 Treg细胞的分选:按说明书操作小鼠CD4+T 淋巴细胞磁珠分离试剂盒、LD 分离柱、MS 分离柱、MidiMAC分选器,阴性选择去除非CD4+T 淋巴细胞获得CD4+T 淋巴细胞;加入FITC CD25单克隆抗体,再加入磁珠标记抗FITC 后分选细胞,阳性选择获得CD4+CD25+Treg。
2.3 流式细胞术分析Treg细胞增殖及IL-2信号通路:分别分离6~8周实验组和对照组小鼠的胸腺和脾脏淋巴细胞,用Foxp3和TCRβ联合标记Treg细胞,流式细胞仪分析Treg细胞的比例和数量,并分析标识分子CTLA-4、CD73、FR4、GITR的表达。实验组和对照组小鼠尾静脉注射2 mg 5-溴脱氧尿嘧啶核苷(BrdU),12 h后继续注射2 mg BrdU,1 h后处死小鼠,分析Treg细胞的增殖情况;100 mg/mL的IL-2于37℃刺激CD4+T细胞20 min,pStat5、 pERK1/2和pAKT抗体标记,分析IL-2信号通路情况。
2.4 体内实验分析Treg细胞的抑制能力(图1):从3种基因型小鼠中分别分离不同类型T细胞:Ly5.2(CD45.2) A20flox/flox小鼠分离Treg细胞的作为对照组(Con Treg)、Ly5.2 (CD45.2)CD4–Cre A20flox/flox小鼠分离Treg细胞的作为实验组A20基因条件敲除Treg(cKO Treg)、Ly5.1 (CD45.1)小鼠分离T细胞作为效应性T细胞(Teff)。将3种T细胞分别混合分成3组:Con Treg+Teff组、cKO Treg+Teff组、Teff组,分别尾静脉注射给Rag 1-/-基因敲除小鼠(免疫缺陷小鼠,每组10只)。每周2次称量小鼠体重,绘制体重变化曲线。
2.5 统计学方法 采用SPSS 11.0统计软件。计量数据以均数±标准差表示。率的比较采用χ2/卡方检验。P<0.05为差异有统计学意义。
结果
1 Treg细胞在A20 cKO小鼠胸腺和脾脏中明显增加A20 cKO小鼠T细胞没有明显的变化,但是,其胸腺和脾脏中Foxp3+Treg的比例和数目均明显增加(P<0.05,图2)。这一结果表明A20基因的缺失可能是造成Treg细胞增加的原因。

图2 A20 cKO小鼠的胸腺和脾脏中Treg细胞比例和数目均明显增加
2 Treg细胞表面分子的分析无明显变化:为进一步分析增加的Treg标记物是否有变化,采用流式细胞仪分析实验组和对照组Treg细胞表面分子CTLA-4、CD73、FR4、GITR的变化,显示实验组和对照组小鼠胸腺和脾脏的Treg细胞中,以上4种表面分子的表达无明显变化(图3)。
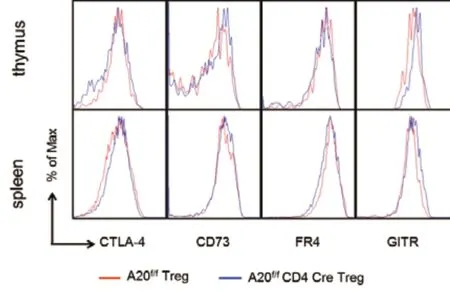
图3 A20 cKO小鼠Treg细胞表面分子的表达情况
3 体内实验不同组小鼠体重变化情况 基于以上流式细胞仪检测结果发现A20 cKO小鼠胸腺与脾脏Treg细胞比例及数量明显增加,表面分子表达无明显变化,进一步进行体内实验,以探索Treg细胞功能的变化情况。以原始体重为基数,每周2次测量实时体重值/原始体重做为百分比体重(percent body weight,PBW),以时间为横坐标,百分比体重为纵坐标(图4),发现只注射正常效应性T细胞(Teff)的Rag 1-/-小鼠,Teff细胞引起的急性自身免疫性反应,3周内体重明显下降,3周后体重稳定并有一定上升;分别联合注射Con Treg+Teff组、A20 cKO Treg+Teff组细胞的Rag 1-/-小鼠体重变化无明显差别(P>0.05,图4),说明实验组A20 cKO与对照组Treg细胞在体内表现的抑制能力无明显差别。

图4 尾静脉注射不同细胞组合Rag 1-/-小鼠体重变化图
4 外周Treg细胞来源分析 进一步探讨A20 cKO小鼠体内增加的Treg是来自胸腺(tTreg)还是来自外周淋巴组织(pTreg)。神经纤毛蛋白(Neuropilin 1,Nrp 1)在tTreg特异性表达,而在pTreg低水平表达,因此Nrp 1可作为胸腺来源tTreg的表面标志物[7],在A20 cKO小鼠外周淋巴器官淋巴结和脾脏中发现Nrp1+Treg明显增多,说明增加的Treg很可能来源于胸腺(P<0.05,图5)。

图5 A20 cKO小鼠和对照组小鼠外周淋巴器官中Nrp 1+ Treg的表达
5 tTreg增殖和凋亡分析 A20 cKO小鼠外周淋巴器官的Treg大部分来自胸腺,为研究A20的缺失对tTreg的影响,使用BrdU和膜联蛋白V(Annexin V)分别分析tTreg的增殖和凋亡。A20缺陷tTreg表现正常增殖和凋亡,提示A20在胸腺来源的tTreg增殖和凋亡没有影响(P>0.05,图6)。6 A20对IL-2信号通路的影响 为探讨A20在白细胞介素2(IL-2)信号通路中的作用,分析不同类型小鼠中Stat5、ERK1/2、Akt磷酸化情况,发现A20缺陷小鼠Stat5的磷酸化增强(P<0.05,图7),而ERK1/2和Akt则无显著差异,说明A20可能通过调节Stat5的磷酸化影响IL-2的分泌。
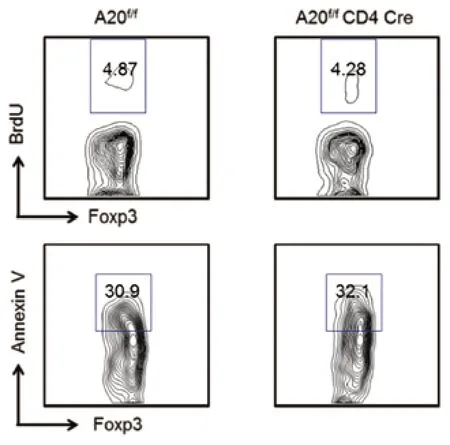
图6 胸腺tTreg的增殖和凋亡

图7 Stat5 ERK和Akt 在不同小鼠中磷酸化情况
讨论
本研究通过杂交手段获得A20flox/floxCD4–Cre小鼠(A20 cKO)即A20基因在该小鼠CD4+T细胞中被条件性敲除,发现该小鼠发育无明显缺陷,但胸腺和外周组织中Treg细胞比例和数量显著增加,推测A20基因的缺失可能是造成Treg细胞增加的原因。通过进一步分析Treg表面分子CTLA-4、CD73、FR4、GITR的变化,发现四种关键因子在2种小鼠Treg细胞上的表达无明显差异,表明增加的Treg功能未受影响。为进一步确认Treg细胞的功能,体内实验不同组合的细胞尾静脉注射小鼠,观察体重变化,提示Treg的抑制作用未受影响。以往的研究表明,IL-2分泌的增加是Treg细胞增殖的主要原因。IL-2是一种O-糖基化的四α螺旋束细胞因子,主要由活化的T细胞、树突状细胞和B细胞产生,维持T细胞内稳态。Stat5、ERK1/2、Akt分别作为必需的介导分子,是IL-2三条主要的信号通路。在功能上,IL-2诱导活化的CD4+和CD8+T细胞表达IL-2和IL-2Rα,并刺激其增殖[8]。同时,IL-2在维持外周血自身耐受中也起着重要作用,它通过抗原再刺激后启动Fas介导的活化诱导CD4+T细胞死亡以及促进调节性T细胞的分化和存活。缺乏IL-2、IL-2Rα或IL-2Rβ的小鼠没有表现出严重的免疫缺陷表型,而是表现出活化T细胞增多,Treg细胞数量减少,并发展为自身免疫性疾病。在自身免疫性肝炎(autoimmune hepatitis,AIH) 疾病诊断中,A20 蛋白水平与临床指标正相关,Treg细胞水平与临床指标呈显著负相关[9]。
Treg的增加与免疫平衡作用相关,本研究通过检测细胞表面特异性表达的标志物,发现A20缺陷型小鼠外周Treg细胞主要来源于胸腺,且在体内、体外均表现出正常的抑制功能。以往的研究发现,A20作为炎性反应的内源性调控蛋白和组织细胞保护性蛋白,通过TNF途径和TLR途径,利用其N端的去泛素化和C端的泛素化作用,负调控p38MAPK/NF-κB信号通路上的多种信号分子,减少细胞炎症因子的产生[10-11]。LPS炎症状态下,A20可通过抑制NF-κB通路使E-selectin表达降低,提示A20可作为干预心脑血管患者血管内皮细胞的一个重要靶点[12]。在前列腺癌相关研究中,A20能够负反馈调节NF-κB表达,抑制细胞的凋亡[13]。诱导提高抗炎分子A20的表达将有望成为治疗SLE疾病的新策略,PBMC中A20水平升高可抑制TLR2、4-p38MAPK/NF-κB信号通路,从而明显改善对MRL/lpr狼疮模型小鼠的炎症反应[14]。Jurkat细胞对DEX耐药,A20过表达联合DEX可增加对DEX 耐药细胞的敏感性,降低Jurkat细胞增殖率;下调Jurkat 细胞中NF-κB的表达水平,促进Jurkat细胞的凋亡[15]。Imatinib通过上调A20水平抑制NF-κB通路激活[16]。
针对IL-2主要的Stat5、ERK1/2、Akt磷酸化3条信号通路进行分析,发现A20缺陷小鼠Stat5的磷酸化增强,且通过使用BrdU和Annexin V分析tTreg的增殖和凋亡,证明A20对tTreg增殖和凋亡没有影响,因此,推测Treg的增加可能与IL-2和TCR信号增强有关,而不是由细胞增殖和凋亡引起的。这些结果说明A20在调节性T细胞增殖中起重要的负调控作用,这与FISCHER等的研究结论一致[17],本研究进一步发现A20主要通过抑制IL-2信号通路中Stat5的磷酸化,抑制IL-2分泌,进而抑制Treg增殖,维持免疫内稳态。A20基因条件敲除小鼠Treg中IL-2的Stat5磷酸化信号通路负调控水平降低,促进IL-2分泌,从而促进Treg细胞的增殖。本研究虽然证实A20在Treg增殖中对IL-2信号通路的负调节作用,但如何进一步确定A20对Stat5的磷酸化/去磷酸化的作用机理?A20为什么不通过影响IL-2另外两条ERK1/2、Akt磷酸化信号通路起作用?ERK1/2、Akt磷酸通路阻断后,Stat5的变化情况如何?这些问题仍需要下一步深入研究。
利益冲突所有作者均声明不存在利益冲突
