加温加压输血仪器核心性能检测的实验研究*
2022-08-22李艳辉施琳颖周谋许京菁谢婷婷单桂秋
李艳辉 施琳颖 周谋 许京菁 谢婷婷 单桂秋
创伤或手术中大出血,是导致死亡的重要原因之一,因此及时足量地补充有效循环血量是提高生存率的重要手段。研究表明,输血早期扩容速率比容量更为重要[1]。此外,红细胞采集后保存需要维持在2~6℃之间,因此在不加热血液的情况下,输血存在降低体温的风险。同时有研究表明,快速输注大容量(30 mL/kg)4℃的晶体液会在30 min后导致核心体温下降约1.3~1.5℃,输注液体总量在1~1.5 L[2-4],存在导致低体温的风险。有研究报道,在手术过程中,与室温静脉输液相比,加热静脉输液可以保持患者核心体温,进一步降低低温休克等风险[5]。因此探索加温加速输液输血方式,对预防患者核心体温降低,治疗大出血导致的失血性休克,降低死亡风险具有重要意义。
目前国内尚无加温加压一体的输液输血装置,本课题组通过参考借鉴现有单一加温或加压仪器和方法的基础上进行创新研究,研发了一套加温加压输血仪器。本仪器包括采用机械加压方式的速度控制设备和利用热传导方式的加热装置两部分,采用了Pro/E建模软件进行三维结构设计,主机以PIC16F1947微处理器芯片为核心,利用蠕动泵实现精准控速。可分离式加温器单独使用PIC16F1936微处理器与主机通讯,通过PID算法实现控温。同时配套一次性使用加温盒(管路耗材),加温盒传热表面采用铝合金材料制作,并采取双面加温和对向齿形铝板结构设计,提高了加温效率[6]。
本实验检测了生理盐水和悬浮红细胞流速和加温效果以及悬浮红细胞输出前后FHb、钾离子和红细胞形态的变化,以此初步评估仪器的应用效果,为下一步临床应用提供数据基础。
材料与方法
1 实验材料 加温加压输血仪器(KSW3100型,自制,图1),配套急救输血输液控温控速系统(Super Warmer 3100),手持式数字温度计(AI-5500,厦门宇电自动化科技有限公司),低温恒温槽(DC-0506,上海舜宇恒平科学仪器有限公司),便携式桌上型数据记录仪(FLUKE2638A), 透析参考仪表HDM97(IBP Medical,HDM99/97),医用冷藏冰箱(4℃,海尔),数显水浴恒温振荡器(SHA-B,常州澳华仪器有限公司),微量游离血红蛋白试剂盒(50T,48样,批号20200515,南京建成生物工程研究所),752紫外可见分光光度计(上海菁华科技仪器有限公司),台式离心机(Eppendorf 5804,德国)。低速离心机(KDC-1044,安徽中科中佳科学仪器有限公司),全自动生化分析仪(罗氏cobas c 702,瑞士),全自动血细胞分析仪(迈瑞BC-3000,中国深圳)。

图1 加温加压输血仪器
2 实验方法 实验利用加温加压输血仪器进行了不同加热温度和流速条件下对生理盐水加热温度和流量的检测。实验环境温度25℃,相对湿度68%, 101.3 kPa大气压强。经2~6℃冷藏的悬浮红细胞通过加温加压仪器输出前后温度、游离血红蛋白浓度、钾离子浓度和血常规检测。
本实验所用悬浮红细胞来源于中国人民解放军南部战区血液中心,为传染病检测合格而谷丙转氨酶检验不合格的效期内报废血液,实验结束后血液废液进行无公害化处理。
2.1 生理盐水和悬浮红细胞流速检测:检测加温加压输血仪器显示50 mL/min、100 mL/min、150 mL/min、200 mL/min流速下,用透析参考仪表检测4组流速实际生理盐水和悬浮红细胞的流速,每组检测3次,比较生理盐水组和悬浮红细胞组的流速差异(n=12)。
2.2 生理盐水输出温度的检测:生理盐水初始温度为(10±0.5)℃和(20±0.5)℃时,检测在36℃、38℃、40℃、42℃预设加温条件下流速分别为50 mL/min、100 mL/min、150 mL/min、200 mL/min时加温加压仪器生理盐水输出温度(n=3)。经前期预实验检测到机器在50 s左右时输出温度趋于稳定,所以我们在第60 s,90 s和120 s时用手持式数字温度计检测生理盐水输出温度。
2.3 快速加温加压悬浮红细胞输出温度的检测:悬浮红细胞从4℃冰箱取出。安装定制管路,室温生理盐水预充管路,连接悬浮红细胞血袋,加温前测试管路中悬浮红细胞液体(n=6)温度为(16.78±1.37)℃。在42℃预设加温条件下分别调节流速为50 mL/min、100 mL/min、150 mL/min和200 mL/min,在启动的第60 s时检测加温加压后每个流速(n=6)的输出温度。
2.4 悬浮红细胞快速加温加压输出后上清FHb浓度检测:留取加温加压前(对照组)悬浮红细胞样本(n=36)和加温(42℃)加压后流速分别为50 mL/min、100 mL/min、150 mL/min、200 mL/min时悬浮红细胞样本(4组流速每组n=9)。经台式离心机(1590×g)离心5 min后取上清液。游离血红蛋白检测按照试剂说明书方法利用分光光度计测试上清液中FHb浓度,比较加温加压前后两组FHb浓度的差异。计算每组加温加压前后FHb浓度差值(n=9),比较 42℃加温后不同流速共4组的FHb浓度变化的差异。
2.5 悬浮红细胞快速加温加压输出前后上清钾离子浓度检测:留取加温加压前(对照组)悬浮红细胞样本(n=3)和加温(42℃)加压后流速分别为50 mL/min、100 mL/min、150 mL/min和200 mL/min时悬浮红细胞样本,4组流速每组3个样本(n=3)于肝素锂抗凝管。经低速离心机(1620×g)离心3 min后,使用全自动生化分析仪检测上清中钾离子浓度。
2.6 悬浮红细胞快速加温加压输出前后血常规检测:留取加温加压前(对照组)悬浮红细胞样本(n=3)和加温(42℃)加压后流速分别为50 mL/min、100 mL/min、150 mL/min和200 mL/min时悬浮红细胞样本,4组流速每组6个样本(n=6)于血常规管EDTA·K2抗凝管。检测血常规,统计HGB、HCT、MCV、MCH四个指标在加温加压前后的变化。
3 统计学处理 使用SPSS 20.0软件进行统计分析处理,实验数据以均数±标准差()表示。采用单因素方差分析(One-Way ANOVA)比较多组数据间差异,若样本总体方差齐,比较采用LSD法分析;若样本总体方差不齐采用Dunnett T3法分析。采用独立样本t检验比较生理盐水与悬浮红细胞检测流速的数据差异。采用配对样本t检验比较悬浮红细胞加温前后FHb两组数据的差异。P<0.05视为差异有统计学意义。
结果
1 生理盐水与悬浮红细胞流速检测 经加温加压输血仪器输出的生理盐水和悬浮红细胞用透析参考仪表检测实际流速(见表1)所示。悬浮红细胞液体的密度高于生理盐水,检测到其平均流速略低于生理盐水的流速。生理盐水和悬浮红细胞两组流速之间比较,经两独立样本(n=12)t检验分析,结果显示t=0.111,P=0.905,P>0.05,两组数据的差异没有统计学意义。2 生理盐水(10±0.5)℃和(20±0.5)℃输出温度检测结果 在36 ℃、38 ℃、40 ℃、42 ℃加温条件下,流速为50 mL/min、100 mL/min、150 mL/min、200 mL/min时,10℃和20℃生理盐水输出温度见下方表2和表3。
表1 生理盐水流量检测(±s)

表1 生理盐水流量检测(±s)
显示流速 50 mL/min 100 mL/min 150 mL/min 200 mL/min生理盐水检测流速 50.5±0.5101.17±0.76149.33±0.58199.33±1.53悬浮红细胞检测流速 50.17±0.7698.83±0.76148.33±0.58192.67±1.15
表2 不同流速与加热温度条件下(10±0.5 )℃生理盐水的输出温度(±s)
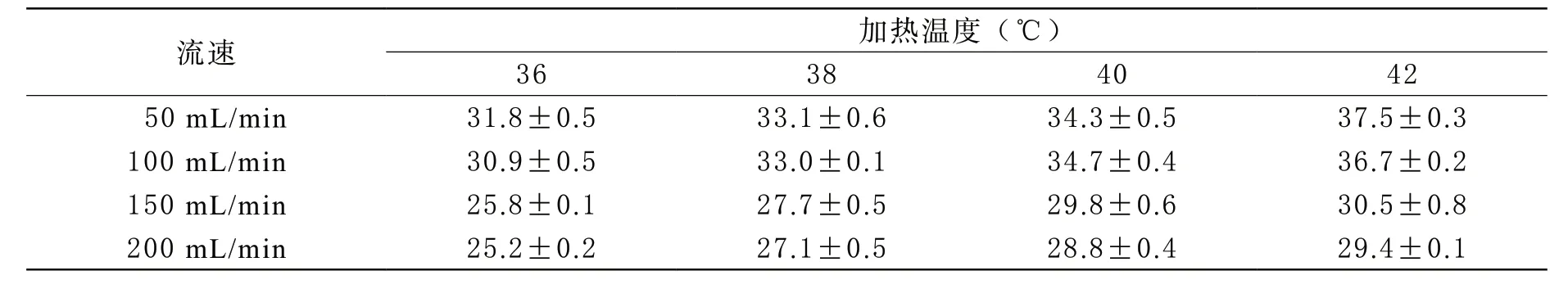
表2 不同流速与加热温度条件下(10±0.5 )℃生理盐水的输出温度(±s)
流速 加热温度(℃)3638 4042 50 mL/min 31.8±0.533.1±0.634.3±0.537.5±0.3100 mL/min 30.9±0.533.0±0.134.7±0.436.7±0.2150 mL/min 25.8±0.127.7±0.529.8±0.630.5±0.8200 mL/min 25.2±0.227.1±0.528.8±0.429.4±0.1
表3 不同流速与加热条件下(20±0.5)℃生理盐水的输出温度(±s )

表3 不同流速与加热条件下(20±0.5)℃生理盐水的输出温度(±s )
流速 加热温度(℃)3638 4042 50 mL/min 34.5±0.136.0±0.137.9±0.339.5±0.2100 mL/min 31.8±0.133.7±0.435.2±0.238.8±0.9150 mL/min 30.8±0.332.1±0.433.4±0.334.5±0.2200 mL/min 29.2±0.330.5±0.231.8±0.233.2±0.4
3 悬浮红细胞输出温度的检测结果 42℃加温,流速为50 mL/min、100 mL/min、150 mL/min和200 mL/min时每组输出温度(n=6)分别为(40.8±0.3)℃、(36.4±0.2)℃、(34.7±0.9)℃和(32.8±0.4)℃,与加温加压输注前悬浮红细胞在管路中的温度(16.8±1.4)℃进行多组比较,F=878.641,P=0.000,P<0.05,五组数据间的差异均有统计学意义(见图2)。
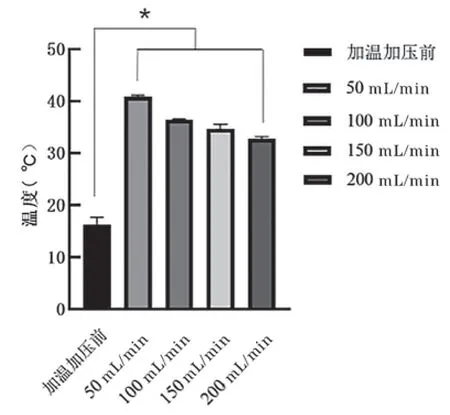
图2 悬浮红细胞42℃加温不同流速输出温度
4 悬浮红细胞加温加压输出前后FHb含量变化
4.1 输注前、后悬浮红细胞上清中FHb含量比较:加热温度42℃时,加温加压前、后两组悬浮红细胞中FHb(n=36)经配对样本t检验统计分析显示,加温加压后悬浮红细胞中FHb含量升高,差异具有统计学意义,t=-10.503,P=0.000,P<0.05。

表4 加温加压前、后悬浮红细胞中FHb含量
4.2 42℃加温不同流速时悬浮红细胞上清中FHb增加值比较:42℃加温,流速为50 mL/min、100 mL/min、150 mL/min和200 mL/min时的输出悬浮红细胞中FHb含量较加温加压前增加值(n=9)分别为67.28±36.20、70.37±28.09、75.40±53.30和89.95±53.98 mg/L,F=0.462,P=0.710,P>0.05,差异没有统计学意义,见图3。
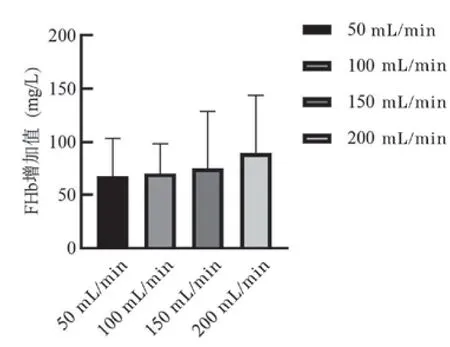
图3 输出悬浮红细胞FHb增加值的比较
5 加温加压输出前后钾离子浓度检测结果 42℃加温,悬浮红细胞在加温加压前(n=3)和流速为50 mL/min、100 mL/min、150 mL/min、200 mL/min流速时的检测到的悬浮红细胞上清中的钾离子浓度(n=3)分别为(15.50±2.15)mmol/L、(15.57±2.20)mmol/L、(15.63±2.15)mmol/L、(15.73±2.15)mmol/L、(16.27±1.96)mmol/L。F=0.063,P=0.970、0.940、0.896、0.668,P>0.05,差异没有统计学意义,见图4。
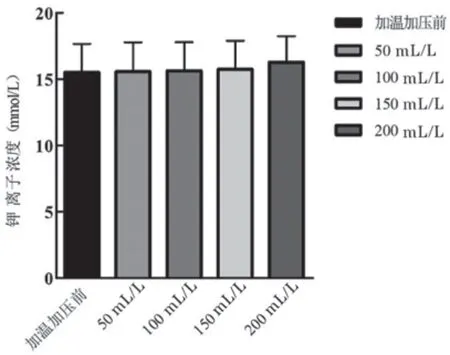
图4 输出前后悬浮红细胞上清中钾离子浓度比较
6 悬浮红细胞加温加压输出前后血常规检测 悬浮红细胞在加温加压前后经血常规检测分析可以看到加温加压前(对照组)和加温加压后不同流速的4组数据统计结果显示HGB、HCT、MCV、MCH四个指标不同组别的比较差异没有统计学意义。
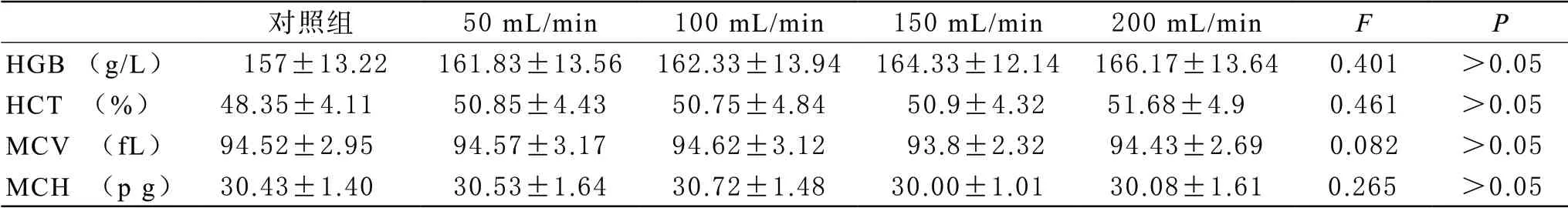
表5 加温加压前与不同流速加温加压后血常规检测红细胞情况(n=6)
讨论
当患者发生急性大出血时,为尽快补足血容量、恢复血压、保证重要脏器供血,同时提供血液止血成分,因此需要通过物理方法加压,达到快速输血的目的。有研究表明在30 min内完成补液量1000 mL时,SBP(收缩压) 、DBP(舒张压)、VCP(中心静脉压) 、SpO2(血氧饱和度) 回升显著,纠正休克效果优于传统的治疗方法,保障了手术进行顺利[7-8]。然而,由于血库保存的血液温度较低,在快速大量输血的情况下,患者容易产生输血低温反应,会出现血管痉挛、体温降低、血压升高等危险症状,甚至心脏停搏[9]。研究表明在术中进行主动升温,可以有效减少身体核心温度的降低[10-11]。基于这些原因,本课题组研发了加温加压仪器,以期既可以满足快速输液输血,又同时可以保证液体温度,防止低体温并发症。本实验通过检测输出温度和流速,检测加温加压前后悬浮红细胞上清中游离血红蛋白和钾离子的含量,以及悬浮红细胞的血常规,对该仪器的性能指标做了初步验证。
急性大量失血需快速输血时,输血速度可达 50~100 mL/min,因此本课题组研制的仪器设定液体流速在0.1~200 mL/min内可调。为了明确生理盐水与悬浮红细胞是否会由于密度、粘度系数等不同而影响流速,在室温环境下分别作了检测,结果发现悬浮红细胞流速略低于生理盐水,误差在10%以内,基本满足使用需求。根据药学理论有关输液问题的报道,输入人体的药液最佳温度为 32~34℃,在此温度下,人体对药液的吸收最好[12]。另外有研究表明,对晶体液生理盐水加温到54℃后输注不会改变晶体液的性质,是安全的[3]。与此同时,在手术中大量补液会造成患者丢失大量热量,有研究表明输注30 mL/kg剂量的4 ℃晶体液可以使38~45℃的高体温患者的体温降低1.2~1.4℃,同时输注加温到42℃的同体积晶体液会升高其基础体温0.2~0.8℃[13]。大量补充4 ℃晶体液可能导致围术期低体温(核心温度<36℃)[14],减弱机体免疫功能、损害凝血功能,进而增加了手术切口感染、出血、术后寒战以及心血管意外等发生的风险[15-16]。液体加热设备在手术静脉输注过程中必不可少,它控制输注液体如电解质溶液、红细胞及其他血液制品的输入温度,防止低体温并发症的发生。这些设备的技术比较成熟并在英国及全球的医疗保健系统中使用[17]。国外有使用加温设备和输液泵对不同流速为0.33、2、4、8、16 mL/min的复方乳酸钠溶液(compound sodium lactate,CSL)在室温条件下进行加温,可以获得22~36℃的输出温度[18]。我们研制的是结合加温设备和输液泵于一体的加温加压仪器,速度在0.1~200 mL/min内可调。在不同温度环境下,输注所用液体的起始温度也有所差异,这会影响液体的输出温度,因此我们检测了起始温度为(10±0.5)℃和(20±0.5)℃条件下,不同流速生理盐水的输出温度。结果表明设置加热温度为36℃,流速为50 mL/min和100 mL/min时,起始温度为(10±0.5)℃的生理盐水输出温度可以达到(31.8±0.5)℃和(30.9±0.5)℃,起始温度为(20±0.5)℃的生理盐水输出温度可以达到(34.5±0.1)℃和(31.8±0.1)℃,这足以防止输液过程中的低温。此外,在流速为100 mL/min时,设置加热温度在42℃时,起始温度为(10±0.5)℃和(20±0.5)℃的生理盐水输出可达(36.7~38.8)℃,起始温度为(16.8±1.4)℃的红细胞输出温度可达(36.4±0.2)℃。国外有研究报道发现,当液体以>30 mL/min的速度流动时,液体加热对体温过低有预防作用[19]。英国国家健康和保健医学研究所(The National Institute for Health and Care Excellence,NICE)建议在静脉输液超过500 mL或者麻醉时间超过30 min时需要对输注液体进行加温,输注血液制品需要加温到37℃[20]。因此,我们的实验结果表明本课题组研发的仪器加温效果和流速可以满足急救快速大量补液时对输液输血温度的要求,并且适用于在寒冷天气环境下急救输液输血。
有研究表明加热红细胞超过42℃可能会导致溶血,进而产生大量的细胞碎片、钾离子和游离血红蛋白,这些物质输入体内会引起心血管系统、凝血功能和电解质紊乱的风险[21]。马印图的研究结果说明在非流动情况下≤50℃ 加温10 min对血液红细胞影响不明显,超过55℃则红细胞损伤作用加重[22]。本仪器设置最高加热温度为42℃。除了温度对红细胞有影响,加压同样可能造成红细胞破裂损伤,因此我们检测了42℃加温条件下,不同流速对红细胞溶血情况的影响。我们通过检测加温加压前后输出的悬浮红细胞上清中FHb和钾离子浓度来判断悬浮红细胞溶血情况,结果发现在42℃加温,50 mL/min流速条件下,FHb的平均增加值在(67.28±36.20)mg/L,随着流速的增加,FHb的增加值也随之增加,钾离子浓度随着流速的增加也有升高,其中FHb的平均增加值和钾离子浓度在加温 加压后不同流速组别间比较差异没有统计学意义。根据我国《临床用血质量控制指标(2019版)》的有关规定,临床输血的质量标准“GB18469-2012《全血及成分血质量要求》”[23]: 全血保存期末血浆游离血红蛋白≤0.72 g/L。在血液质量控制标准中,全血和冰冻红细胞中游离血红蛋白有明确的规定,而悬浮红细胞目前无明确标准[24]。有研究表明悬浮红细胞保存35天后游离血红蛋白远高于全血组,说明红细胞制品在制备过程中明显发生细胞膜功能的减弱或破坏[25]。本研究结果显示使用本仪器加温加压后的悬浮红细胞有轻微损伤,但是其中游离血红蛋白含量低于《全血及成分血质量要求》的0.72 g/L,说明质量符合我们国家的上述标准求。
综上所述,本课题组研制的加温加压输血仪器性能较好,可以达到加温加压输血输液的要求,并且对红细胞影响较小,符合国家标准。这种仪器同时具备给液体加温和快速输注的性能,把临床上的输液泵和输液加温仪器有效结合在一起,以期减少操作上的复杂性并达到临床治疗效果,是本文的特色。但是初代的加温加压仪器也有短板,在加压的情况下加温,加热温度显示在数控操作区,经检测也可以达到目标温度。本文测试结果显示生理盐水和悬浮红细胞的输出温度在50 mL/min~150 mL/min的流速下输出温度均可以达到30℃以上,但是实际输出温度却没有在屏幕实时显示。下一步仪器的设计升级会考虑输出新增温度监测单元,并在仪器界面实时显示,以达到临床精准控温的目标,更利于临床推广应用。本文仅是在体外检测了初步性能检测,并未进行细胞内2,3-二磷酸甘油酸(2,3-diphosphoglycerate,2,3-DPG)、三磷酸腺苷(adenosine triphosphate,ATP)和细胞外过氧化氢(hydrogen peroxide,H2O2)含量变化检测[26-27],下一步拟进行更深一步的细胞应激反应、携氧能力、能量等检测,以及动物体内实验效果、安全性检测等等,为临床应用奠定充分的实验基础。
利益冲突所有作者均声明不存在利益冲突
