利拉鲁肽注射液对2型糖尿病合并冠心病患者血清炎性因子及胰岛素抵抗的影响
2022-08-19杜银苹董国华李菲耿猛
杜银苹,董国华,李菲,耿猛
(徐州市第一人民医院全科医学科,江苏徐州 221000)
糖代谢异常与心血管疾病密切相关,2型糖尿病(T2DM)是诱发冠心病(CHD)的高危因素[1]。随着饮食习惯变化及人口老龄化加剧,T2DM、CHD等疾病发生率逐年升高,严重影响患者生活质量。T2DM合并CHD病情复杂,会加重心肌损害,而心肌受损后会激活促炎因子,促使炎症因子释放增加,诱发炎性损伤形成恶性循环[2-3]。临床对T2DM合并CHD多采用降糖、调脂、抗血小板等药物进行治疗,可在一定程度上减轻病情,但在抑制机体炎症反应方面存在不足。利拉鲁肽为人胰高糖素样肽-1(GLP-1)类似物,充分保留GLP-1的多项生理活性,具有双重降糖机制[4]。基于此,本研究选择2020年8月—2021年11月本院收治的86例T2DM合并CHD患者为对象,通过随机分组对照,分析利拉鲁肽注射液对患者血清炎性因子及胰岛素抵抗的影响。报道如下。
1 资料与方法
1.1 一般资料
选择本院收治的86例T2DM合并CHD患者为研究对象。纳入标准:符合《中国2型糖尿病防治指南(2017年版)》[5]中T2DM相关诊断标准,《稳定性冠心病诊断与治疗指南》[6]中CHD相关诊断标准;沟通、交流能力正常;入组前未进行过相关治疗。排除标准:合并严重器质性疾病者;对本研究所用药物不耐受者;患有严重感染性疾病者;存在免疫功能障碍者;临床资料缺失者。本研究获本院医学伦理委员会审批,患者及其家属知情且签署同意书。按随机数字表法分为对照组(n=43)和观察组(n=43)。对照组:男23例,女20例;年龄52~76岁,平均年龄(64.15±5.13)岁;T2DM病程3~11年,平均病程(7.23±2.12)年;CHD病程2~7年,平均病程(5.13±1.34)年。观察组:男25例,女18例;年龄53~78岁,平均年龄(64.19±5.15)岁;T2DM病程3~12年,平均病程(7.29±2.05)年;CHD病程2~8年,平均病程(5.16±1.31)年。两组一般资料对比,差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 对照组
口服阿司匹林肠溶片(Bayer Vital GmbH,国药准字H20130339,规格:0.1 g/片),1片/次,1次/d;口服盐酸二甲双胍片(华北制药股份有限公司,国药准字H20113492,规格:0.5 g/片),1片/次,3次/d;口服阿托伐他汀钙片(乐普制药科技有限公司,国药准字H20133127,规格:10 mg/片),1片/次,1次/d。持续治疗1个月。
1.2.2 观察组
在对照组基础上皮下注射利拉鲁肽注射液(丹麦诺和诺德公司,国药准字J20160037,规格:3 mL:18 mg),0.6 mg/次,1次/d,若患者未出现不适反应,则于1周后将剂量增加至1.2 mg/次,1次/d。持续治疗1个月。
1.3 观察指标
(1)血清炎性因子水平:于治疗前后抽取患者清晨空腹静脉血5 mL,离心分离血清,通过酶联免疫吸附试验法检测肿瘤坏死因子-α(TNF-α)、高敏C反应蛋白(hs-CRP)、白细胞介素-6(IL-6)水平。
(2)胰岛素抵抗:于治疗前后抽取患者清晨空腹静脉血5 mL,离心分离血清,采用全自动化学发光免疫分析仪(厦门优迈科医学仪器有限公司,型号:Caris200,闽械注准20192220050)检测空腹胰岛素(FINS),分别计算胰岛素分泌指数(HOMA-β)、胰岛素抵抗指数(HOMA-IR)。
(3)心血管不良事件:包括心肌梗死、心力衰竭、心源性死亡、恶性心律失常等。
(4)不良反应:包括头晕、腹泻、恶心、皮疹等。
1.4 统计方法
采用SPSS 20.0统计学软件进行数据分析,计数资料如心血管不良事件、不良反应用[n(%)]表示,采用χ2检验,计量资料如炎性因子水平、胰岛素抵抗以(±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组血清炎性因子水平比较
两组治疗前TNF-α、hs-CRP、IL-6水平对比,组间差异无统计学意义(P>0.05);观察组治疗后TNF-α、hs-CRP、IL-6水平均低于对照组,组间差异有统计学意义(P<0.05)。见表1。
表1 两组血清炎性因子水平比较(±s)
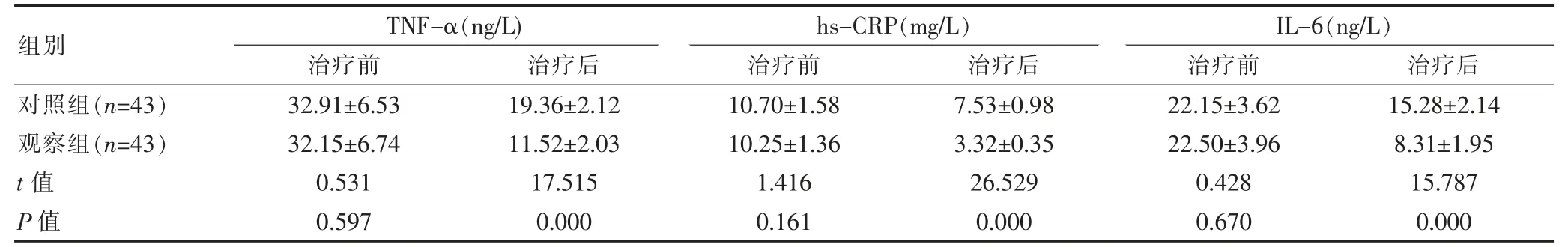
表1 两组血清炎性因子水平比较(±s)
组别对照组(n=43)观察组(n=43)t值P值TNF-α(ng/L)治疗前 治疗后hs-CRP(mg/L)治疗前 治疗后32.91±6.53 32.15±6.74 0.531 0.597 19.36±2.12 11.52±2.03 17.515 0.000 10.70±1.58 10.25±1.36 1.416 0.161 7.53±0.98 3.32±0.35 26.529 0.000 IL-6(ng/L)治疗前 治疗后22.15±3.62 22.50±3.96 0.428 0.670 15.28±2.14 8.31±1.95 15.787 0.000
2.2 两组胰岛素抵抗比较
两组治疗前HOMA-β、HOMA-IR对比,组间差异无统计学意义(P>0.05);观察组治疗后HOMA-β高于对照组,HOMA-IR低于对照组,组间差异有统计学意义(P<0.05)。见表2。
表2 两组胰岛素抵抗比较(±s)
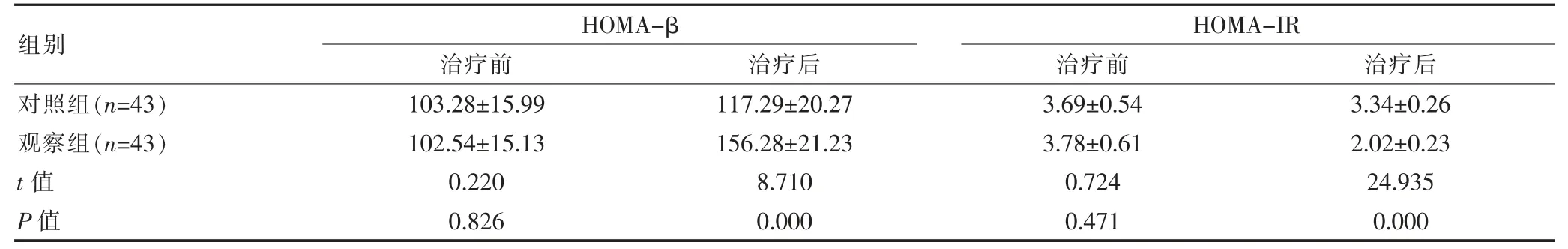
表2 两组胰岛素抵抗比较(±s)
组别对照组(n=43)观察组(n=43)t值P值HOMA-β治疗前 治疗后103.28±15.99 102.54±15.13 0.220 0.826 117.29±20.27 156.28±21.23 8.710 0.000 HOMA-IR治疗前 治疗后3.69±0.54 3.78±0.61 0.724 0.471 3.34±0.26 2.02±0.23 24.935 0.000
2.3 两组心血管不良事件比较
观察组心血管不良事件发生率低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 两组心血管不良事件比较[n(%)]
2.4 两组不良反应比较
对照组发生2例头晕、1例腹泻、2例恶心,不良反应发生率为11.63%(5/43);观察组发生2例头晕、2例腹泻、3例恶心、1例皮疹,不良反应发生率为18.60%(8/43)。两组不良反应发生率对比,差异无统计学意义(χ2=0.816,P=0.367)。
3 讨 论
T2DM属代谢紊乱性疾病,以血糖持续升高为典型特征,机体长期处于高血糖状态,会导致血管内皮损伤及血液流速减慢,促使动脉粥样硬化形成,进而影响心肌供血,促使CHD发生。研究发现,炎症反应参与动脉粥样硬化的形成,且炎症反应激活是导致动脉粥样硬化斑块不稳定的高危因素,会致使血栓形成,增加血管不良事件发生风险[7]。胰岛素抵抗是T2DM发病重要环节,与CHD发生密切相关,若胰岛素抵抗持续增加,冠状动脉病变程度会随之加重,故积极进行胰岛素抵抗治疗尤为重要[8]。
T2DM合并CHD病情复杂,临床治疗需兼顾多个方面,以促进病情改善。本研究结果显示,观察组TNF-α、hs-CRP、IL-6水平均低于对照组,HOMA-β高于对照组,HOMA-IR低于对照组,心血管不良事件发生率低于对照组(P<0.05),两组不良反应发生率比较,差异无统计学意义(P>0.05),表明在T2DM合并CHD患者中采用利拉鲁肽注射液治疗效果更佳,能够减轻炎症反应及胰岛素抵抗,降低心血管不良事件发生率,且具有较高安全性。分析其原因为,利拉鲁肽注射液为GLP-1类似物,与GLP-1具有高度序列同源性,作用机制广泛,能够促进胰岛素分泌,抑制胰高血糖素分泌,进而提高胰岛素敏感性,改善胰岛细胞功能,减轻胰岛素抵抗,增强常规药物降糖效果,有利于病情的控制[9]。CHD主要病理变化是心肌缺血-再灌注损伤,利拉鲁肽注射后能够快速激活促进存活信号通路,减少氧自由基产生,减轻心肌损伤,促使TNF-α等炎性因子释放减少,减少心肌细胞死亡,降低心血管不良事件的发生风险[10]。在常规降糖、调脂、抑制血小板聚集等治疗基础上加用利拉鲁肽,能够互相补充,从多个方面协同增强血糖控制效果,改善胰岛素抵抗,减轻炎症反应,预防心肌慢性损害,疗效更佳。
综上所述,在T2DM合并CHD患者中采用利拉鲁肽注射液治疗效果确切,能够有效降低炎性因子水平,减轻胰岛素抵抗,进而降低心血管不良事件发生风险,安全可靠。
