绵羊HSPA1L 基因的生物信息学分析
2022-08-19陈占玉黄永亮王维民王国秀李明月
陈占玉,黄永亮,王维民,李 冲,王国秀,李明月
(甘肃农业大学动物科学技术学院,甘肃 兰州 730070)
热休克蛋白(Heat Shock Proteins,HSPs)是由机体受损、受寒、紫外线暴露、组织修复等各种应激诱导表达的蛋白[1]。该蛋白由Ritossa 于1962年在果蝇体内发现,直至1974 年经Tissieres 证实并命名。HSPs 按大小可分为五大类,分别为HSP110(90-110KDa)、HSP90(83-90KDa)、HSP70(68-78KDa)、HSP60(40-60KDa)以及sHSP(12-34 KDa)[2]。HSPs 广泛存在于从低等生物到高等动物的机体中,当生物有机体暴露于高温时,就会由热激发合成HSPs 来保护机体细胞免受热损伤[3]。除高温环境以外,其他应激源如缺氧、严寒、中毒等恶劣环境也能诱发机体细胞生成HSPs,从而帮助每个细胞维持正常的生理活动,阻截影响细胞健康的蛋白质相互作用。也有研究发现,HSPs对维持绵羊心脏的正常功能也有重要作用[4]。
HSPA1L(heat shock protein family A member 1 like)是HSP70 蛋白中的一员,HSP70 是HSP 家族中稳定性最高含量最多的一类蛋白[5]。HSPA1L 与HSPA1A、HSPA1B 都属于HSP70 家族中的编码蛋白质基因,HSPA1L 基因编码蛋白有90%的氨基酸序列与HSP70 家族一致。HSP70 作为重要的应激蛋白,在保护细胞免于凋亡、氧化损伤和基因损伤中起着关键作用[6]。由于HSPA1L 基因是编码HSP70 的3 个基因之一,所以HSPA1L 基因对绵羊抗应激和免疫功能也极为重要。但HSP70 增强耐热力的作用机制模糊,如何通过技术措施诱导HSP70 基因在局部合理表达以提高免疫效率仍需进一步研究[7]。
目前针对HSPA1L 基因的研究集中在人类医学方面,有研究表明HSPA1L 编码蛋白与细胞损伤、肿瘤干细胞样特性和精子质量等有关[8]。绵羊虽然有较强的耐受性和抗逆能力,但热适应性较差,温度过高会对其健康和生长造成影响,如诱导机体发生氧化应激、降低干物质的采食量、损害肠道组织等[9],目前,国内外对绵羊HSPA1L基因的理论研究和生物信息学分析极少,缺乏实质性的参考信息。我们用生物信息学方法和程序软件对绵羊HSPA1L 基因的开放阅读框、蛋白质亲/疏水性、基因基本理化性质进行分析,预测HSPA1L 基因的初级和高级结构、跨膜区和亚细胞定位,旨在对绵羊的抗热应激和免疫等方面的研究提供理论基础和依据。
1 材料与方法
1.1 序列来源
从美国国立生物技术信息中心(NCBI)数据库中查询了绵羊HSPA1L 基因的mRNA 序列(登录号:XM_027958817.2),该序列来自爱荷华大学绵羊全基因组鸟枪测序(WGS)项目及绵羊基因组功能注释计划项目,绵羊品种为兰布莱绵羊(Rambouillet)。同时下载了除绵羊以外的其他11 个物种的HSPA1L 基因编码蛋白质序列(表1)。
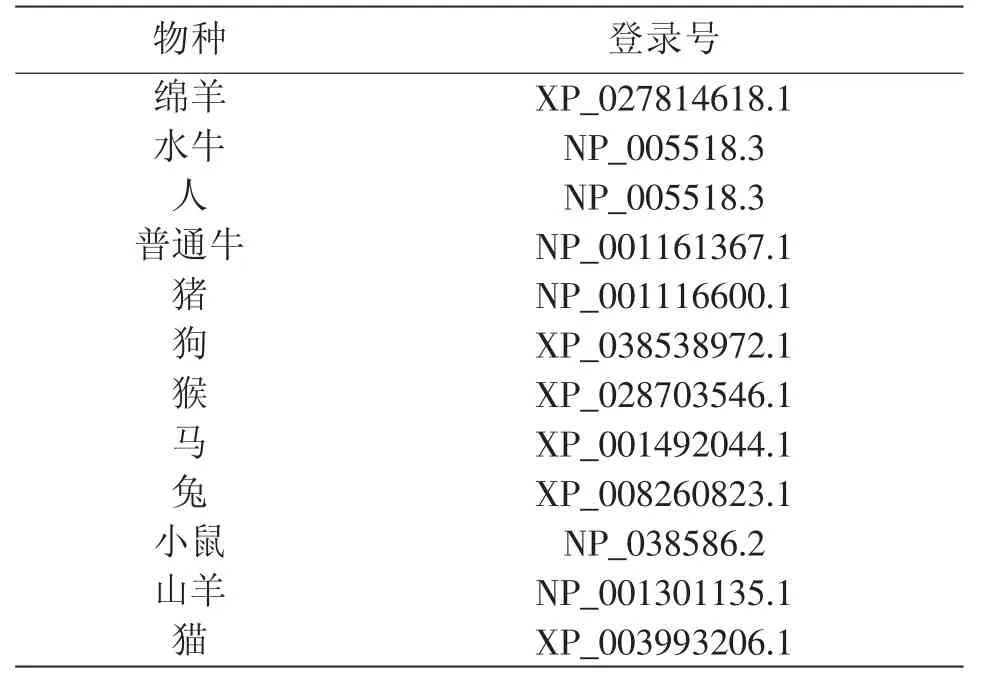
表1 12 个物种的HSPA1L 基因编码蛋白质序列
1.2 研究方法
绵羊HSPA1L 基因开放阅读框(Open reading frame,ORF)采用NCBI 的ORF Finder 程序分析(https://www.ncbi.nlm.nih.gov/orffinder/)。采用Bioedit软件预测HSPA1L 基因编码产物的基本理化性质(https://www.expasy.org/resources/protparam)。蛋白亲疏水性采用ProtScale 工具进行分析(http://ca.expasy.org/tools/protscale.html)。蛋白潜在信号肽预测采用SignalP 方法分析(http://www.cbs.dtu.dk/services/SignalP-3.0/)。蛋白质亚细胞定位预测采用PSORT 方法预测(https://psort.hgc.jp/form2.html)。跨膜螺旋区域的预测采用TMHMM Server v.2.0 程序分析(http://www.cbs.dtu.dk/services/TMHMM)。采用DNAMAN 软件对多序列比对和同源性分析进行预测。HSPA1L 基因的保守结构域采用网站分析http://smart.embl-heidelberg.de/。蛋白二级结构的预测采用Jpred 软件分析,三级结构的预测使用SWISS-MODEL 在线工具进行分析(https://www.swissmodel.expasy.org/)。
2 结果与分析
2.1 绵羊HSPA1L 基因开放阅读框分析
开放阅读框(Open reading frame,ORF)是一段可编码蛋白质中间无终止序列打断,从启动子到终止子的碱基序列,通过识别ORF 可以快速识别出基因序列中的编码区域[10]。从ORF 分析结果可以看出(图1),序列中共识别的绵羊HSPA1L 基因有20 个ORF,其中最大长度的ORF 有1 926 bp,推测其编码641 个氨基酸残基。

图1 绵羊HSPA1L 基因序列的ORF 分析
2.2 绵羊HSPA1L 基因蛋白基本理化性质分析
蛋白质基本性质主要包括氨基酸组成、相对分子质量和等电点[11-13]。本文采用Bioedit 软件预测绵羊HSPA1L 基因编码蛋白质的理化特性并分析该基因编码产物的氨基酸组成,结果显示(表2),绵羊HSPA1L 基因可编码641 个氨基酸,其中Ala 的比例最高,为9.0%;含量最少的是Trp,为0.3%。负电荷残基总数(Asp+Glu)为89,正电荷残基总数(Arg+Lys)为83,分子式为C3094H4985N859O969S20,理论等电点pI 为5.89,不稳定指数为32.56。

表2 绵羊HSPA1L 基因编码产物的氨基酸组成
2.3 绵羊HSPA1L 基因蛋白质亲/疏水性分析
蛋白质的亲疏水性取决于氨基酸序列,一般高度易溶的蛋白质袒露在最外侧的都为亲水蛋白,最内侧的都为疏水蛋白[14]。采用ProtScale 程序分析绵羊HSPA1L 基因编码蛋白质的亲/ 疏水性分析,(图2)表明,绵羊HSPA1L 基因编码蛋白的疏水性最大值为2.211(第397 位),最小值为-3.056(第250 位),故绵羊HSPA1L 基因编码的蛋白是亲水蛋白。

图2 绵羊HSPA1L 基因蛋白质亲/疏水性分析
2.4 编码蛋白质的信号肽预测
信号肽序列是分布在分泌蛋白基因的编码序列中的位于起始密码子之后的一段含有较多疏水氨基酸多肽的序列[15]。绵羊HSPA1L 基因编码产物的C 值为0.088,Y 值为0.114,S 值为0.515(图3)。表明绵羊HSPA1L 基因的编码产物不存在信号肽。

图3 绵羊HSPA1L 基因蛋白潜在信号肽预测结果
2.5 绵羊HSPA1L 蛋白质亚细胞定位预测
采用PSORT 方法预测绵羊HSPA1L 蛋白质亚细胞定位。绵羊HSPA1L 蛋白分布在细胞质中的可能性是69.6%,在细胞核内的可能性是26.1%,在线粒体中为4.3%(表3)。表明绵羊HSPA1L 基因在细胞核中发挥的作用较小,主要是在细胞质中发挥生物学作用。

表3 绵羊HSPA1L 蛋白质亚细胞定位预测分析
2.6 绵羊HSPA1L 基因跨膜区预测
应用TMHMM Server v.2.0 程序分析了绵羊HSPA1L 基因的信号肽,结果显示(图4),绵羊HSPA1L 基因编码产物没有跨膜区。

图4 绵羊HSPA1L 基因跨膜螺旋结构分析结果
2.7 多序列比对和同源性分析
HSPA1L 基因在很多物种中均有表达。本文采用DNAMAN 软件对水牛、人、普通牛、绵羊、猪、狗、猴、马、兔子、小鼠、山羊和猫的HSPA1L 蛋白多序列进行比对的结果显示(图5),HSPA1L 基因在以上12 个物种中都有表达,且绵羊与普通牛和猪的HSPA1L 氨基酸序列同源性最高,说明绵羊与普通牛和猪在进化过程中有较近的亲缘关系。由HSPA1L 编码产物的同源树可以证明,在分析选择的12 个物种中,绵羊与普通牛和猪的同源性最高(图6)。

图5 12 个物种的HSPA1L 基因编码产物的同源树

图6 12 个物种的HSPA1L 基因编码序列的同源性分析
2.8 绵羊HSPA1L 蛋白保守结构域分析
采用Smart 软件分析HSPA1L 蛋白保守结构域,绵羊HSPA1L 蛋白包含2 个结构域,分别位于370~380 和393~405 位,均为低复杂性结构域(lowcomplexity domain)(图7)。
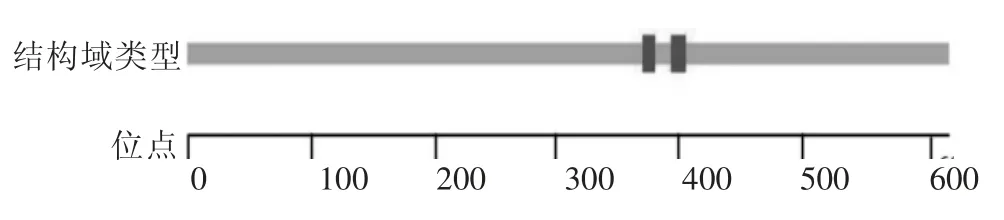
图7 绵羊HSPA1L 蛋白保守结构域分析
2.9 绵羊HSPA1L 蛋白二级结构的预测分析
蛋白质的二级结构是2 条核苷酸链反向平行盘绕所生成的双螺旋结构。采用Jpred 软件对其进行预测,绵羊HSPA1L 蛋白二级结构中无规则卷曲(Cc)占58.81%,为绵羊HSPA1L 蛋白二级结构的主要组成部分;其次是α-螺旋(Hh),占比28.86%;β-折叠(Ee)占比最少,为12.32%(图8)。

图8 绵羊HSPA1L 基因编码蛋白质二级结构预测
2.10 绵羊HSPA1L 蛋白三级结构的预测分析
蛋白质的三级结构是在二级结构的基础上进一步盘绕折叠所形成的特定空间结构。使用SWISS-MODEL 在线工具对其进行预测分析结果显示(图9),HSPA1L 基因编码蛋白的三级结构中主要由无规则卷曲构成,结构较为复杂。

图9 绵羊HSPA1L 蛋白三级结构的预测分析
3 结论与讨论
本研究分析结果表明,绵羊HSPA1L 基因最长ORF 有1 926 个bp,其编码产物稳定,编码的蛋白以亲水性区域为主,是一种易溶的弱酸性蛋白质,不存在信号肽,无跨膜结构,主要在细胞质中发挥生物学作用。与普通牛、和猪的同源性最高,该蛋白二级结构和三级结构中占主导地位的都是无规则卷曲,结构较为复杂。
有研究表明,热休克蛋白1L(HSPA1L)是一种免疫性和保守性较强的蛋白[16]。通过生物信息学分析可知,绵羊HSPA1L 基因序列中最大长度的ORF 有1 926 个bp,可编码641 个氨基酸残基,呈弱酸性,较稳定,属于亲水蛋白且不存在信号肽。哺乳动物在热应激条件下,热休克细胞中的许多核蛋白会变的不可溶并成为基质的一部分,而在应激过程中合成的HSP70蛋白可向细胞核迁移,加速细胞核热休克的应激恢复[17]。本研究表明,HSPA1L 基因编码蛋白稳定性较强,二级结构和三级结构中占主导地位的都是无规则卷曲,结构较复杂。较强的稳定性和在结构上较高的保守性,是其在热应激条件下保持结构和功能稳定的分子基础。本研究还证实,HSPA1L 编码蛋白属于亲水蛋白。有研究表明热应激条件下HSP70 蛋白以亲水的方式结合到基质上在细胞核集中,以修复基质上变性的核蛋白[18]。
HSPA1L 基因主要在细胞质中发挥作用,基因编码产物没有跨膜区。有研究表明,正常生理状态下HSPs 主要存在于细胞质中[19],这与本研究一致。虽然细胞核对热更加敏感,但本文研究显示,绵羊HSPA1L 蛋白分布于细胞核的可能性仅为26.1%,而在细胞质中可能性高达69.6%,原因在于HSP70 中的HSPA9 蛋白是一个主要的线粒体伴侣蛋白,可通过线粒体的双层膜将细胞核中的HSPA1L 转移到细胞质中,从而使细胞质中HSPA1L 基因表达更加明显[20]。由于热休克蛋白基因具有高度应激性和高表达性,在应激源刺激下HSPA1L 基因有可能在细胞质中快速表达合成。应激条件下,HSP70 蛋白会迅速从细胞质进入到细胞核和核仁,而应激恢复期,又迅速从其他组织返回细胞质[17]。
在不同物种间绵羊与普通牛和猪的HSPA1L基因同源性最高为100%,这说明在进化过程中它们在该基因上具有较近的亲缘关系。但绵羊与山羊HSPA1L 基因同源性相对较低。绵羊与山羊的物种亲缘关系较近,但生活环境和适应性有较大差异,山羊的热适应性更强。这有可能是环境差异导致的自然选择过程中HSPA1L 基因在进化中出现了变异,但具体的进化机制,以及差异位点对该基因在抗热应激中发挥的作用和机理的影响仍需研究。
HSPA1L 基因作为编码HSP70 蛋白的基因,有可能对绵羊在热耐力形成过程中维持细胞内环境的稳定具有重要作用,并对绵羊在各种环境应激条件下的适应性具有重要影响[10]。以HSPA1L基因作为绵羊抗应激能力的分子标记选育开展分子标记辅助选育,有可能加快绵羊育种进程,改善绵羊的适应性,减少生产中降低应激,提高效益,节约成本,从而推动养羊业的发展。然而,HSPA1L 基因编码蛋白的生物学功能、表达调控以及HSPA1L 基因多态性与绵羊健康与生长发育的关系仍有待进一步研究。
