2016—2020 年西北部分地区马铃薯致病疫霉交配型分析
2022-08-19惠娜娜李培玲李继平
王 立,惠娜娜,李培玲,郑 果,李继平
(1.甘肃省农业科学院植物保护研究所,甘肃 兰州 730070;2.农业部天水作物有害生物科学观测试验站,甘肃 甘谷 741299)
我国是目前世界马铃薯种植第一大国。据统计,2019 年我国马铃薯种植面积576.7 万hm2,总产量9 920.5 万t,占全球总种植面积的29.9%和总产量的25.6%(FAO数据)[1]。马铃薯生产中,由致病疫霉[Phytophthora infestans(Mont.)de Bary]引起的晚疫病是最具有毁灭性的病害,已被视为世界第一大作物病害[2]。晚疫病在我国各马铃薯种植区常年发生,尤其是湿度大、气候冷凉的地区。据国家统计局官方数据,2008—2017 年我国马铃薯晚疫病普遍发生,危害严重,年平均发生面积197.47 万hm2,约占马铃薯总种植面积的40.66%。甘肃省的马铃薯晚疫病年平均发生面积为36.29 万hm2[3],严重发生的2012 年和2013 年,马铃薯晚疫病发生面积占种植面积的比率分别达到84.7%。2012 年,山西、重庆、宁夏等省(区、市)的发生面积也超过了种植面积的60%[4]。
20 世纪40 年代之前,马铃薯晚疫病菌主要为A1 交配型,1956 年Neiderhauser 在墨西哥中部发现了A2 交配型[5],1996 年张志铭等[6]首次在山西和内蒙古发现A2 交配型菌株,随后赵志坚等[7]、朱杰华等[8]也报道了在云南、河北、四川等地存在A2 交配型。田月娥[9]的研究发现,2009 年在甘肃和宁夏两个地区A1 交配型菌株广泛分布,但2010 年却没有检测到A1 交配型菌株,而是A2 交配型菌株在群体中占据优势。这种情况类似于欧洲一些国家晚疫病菌群体的变化形式,如芬兰和挪威在1993—1999 年之间的交配型变化情况。如果A1、A2 两种交配型同时存在,通过异宗配合进行有性生殖产生卵孢子,也有少量能自育产生卵孢子,卵孢子能够在土壤中越冬,成为次年主要的初侵染源[10]。同时卵孢子多集中在马铃薯植株较低部位的叶片,喷雾防治时很可能避开杀菌剂,使得化学防治更加困难。因此,A2交配型的出现被认为是晚疫病在各地严重发生的主要原因,对抗病育种和晚疫病的防治提出了新的挑战[11-12]。
我们在前人研究基础上继续监测了2016—2020 年甘肃、青海、宁夏3 地马铃薯产区晚疫病菌交配型并进行分析,以期为生产中科学规范施药与合理选用抗性品种相结合防治马铃薯晚疫病提供参考。
1 材料与方法
1.1 材料
2016—2020 年采集自甘肃、青海、宁夏3 省(自治区)马铃薯主产区的不同马铃薯品种(系)的晚疫病病样共计5 000 余份,经分离、纯化、保存的致病疫霉菌株共计1 040 株,对其中694 株进行了交配型测定。病样的采集地点涉及甘肃、青海、宁夏3 地马铃薯主产区的25 个县(区),包括甘肃省的皋兰县、榆中县、永登县、安定区、渭源县、陇西县、临洮县、民乐县、山丹县、永昌县、秦州区、张家川县、礼县、西和县、宕昌县、和政县、康乐县、静宁县、庄浪县、会宁县等20 个县(区);宁夏的隆德县和西吉县;青海湟中县、大通县和湟源县。采集的病样寄主品种主要为冀张薯8 号、冀张薯12 号、陇薯3 号、陇薯6 号、陇薯7 号、陇薯10 号、陇薯12 号、陇薯13 号、陇薯14 号、陇薯18 号、新大坪、庄薯3 号、庄薯7号、庄薯8 号、庄薯14 号、天薯11 号,定薯3号、定薯7 号,中薯18 号、中薯19 号、中薯21号、中薯22 号、中薯26 号、农天1 号、青薯2号、青薯9 号、荷兰15、克新13 号、宁薯12 号、宁薯16 号,希森6 号,凯薯1 号、凯薯2 号,陇彩1 号、甘农薯9 号、下寨65、丹马3 号、闽薯4 号、兴加12 号及天薯、陇薯、定薯系列部分品系。
1.2 方法
1.2.1 黑麦培养基和选择性培养基制备 黑麦番茄培养基制备方法为60 g 黑麦加水煮沸用4 层纱布过滤,用其过滤液加琼脂13~15 g、CaCO30.4 g、番茄汁100 mL,加蒸馏水定容至1 000 mL,分装,高压灭菌30 min。
选择性培养基制备方法:60 g 黑麦煮沸用4层纱布过滤,过滤液加琼脂13~15 g,蒸馏水定容至1 000 mL,分装高压灭菌30 min。冷却至45 ℃后加抗生素利福平20 mg/L、氨苄青霉素100 mg/L、五氯硝基苯(W=99%)50 mg/L。
1.2.2 晚疫病病菌分离、纯化 选取易感病品种马铃薯块茎用75%酒精表面消毒,切成梯形状薯片(3~5 mm 厚)。将马铃薯单病斑叶片放入已灭菌的9 cm 培养皿中,叶片正面紧贴培养皿,背面朝上,每皿放1~3 片病斑叶。用切好的马铃薯片压紧叶片,置于18 ℃光周期培养箱高湿黑暗培养3~6 d。待薯片长出白色的霉层后,挑取少量菌丝于选择性培养基上,18 ℃培养箱高湿黑暗培养,菌落形成后转到黑麦番茄培养基上进一步的纯化并保存备用。
1.2.3 交配型的测定 采用国立耕等[13]的皿内对峙法测定各菌株的交配型。将直径为5 mm 待测菌株分别在黑麦番茄培养基上进行单独培养和与标准菌株对峙培养,2 菌饼间距2.0 cm,置于18 ℃培养箱黑暗培养14 d 左右,在显微镜下观察卵孢子的产生。与A1 标准菌株对峙培养后产生卵孢子,且与A2 标准菌株对峙培养不产生卵孢子的菌株称为A2 交配型菌株,反之则为A1 交配型菌株,不需要对峙培养单独培养就能产生卵孢子的菌株为自育型(SF)菌株。交配型A1、A2 标准菌株由西北农林科技大学单卫星教授提供。
2 结果与分析
2016—2020 年采集分离的马铃薯晚疫病致病疫霉菌交配型测定结果见表1~5。

表1 2016 年马铃薯晚疫病菌交配型组成与分布
总的来看,A1、A2 交配型共存的地区有甘肃的定西市安定区(2016年)、张掖市民乐县(2017年)、定西市渭源县(2018、2020 年)、定西市通渭县(2020 年)、兰州市榆中县(2018 年)和青海省西宁市大通县(2016 年),但甘肃省张掖市民乐县(2018 年)和青海省西宁市大通县(2019、2020 年)的菌株均仅为A1 交配型;甘肃省金昌市永昌县(2017、2019 年)和甘肃省张掖市民乐县(2018年)采集分离的菌株均为A1 交配型;宁夏固原市隆德县(2017 年)、宁夏固原市西吉县(2018 年)采集分离的菌株均为A2 交配型;甘肃省其余马铃薯产区其他年份采集分离的菌株均为A2 交配型。
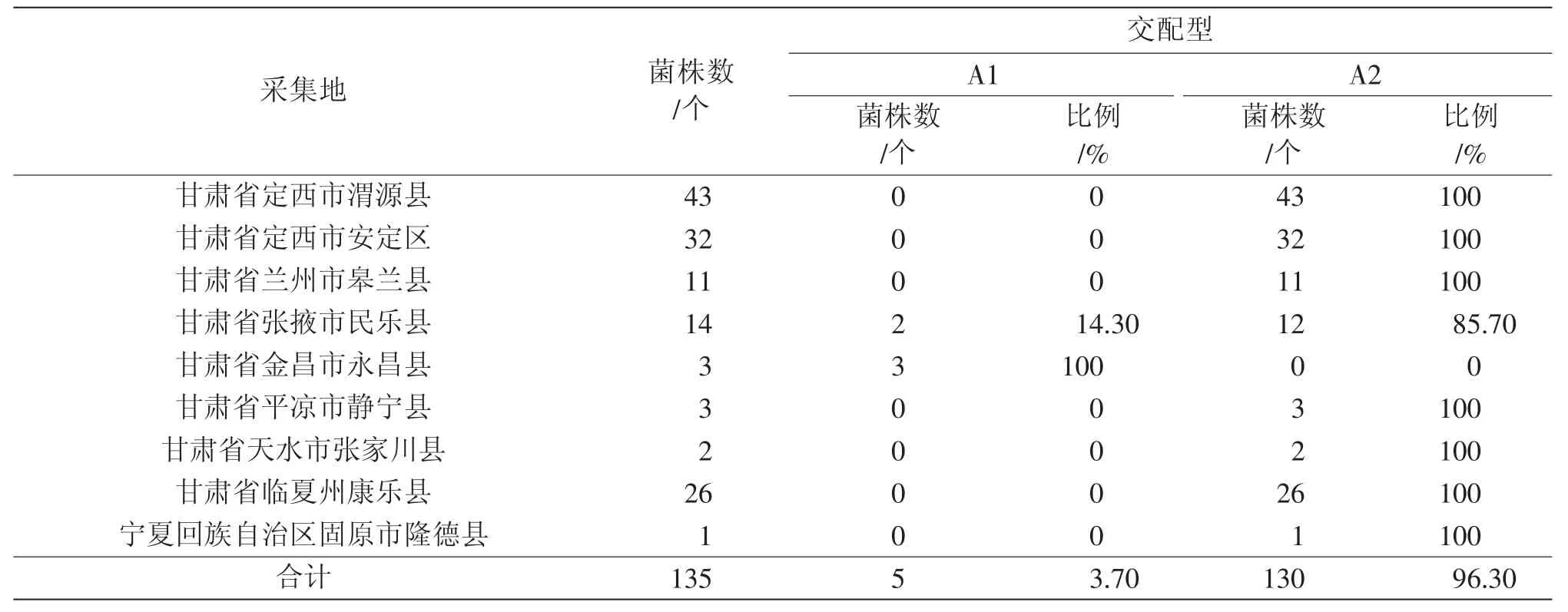
表2 2017 年马铃薯晚疫病菌交配型组成与分布
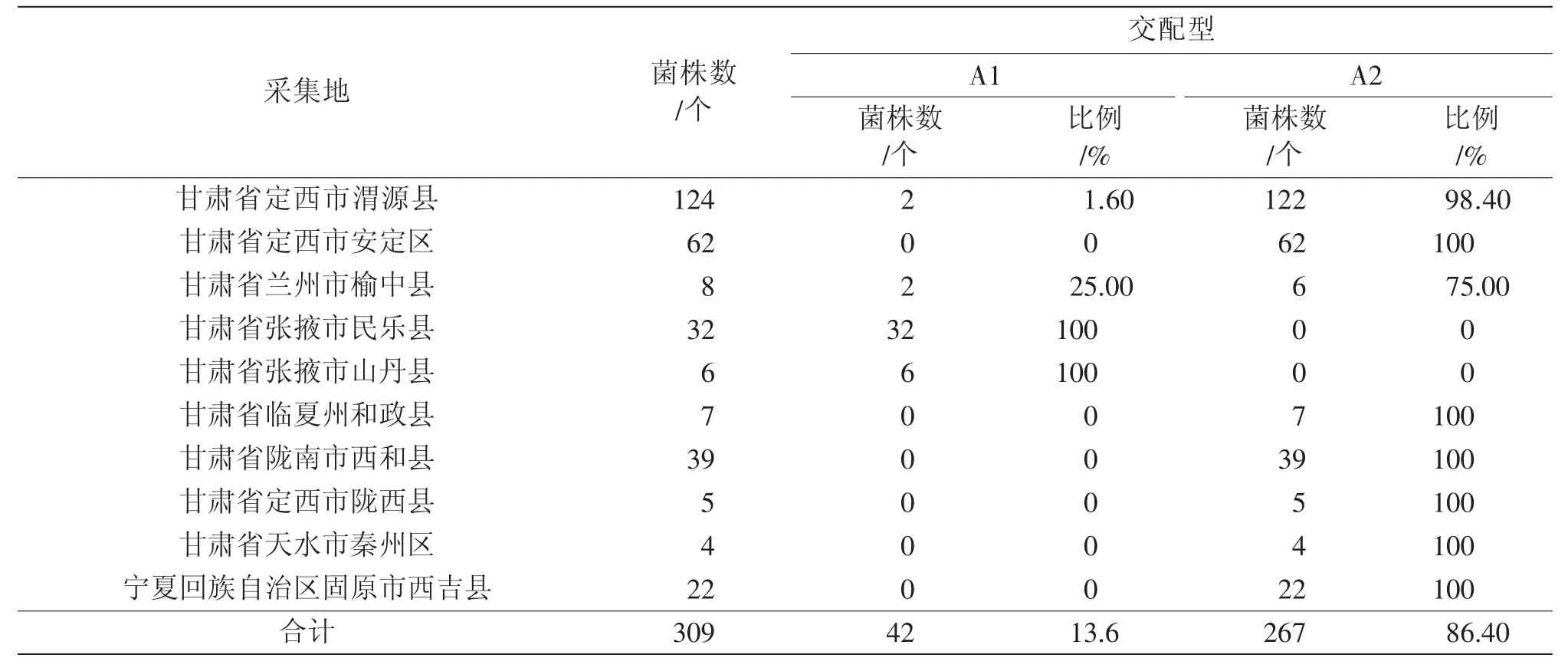
表3 2018 年马铃薯晚疫病菌交配型组成与分布
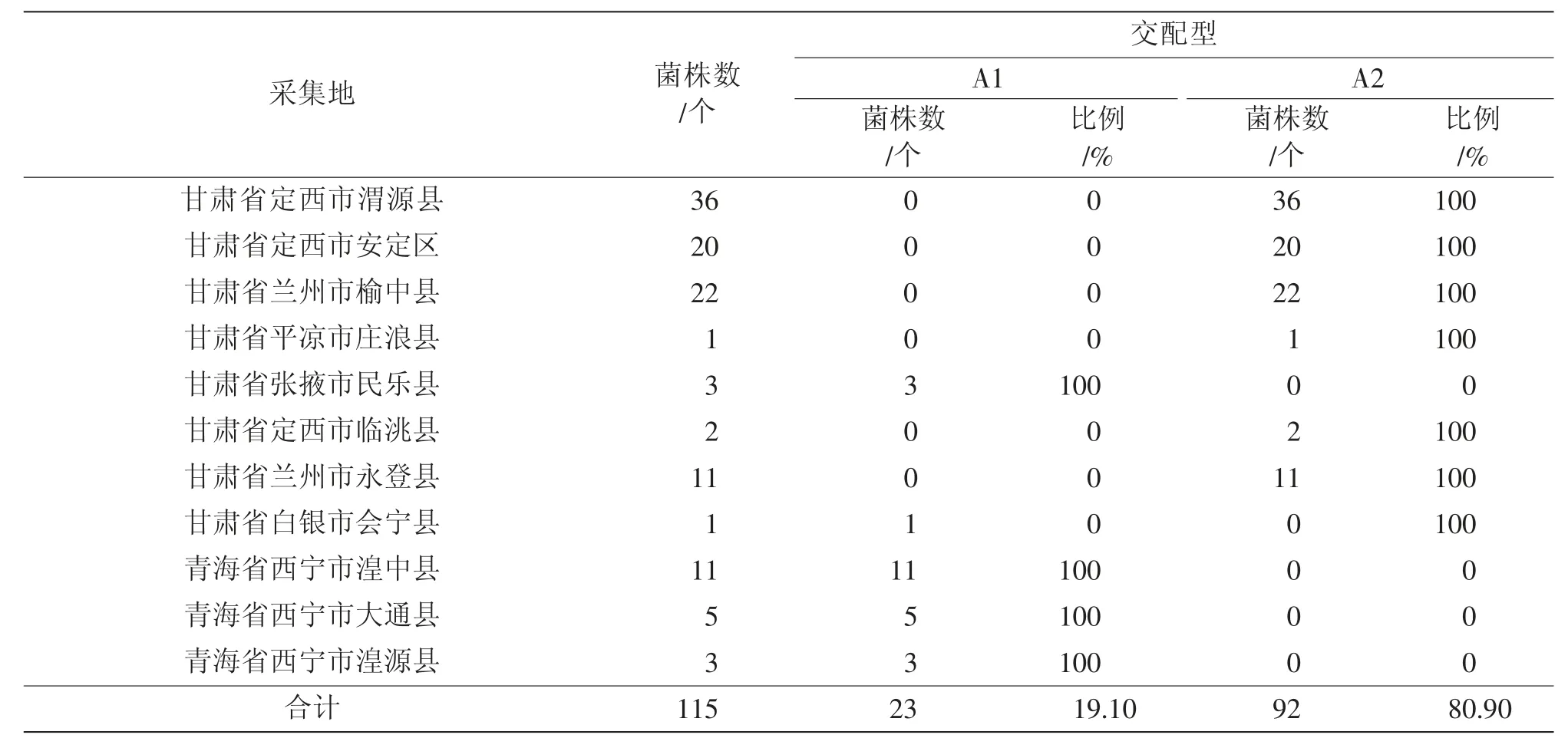
表4 2019 年马铃薯致病疫霉交配型组成与分布

表5 2020 年马铃薯致病疫霉交配型组成与分布
2016—2020 年菌株中只检测到了A1 交配型,A2 交配型,未检测到A1A2 交配型和SF(自育型),A2 交配型菌株占主导地位,A2 交配型的菌株为优势菌株,比例高达88.9%。A2 交配型菌株所占比例先升后降再升,2017 年为96.3%,随后下降,2018 年、2019 年A2 交配型菌株分别为86.4%、80.9%,随后又上升,2020 年A2 交配型菌株为96.5%;A1 交配型菌株所占比例先降后升再降,2019 年最高达到了19.1%,2017、2020 年分别达到3.7%和3.5%。
3 小结与讨论
对2016—2020 年甘肃、青海、宁夏等3 省(自治区)马铃薯晚疫病菌共694 株菌株的交配型监测,结果显示,5 年间A2 交配型菌株均为优势菌株,A2 交配型菌株占比呈先升后降再升趋势。其中青海监测区域的马铃薯晚疫病菌株交配型均为A1,这与叶广继[14]监测的青海2006—2007 年马铃薯晚疫病菌株交配型为A1 的结果一致。宁夏和甘肃康乐、和政、漳县和天水的马铃薯晚疫病菌株交配型均为A2,王喜刚等[15]对宁夏2018—2019 年马铃薯主产区晚疫病菌交配型监测结果为有A1、A2、SF(自育型)3 种类型,A2 交配型菌株为优势菌株;我们于2007—2012 年监测到甘肃康乐县、和政县的马铃薯晚疫病菌株交配型有A1A2类型,甘肃天水市、漳县的马铃薯晚疫病菌株交配型有SF(自育型)[16],这与本次研究有差异,其原因可能与菌株的采集范围和数量有限以及年际间交配型的变化有关。
2016—2020 年采集的菌株中,A2 交配型为优势菌株,占各年所测菌株的比例分别为86.4%、96.3%、86.4%、80.9%、96.5%,其所占比例呈先升后降再升的趋势。张大为等[16]2007—2012 年研究结果也表明,A1 交配型在许多马铃薯产区已逐渐被毒性更强的A2 交配型取代,意味着晚疫病菌的变异速度会大大加快,各地区间的种薯贸易加快了A2 交配型传播与流行。A1、A2 交配型共存的地区(甘肃的定西安定区、民乐、渭源、通渭、榆中和青海的大通),有性生殖就有可能发生。有性生殖不仅会产生具厚壁抗逆性强的卵孢子作为初侵染源,还提供了遗传重组的机会,导致出现致病力更强的生理小种[17],因此马铃薯晚疫病的防治和抗病育种将迎来更大的挑战。王腾等[18]认为在几年内会出现A2 交配型频率急剧下降甚至消失的状况,之后A2 交配型的频率则鲜有升高。A2交配型先升后降的现象在欧洲多个国家同样存在,这种现象发生的原因尚不明确,推测可能是由于气候变化导致[19]。因此,马铃薯晚疫病菌交配型的监测研究工作仍需继续,各交配型出现频率变化的原因也需进一步研究。
