核黄素磷酸钠光敏化抗人脉络膜黑色素瘤MUM-2B细胞的研究
2022-08-19李娟,李宁
李 娟, 李 宁
(蚌埠医学院 第一附属医院,安徽 蚌埠 233000)
脉络膜黑色素瘤是一种恶性程度很高、高致死率、发病机制复杂的原发性眼部恶性肿瘤,已经成为眼科研究的热点课题[1]。虽然早期脉络膜黑色素瘤患者可选择的治疗方案很多,一般可达到良好的局部肿瘤控制,但是对于晚期转移病例或者早期治疗后复发病例对细胞毒性和免疫治疗反应较差,因此,探寻安全有效的治疗技术是近年来眼科肿瘤领域科学家们研究的热点[2-4]。光动力疗法(Photodynamic therapy,PDT)以其毒性小、疗效快、靶向性强,以及利用药物在正常组织和肿瘤组织中富集、流失的时间差进行光照,能在杀伤肿瘤细胞的同时不危及正常组织等优点,已经成为继化疗和放疗之后,用于癌症治疗的理想疗法之一[5-6]。PDT包含3种基本的组成部分:光敏剂、光和氧气。光敏剂的选择对生物安全性具有较高的要求,目前也只有少数几个被批准应用于临床,即使进入临床使用的光敏剂,仍然面临着光敏剂本身毒副作用高的缺陷,因此寻找天然来源的、安全性高的、具有营养价值的光敏剂对于光动力学治疗的突破具有重大的研究价值[7-8]。
核黄素,即维生素B2是维持生命所必需的一种水溶性维生素,核黄素被证实也是一种有效的光敏剂,以核黄素为光敏剂的光动力效应在肿瘤、皮肤病、病虫害、眼科抗菌等领域均有大量应用和研究[9]。但是核黄素水溶性差,限制其应用。核黄素磷酸钠(Riboflavin-5-phosphate Sodium,RFP)是维生素B2的磷酸化形式,其比核黄素的稳定性更高,水溶性更好,更利于吸收利用,生物效价更高,具有更广泛的用途,可以作为医药、食品添加剂、饲料添加剂等使用[10]。有研究表明RFP也可作为光敏剂使用[11]。鉴于RFP在生物安全性方面的优势,本研究首次考察RFP光敏化对人脉络膜黑色素瘤MUM-2B细胞的影响,并探讨相关机制,不仅为人脉络膜黑色素瘤的治疗提供了新的可能,也为RFP的“老药新用”提供新的思路。
1 材料与方法
1.1 供试材料
人脉络膜黑色素瘤细胞(ATCC,American Type Culture Collection)。细胞培养基(含10%胎牛血清和双抗的DMEM溶液,培养箱条件为5% CO2,温度37 ℃)。RFP(AR,生工生物工程股份有限公司);MTT、DMSO(AR,上海阿拉丁生化科技股份有限公司);Annexin V-FITC细胞凋亡检测试剂盒,活性氧检测试剂盒,线粒体膜电位检测试剂盒(JC-1),细胞周期与细胞凋亡检测试剂盒,胰酶,PBS(上海碧云天生物技术有限公司);DMEM高糖培养基,胎牛血清(美国Gibco)。
1.2 仪器与设备
流式细胞仪(美国ACEA);Multiskan GO型多功能酶标仪(美国Thermo Scientific);3111型二氧化碳培养箱;1300 SERIES A2型生物安全柜(美国Thermo Fisher Scientific);UV-2700型紫外分光光度计(日本岛津);Axio Imager A2光学显微镜(德国Zeiss)。
1.3 实验方法
采用MTT方法考察RFP光敏化对MUM-2B细胞的抑制作用,并利用流式细胞仪从细胞凋亡坏死、线粒体膜电位、周期阻滞3个方面分析RFP光敏化抑制MUM-2B细胞的机制。本实验稳态辐照装置自行搭建,30 W的LED灯板购自徐州爱佳电子科技有限公司,灯板尺寸14 cm×20 cm,光通量1.8 J/cm2,每个样品辐照度1±0.2 mW/cm2,波长范围450~470 nm。在实际辐照时,灯板与孔板之间的垂直距离为25 cm。
1.4 测定项目及分析方法
1.4.1 MTT实验 通过MTT实验分析RFP光动力学作用对MUM-2B的毒性作用。首先制备MUM-2B细胞悬液,铺板于96孔板,每孔细胞密度约为8 000个。在培养箱培养12 h,细胞贴壁,然后对细胞进行加药处理,根据设置的不同加入不同浓度的RFP溶液,继续培养4 h,进行光照处理,光照采用中心波长460 nm、功率为30 W的LED灯板,辐照时间为30 min,避光组采用锡箔纸遮挡。辐照结束后,细胞继续培养24或者48 h,在设定时间结束后,每孔加入50 μL 1 mg/mL MTT溶液,放入培养箱继续培养4 h,取出,弃上清,每孔加入150 μL DMSO溶液,振荡30 min,在540 nm测定吸光度。
1.4.2 细胞吞噬实验 MUM-2B细胞对RFP的吞噬实验采用流式细胞仪进行,利用RFP本身的荧光。制备细胞悬液后,将细胞以每孔约15 000个细胞铺板于6孔板,培养12 h,待细胞贴壁,在不同时间段对细胞进行加药处理(采用时间倒序,使得细胞与药物的接触时间分别为0、1、2、4、6、8 h),每孔加入1.5 mL 1 μg/mL的药物。使用PBS清洗细胞3次,洗去没有被吞噬的药物,然后每孔加入0.5 mL胰酶消化液消化2 min,消化结束后,每孔加入0.5 mL完全培养基终止消化,收集细胞,2 000 r/min离心3 min,PBS洗涤1次,细胞沉淀重悬于1 mL的PBS,进行流式细胞仪分析。
1.4.3 细胞凋亡坏死分析 采用Annexin V-FIT凋亡分析试剂盒,利用流式细胞仪分析RFP光敏化诱导MUM-2B细胞死亡的机制。将制备好的细胞悬液以每孔约15 000个细胞铺板于6孔板中,培养12 h,加药(1.5 mL/well, 0.2 μg/mL),继续培养4 h,进行辐照处理,光照采用中心波长460 nm、功率为30 W的LED灯板,辐照时间为30 min,避光组采用锡箔纸遮挡。辐照处理完毕,继续培养24 h,去除上清,细胞使用PBS洗涤2次,按照试剂盒使用说明,对细胞进行Annexin V和PI双染,使用流式细胞仪进行分析。
1.4.4 细胞线粒体膜电位分析 采用线粒体膜电位检测试剂盒(JC-1),利用流式细胞仪分析RFP光敏化对MUM-2B细胞线粒体膜电位的影响。将制备好的细胞悬液以每孔约15 000个细胞铺板于6孔板中,培养12 h,加药(1.5 mL/well, 0.2 μg/mL),继续培养4 h,进行辐照处理,光照采用中心波长在460 nm功率为30 W的LED灯板,辐照时间为30 min,避光组采用锡箔纸遮挡。辐照处理完毕后,继续培养0或者24 h,去除上清,加入胰酶,消化收集细胞,PBS洗涤2次,按照试剂盒处理进行JC-1染色,使用流式细胞仪进行分析。
1.4.5 细胞周期阻滞分析 采用细胞周期与细胞凋亡检测试剂盒,利用流式细胞仪分析RFP光敏化对MUM-2B细胞周期分布的影响。将制备好的细胞悬液以每孔约15 000个细胞铺板于6孔板中,培养12 h加药(1.5 mL/well, 0.2 μg/mL),继续培养4 h后,进行辐照处理,光照采用中心波长在460 nm、功率为30 W的LED灯板,辐照时间为30 min,避光组采用锡箔纸遮挡。辐照处理完毕后继续培养24 h,去除上清,加入胰酶,消化收集细胞,PBS洗涤2次,按照试剂盒处理,使用流式细胞仪进行分析。
2 结果与分析
2.1 RFP辐照光源波段选择
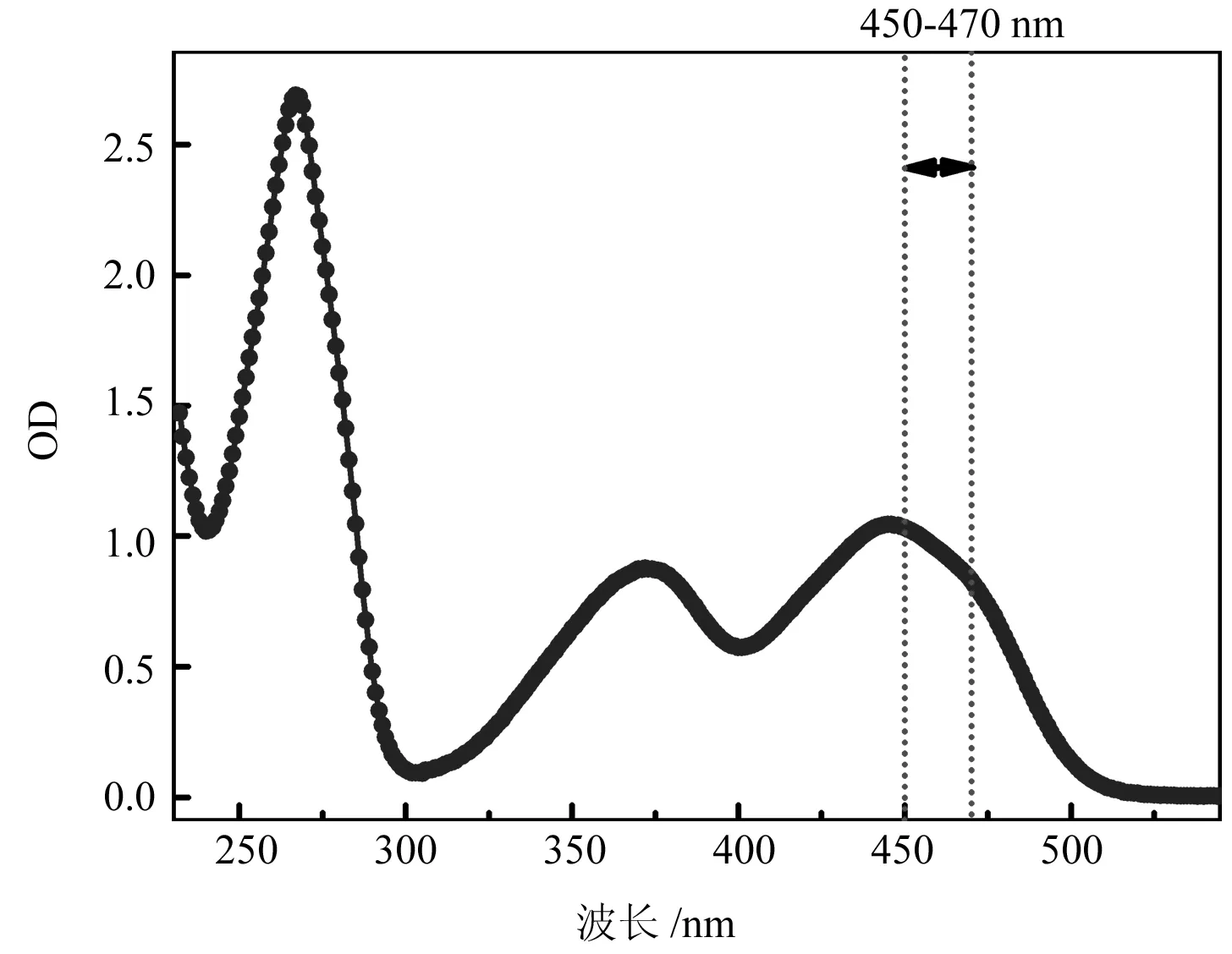
光敏剂在吸收光作用下会发生光激发反应,生成相应的激发态,因此选取RFP辐照光源时要考虑到光源能够有效被RFP吸收,但是短波长的光对细胞毒性较大,因此要尽可能选择长波段的光源。由图1所示,RFP在小于300 nm的紫外光区具有较强吸收,但是该波段光源对细胞毒性大,所以考虑选取RSP在可见光光区的吸收波段,采用中心波长在460 nm、波长范围在450~470 nm的LED光源作为RFP激发光源。
2.2 MUM-2B细胞增殖对RFP吞噬的依赖性考察
光敏剂能够被细胞吞噬是光敏剂光动力学效应作用细胞的前提,因此首先采用流式细胞仪利用RFP自身荧光考察MUM-2B细胞对RFP的吞噬过程。如图2所示,当细胞与RFP孵育时间在4 h之内时,细胞对RFP的吞噬随着孵育时间延长而增大,但是超过4 h,随着孵育时间增加,细胞对RFP的吞噬没有明显增加,说明药物与细胞孵育4 h时细胞对药物吞噬已接近饱和状态,因此后续光照实验均是在药物与细胞孵育4 h后进行光照处理。
2.3 RFP光敏化对MUM-2B细胞增殖的影响
如图3所示,在没有光照的情况下,单独的RFP对MUM-2B细胞的生长和增殖影响较小,即使在最大浓度时,细胞存活率均在85%以上,当加药后再施加光照,细胞的存活率显著降低。从加药浓度为0时光照组的细胞存活率可以看出,细胞存活率在98%以上,说明光源单独辐照对细胞的存活率没有影响。由此可以推测只有辐照光源与RFP联合作用时才能够显著降低MUM-2B细胞的存活率。即RFP吸收辐照光之后发生光敏化,通过光动力效应抑制了MUM-2B细胞生长与增殖。
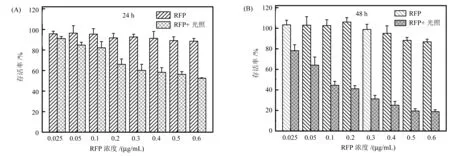
图3 MTT分析RFP光敏化对MUM-2B细胞存活率的影响
2.4 RFP光敏化对MUM-2B细胞凋亡坏死的影响
MTT实验结果表明,RFP的光动力学作用能够有效抑制MUM-2B细胞的增殖,随后探讨MUM-2B细胞的死亡机制。如图4所示,与对照组相比,单独的光照或者单独的RFP作用对MUM-2B细胞的凋亡和坏死比例影响不大,这进一步说明本实验采用的光照条件对细胞没有毒性。然而当RFP和光照联合作用时,相比于其他组,凋亡细胞的比例增加10倍以上。由此得出,RFP光敏化是通过有效诱导细胞凋亡来抑制MUM-2B生长与增殖。
2.5 RFP光敏化对MUM-2B细胞线粒体膜电位的影响
为了深入验证RFP光敏化抗MUM-2B的机制,采用JC-1探针检测MUM-2B细胞线粒体膜电位的变化,当线粒体膜电位降低时,JC-1探针的荧光将会由红色向绿色转变[12-13]。如图5A、5B、5C所示,与对照组相比,单独光照或者单独药物作用细胞,均会引起线粒体膜电位下降,但是幅度并不大。当RFP与光照联合作用时,细胞线粒体膜电位显著下降,与对照组相比,绿色荧光比例由4.71%上升到35.75%。这说明RFP光敏化能够有效降低MUM-2B细胞的线粒体膜电位。
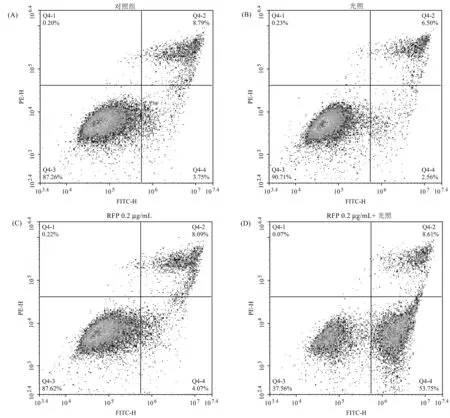
图4 RFP光敏化对细胞凋亡与坏死的影响
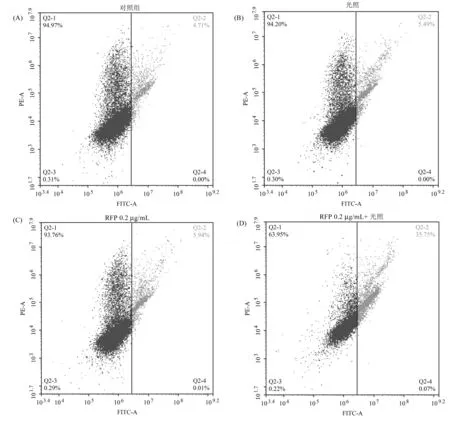
图5 RFP光敏化对MUM-2B细胞线粒体膜电位的影响
2.6 RFP光敏化对MUM-2B细胞周期阻滞的影响
RFP光敏化对MUM-2B细胞周期分布的影响如图6所示,与对照组相比,单独的光照处理和单独药物处理几乎不影响MUM-2B细胞的周期分布,当RFP与光照联合作用后,S和G2期细胞比例明显升高,而处于G1期的细胞比例减小。这些结果表明RFP光敏化造成了MUM-2B细胞诱发了S和G2期阻滞。
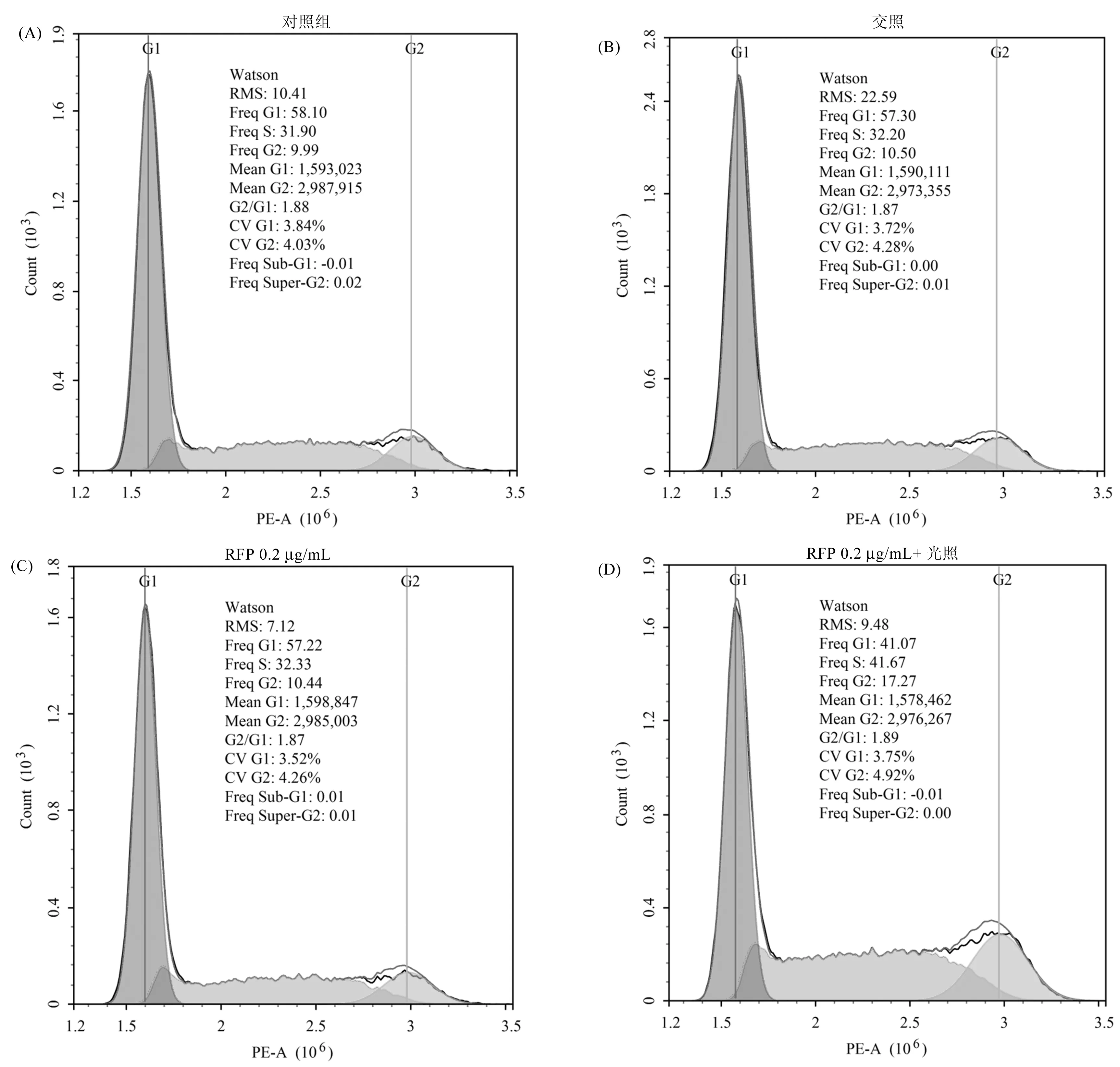
图6 RFP光敏化对MUM-2B细胞周期分布的影响
3 结论与讨论
PDT以其毒性小、疗效快、靶向性强等优势已经成为继化疗和放疗之后用于癌症治疗的理想疗法之一[5-6]。PDT由光敏剂、光和氧气组成,这3种因素单独作用时没有毒性,但是当3者联合作用时将会发生光化学反应,引发高度活性产物ROS的产生[14-15]。由细胞水平实验表明,单独的光照和RFP本身对细胞没有显著毒性,说明RFP作为光敏剂具有安全性高、毒性小的优势。但RFP与光源联合作用时,RFP发生光敏化产生光动力效应能够有效抑制MUN-2B细胞的生长,可通过控制光源辐照来精准实施抗肿瘤,达到靶向操作的目的。因此,RFP理论上能够作为光敏剂应用于脉络膜黑色素瘤细胞的光动力治疗。
PDT对肿瘤细胞的直接破坏主要源于对重要的亚细胞靶点的不可逆光损伤。在细胞水平,PDT一般能够激活三种主要的细胞死亡通路:凋亡、坏死和自噬相关的细胞死亡。细胞凋亡是PDT作用下癌细胞的最主要的死亡途径[15-18]。MUM-2B死亡途径显示出RFP光动力作用能够有效诱导MUM-2B细胞凋亡和坏死,其中对MUM-2B细胞的凋亡诱导作用最为显著,这是由于RFP光敏化主要通过诱导MUM-2B细胞凋亡,从而实现抗癌作用。线粒体在细胞凋亡的进程中扮演重要的角色。一般认为,线粒体膜电位的降低是细胞凋亡的早期标志事件[19-20],从RFP光敏化对MUM-2B细胞线粒体膜电位的影响中可以发现,RFP光敏化能够显著降低MUM-2B细胞线粒体膜电位,由此推测RFP光敏化可能破坏了线粒体膜,线粒体膜受到损伤而崩解,可能会释放与细胞凋亡相关的细胞信号分子,进而启动细胞凋亡途径。
PDT的主要效应物质就是ROS,多项研究表明,相比于其他细胞器,细胞核对ROS的进攻和破坏更加的敏感,ROS能够对DNA直接造成氧化损伤,当DNA损伤积累到一定程度,细胞本身的DNA修复系统无法完成修复时,细胞便会启动死亡机制[21-23]。结果表明,RFP光敏化能够引起MUM-2B细胞在S期和G2期阻滞,而S期和G2期是DNA合成和DNA损伤检验点关键调控期,负责阻止DNA受损的细胞进入有丝分裂期(M期)[24-25]。虽然没有直接观察到DNA的损伤情况,但是从MUM-2B细胞在S期和G2期的阻滞结果分析,进而推断RFP光敏化产生的ROS很有可能对附近的DNA造成严重损伤,以至于DNA修复系统无法修复,细胞无法通过G2/M期DNA损伤检验点,无法进入分裂期,最终诱导细胞启动凋亡信号途径。