TIPIN:肝癌预后生物标志物
2022-08-19李姝婧刘怀峰王香港王清晴陈玉欣石兵兵谭静文王媛媛
李姝婧, 刘怀峰, 王香港, 王清晴, 陈玉欣, 石兵兵, 谭静文, 王媛媛
(蚌埠医学院 生命科学学院,安徽 蚌埠 233030)
原发性肝癌是一种高度恶性的肿瘤,在世界范围内,肝癌居男性恶性肿瘤第7位,居女性第9位,在我国肿瘤发病率排名前3位。由于肝癌早期症状和临床体征不显著,其发病具有隐匿性并且病程进展快速,造成大多数患者在确诊时已是晚期,所以预后效果差,且患者生存率低[1-2]。因此,提高早期诊断率、开展肝癌早期诊断和治疗的关键分子机制的研究,对于降低肝癌死亡率和提高患者的预后水平具有重要意义。
基因组的稳定性直接关联到细胞是否发生癌变,其中DNA复制是最容易发生变化的过程,也是最容易致癌的过程。任何导致DNA损伤高水平发生的条件也都会引发复制应激(Replication Stress),这是基因组不稳定的来源之一,也是癌变前细胞和癌变细胞的一大标志[3-4]。参与DNA复制稳定性的因素是癌症治疗的潜在靶点。Timeless(TIM)及其伙伴TIM互作蛋白(TIM-interacting protein,TIPIN)是复制叉保护复合物(RFC)的组成成员,并参与正常DNA复制过程来维持基因组稳定性[5-6]。TIM-TIPIN在协调复制解旋酶和聚合酶以调节单链DNA(ssDNA)聚合方面起着重要作用[7]。然而,关于TIPIN与肿瘤的联系有限,通过生物信息学方法研究TIPIN在肝癌中的表达及其临床病理特征和预后价值,初步揭示TIPIN潜在的分子作用机制,有望为临床上肝癌的早期诊断和治疗提供依据和关键技术支持。
1 材料和方法
1.1 原始资料收集
进入TCGA的repository界面(https://portal.gdc.cancer.gov/repository)中,先在Cases中选项栏中进行选择,其中Primary Site选项中选择liver and intrahepatic bile ducts,在Project选项中选择TCGA-LIHC。随后在file的选项栏中再进行选择,在Data Category中选择transcriptome profiling, Data Type中选择Gene Expression Quantification,Experimental Strategy中选择RNA-seq,Workflow Type中选择HTSeq-FPKM。将查找符合条件的所有数据全部加入cart中,进行数据的下载。
1.2 TIPIN基因表达分析
利用Rstudio软件中limma和beeswarm包对TCGA中LIHC数据进行归一化处理,提取肿瘤组和正常组的TIPIN基因的表达量并绘图。对424例病人样本进行筛选分析,将来自相同患者的癌常组与肿瘤组样本进行配对(共50对),并对TIPIN基因的表达量进行提取,通过Rstudio软件绘制配对图。
1.3 生存分析
采用Rstudio中survival包对376例TCGA-LIHC患者的TIPIN基因表达和总生存率(OS)进行生存分析(去除无生存时间的病例1例)。利用Kaplan Meier网站(Http://kmplot.com/analysis)对TIPIN基因进行生存曲线分析的验证。在KM-plotter主界面选择mRNA(RNA-seq)中的Start KM Plotter for liver cancer,填入需要检索的基因名,其它选项选取默认值。
1.4 临床相关性分析
将得到的377例肝癌患者的临床信息进行整理,根据患者的年龄、性别、分级、TNM分期、浸润深度、淋巴结转移和远处转移等临床病理特征,去除临床信息不完整的患者数据,最后,获得235例患者,利用Rstudio软件的survminer和survival包进行COX分析,以评估临床特征与基因的联合作用。
1.5 ROC曲线分析
使用ROC曲线来测定临床的诊断价值,通过结合病人生存时间并按基因表达量的中位数进行高、低风险划分,使用Rstudio软件中的survival ROC包进行ROC曲线分析,并获得曲线下面积(AUC)。
1.6 基因集富集分析(GSEA)
根据TIPIN基因mRNA表达量的中位数将TCGA-LIHC数据分为高表达组和低表达组。GSEA检测2组中排名靠前的基因富集的通路。对于每个分析,基因集排列的数量被设置为1 000。用标称(NOM)P值、假发现率(FDR)来识别每种表型的富集途径,NOM p-value<0.05和FDR q-value<0.25的基因集被认为是重要的。
1.7 共表达分析
利用cBioportal 数据库 (Https://www.cbioportal.org) 对TIPIN的共表达基因进行鉴定,以筛选与TIPIN相互作用的蛋白,选择与TIPIN显著相关的前10个基因进行进一步分析。并在TCGA数据库中验证它们与TIPIN的相关性,利用Rstudio软件对TCGA数据库中的LIHC数据进行FANCI基因的表达量以及生存分析的检测。
1.8 统计分析
使用Rstudio软件进行统计检验。使用t检验比较2组之间统计学意义。使用Schoenfeld个体检验来评估COX回归模型拟合的比例风险假设。使用单变量和多变量COX比例风险模型进行生存期生存分析,将其分为最优截断值,该截断值由R包 survminer的survc-utpoint函数生成,将表达水平二分。P<0.05被认为具有统计学意义。
2 结果与分析
2.1 TIPIN基因的生存分析
为了研究TIPIN的预后价值,通过结合TCGA中肝癌患者(N=377)的临床数据并去除无生存时间的患者,绘制TIPIN基因的生存曲线图。结果显示,TIPIN低表达的患者生存率较高,而高表达患者生存率显著降低,P值为0.001(图1A)。随后利用Kaplan Meier在线数据库对TIPIN基因的生存分析进行验证,与之前的结果一致,肝癌患者TIPIN基因的高表达不利于病人的生存,且P值为0.000 15(图1B)。生存分析表明,TIPIN可以作为判断肝癌患者病情进展和预后的指标。
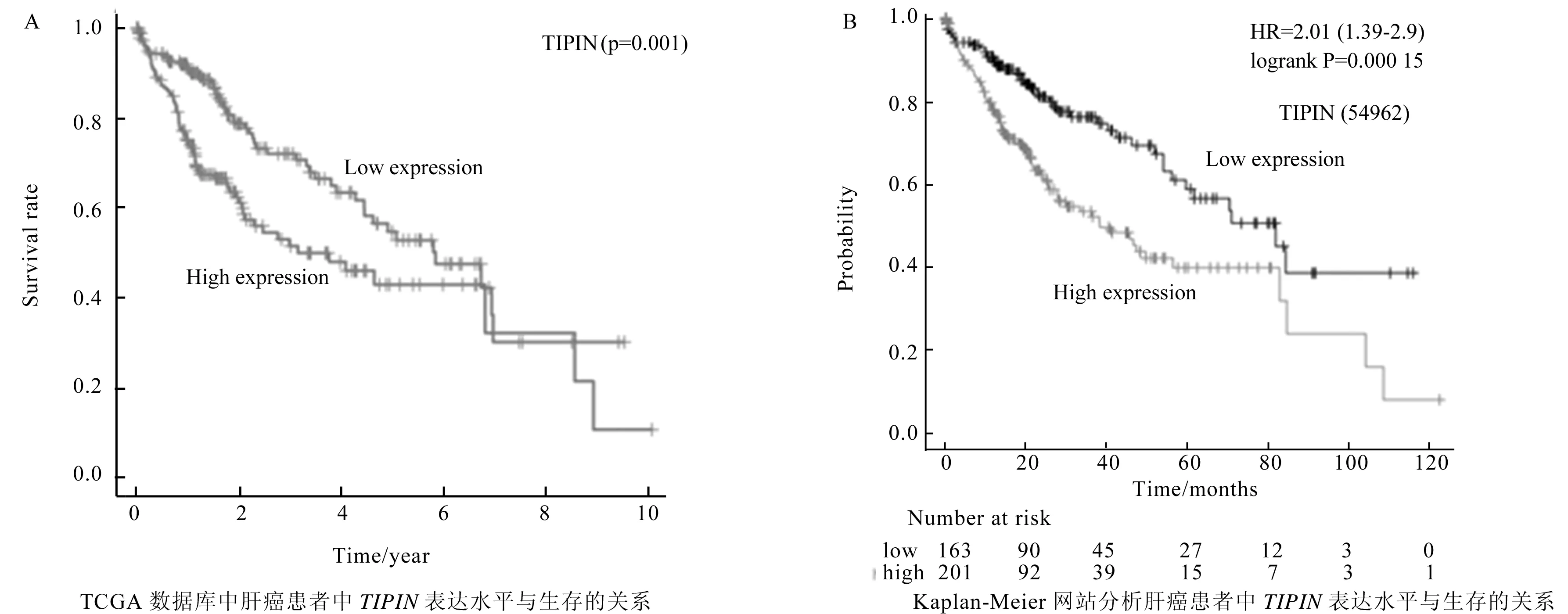
图1 TIPIN基因的生存分析
2.2 TIPIN基因在肝癌组织中高表达
将TCGA中LIHC数据的424例病人样本进行归一化处理,发现在肝癌中TIPIN的mRNA表达量显著高于正常肝组织(图2A)。进一步对病人样本进行整理,将来自相同患者的50对癌常组样本与肿瘤组样本进行配对分析,发现肿瘤组TIPIN的表达量明显上调(图2B)。此外,除了在肝癌组织中,TIPIN基因在乳腺癌(BRCA)、胆管癌(CHOL)、弥漫性大B细胞淋巴瘤(DLBC)和脑胶质瘤(GBM)等癌组织中也是显著高表达(图2C)。以上结果表明,TIPIN基因与癌症的发生发展密切相关。
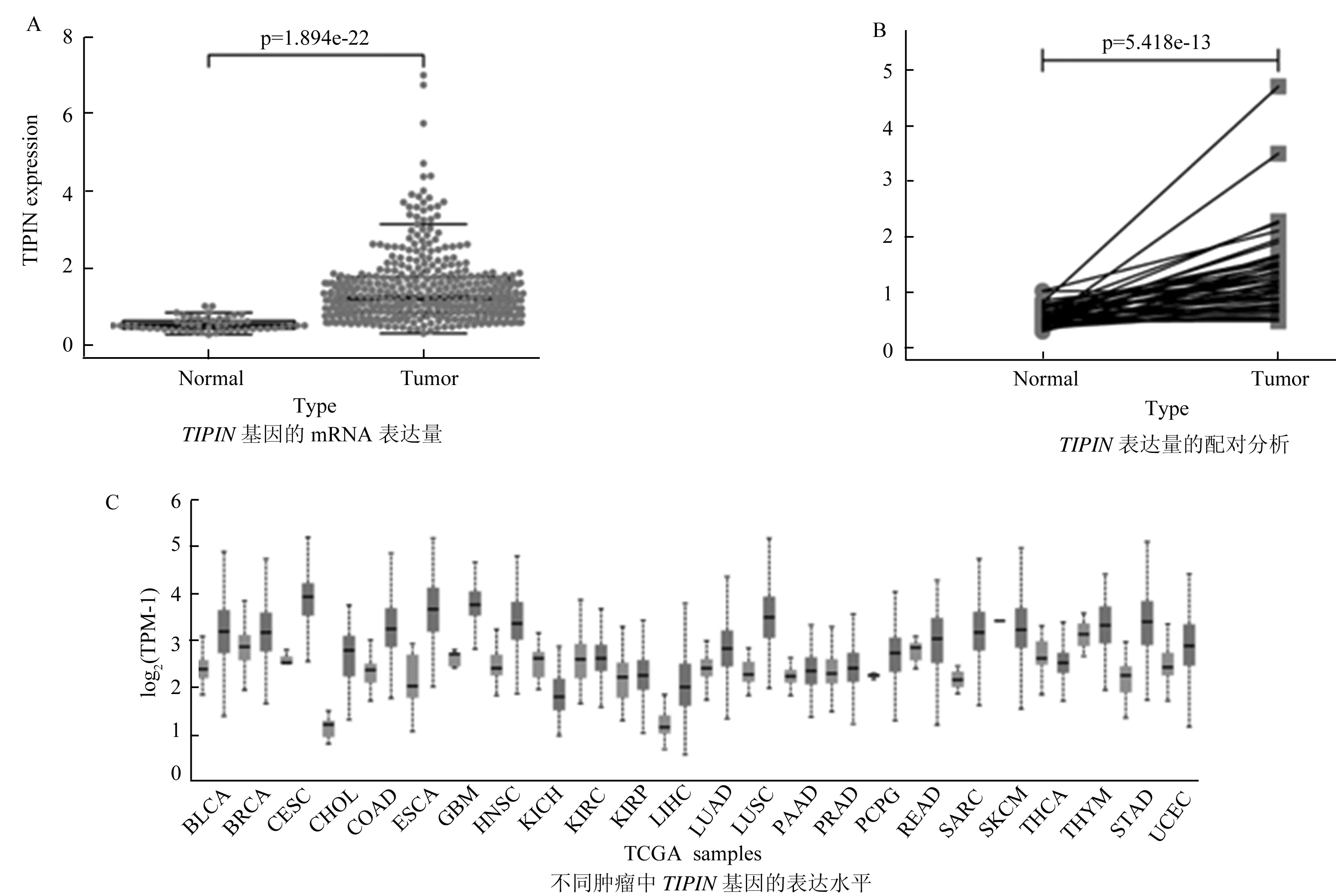
图2 TIPIN基因在癌组织中的表达水平
2.3 TIPIN基因的临床相关性分析
为了进一步验证TIPIN的临床相关性,基于TCGA数据库中肝癌患者的临床数据,使用单因素COX进行分析,研究TIPIN的表达与肝癌患者年龄、性别、分级、TIPIN分期、浸润深度、淋巴结转移和远处转移等临床病例特征的关系。我们发现TIPIN的表达量与临床分期显著相关(图3A),随着临床分期增加总体呈现上升趋势(Ⅳ期可能由于病人样本数少)。单因素COX分析结果显示,TIPIN基因在肝癌患者中是一个高危因素(HR为1.39;95%CI为1.14~1.69),除此之外,原发肿瘤T (HR为1.80;95% CI为1.43~2.27)、肿瘤的远处转移M (HR为3.85;95%CI为1.21~12.28)和分期stage (HR为1.86;95% CI为1.46~2.39也都是高危因素(表1)。随后为了进一步探讨TIPIN基因在肝癌中的作用,我们进行了多因素COX分析,分析结果表明,TIPIN(HR为1.33;95% CI为1.08~1.65;P=0.008)仍与总生存期独立相关(图3B和表1),TIPIN基因可以作为肝癌患者的独立预后因素。
2.4 TIPIN基因的ROC曲线分析
为了进一步验证TIPIN基因在肝癌中的临床诊断价值,对TCGA数据库中肝癌患者的临床数据进行了整理,通过结合病人生存时间并按基因表达量的中位数进行高低风险划分,随后利用Rstudio软件进行ROC曲线绘图。结果表明,TIPIN基因3年的ROC曲线下面积AUC值为0.622(图4),具有一定的临床诊断价值。
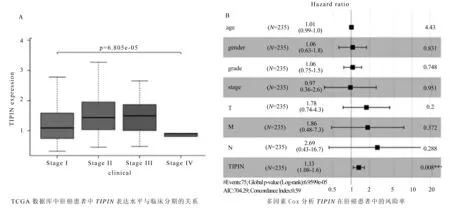
图3 TIPIN基因的临床相关性

表1 肝癌患者预后因素COX回归模型分析(TIPIN)
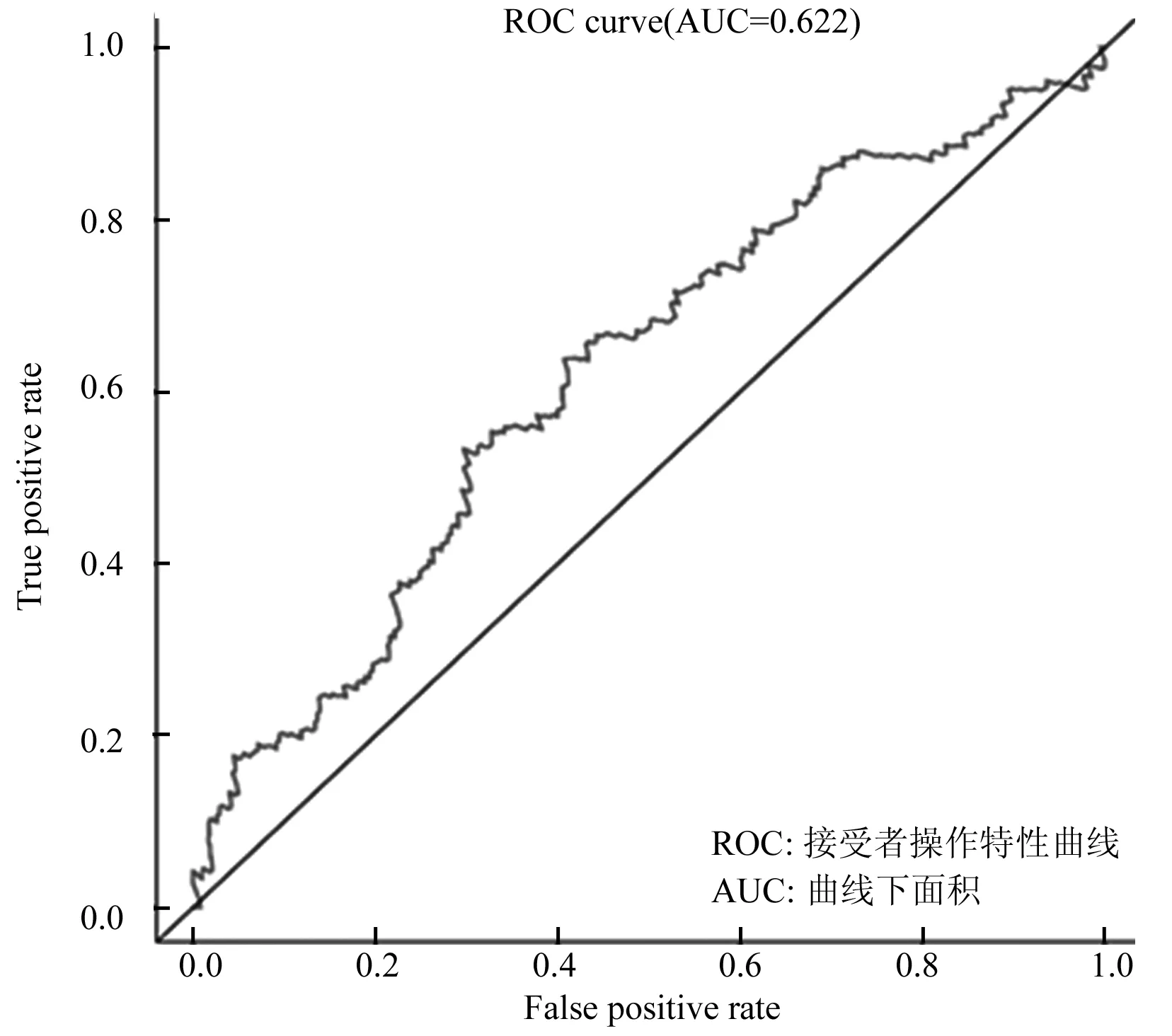
图4 TIPIN基因的ROC曲线风险评分
2.5 TIPIN基因的GSEA分析
为了研究TIPIN基因在肝癌发生中的潜在分子功能,对TIPIN低表达和高表达的样本进行GSEA分析,以预测TIPIN相关的信号通路。富集结果分析显示,178条信号通路中有145条上调,其中72条信号通路在NOMP<0.05和FDR<0.25条件下显著富集。TIPIN高表达样本中,多种肿瘤相关的KEGG通路显著富集,如膀胱癌信号通路(图5A)、DNA复制信号通路(图5B)、非小细胞性肺癌信号通路(图5C)、NOTCH信号通路(图5D)、P53信号通路(图5E)、WNT信号通路(图5F)等。
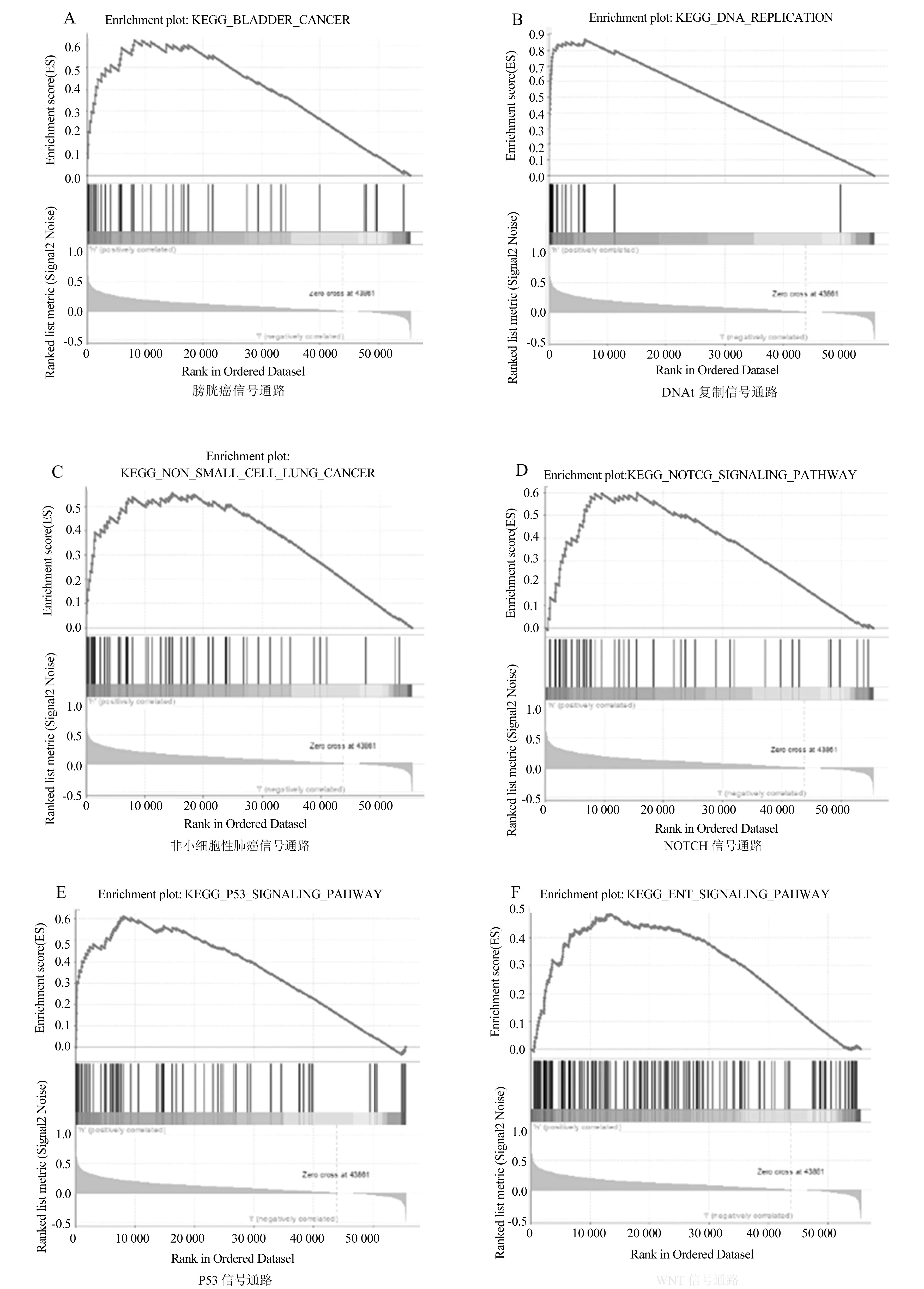
图5 TIPIN基因的综合GSEA分析
2.6 TIPIN基因的共表达分析
为了进一步研究TIPIN在肝癌发生发展中的作用机制,利用cBioportal数据库进行数据挖掘,筛选与TIPIN相互作用的基因。我们发现FANCI与TIPIN显著正相关(图6A)。进一步对FANCI基因进行临床相关性分析,发现FANCI高表达患者生存率显著降低 (图6B),在肝癌组织中FANCI的表达水平明显高于正常肝组织(图6C),进一步对病人样本进行整理,将来自相同患者的50对癌常组样本与肿瘤组样本进行配对分析,发现肿瘤组TIPIN的表达量明显上调(图6D),这与TIPIN的分析结果一致。这些结果表明,TIPIN与及其共表达基因FANCI可能共同促进了肝癌的发生与发展。
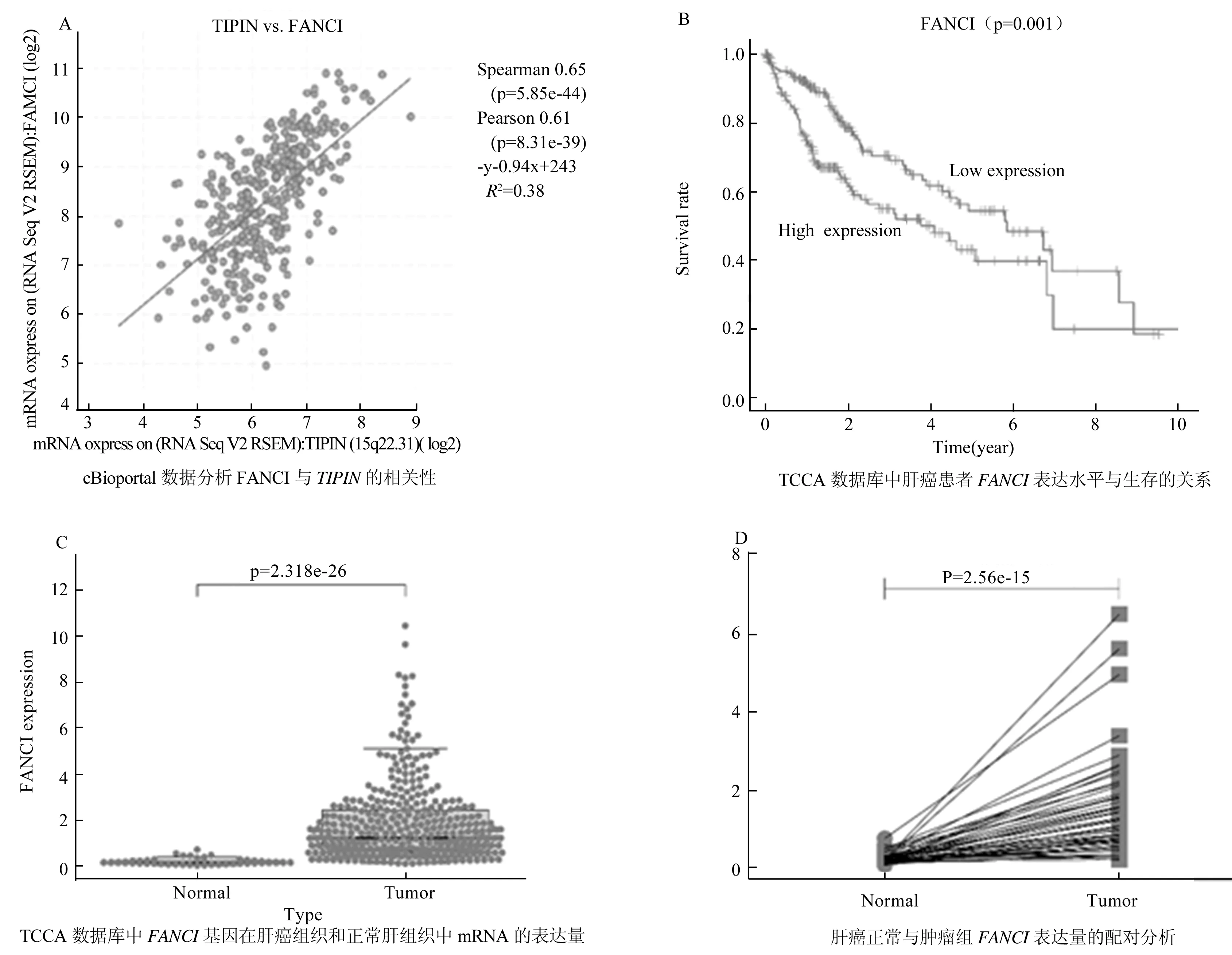
图6 TIPIN基因的共表达分析
3 结论与讨论
DNA损伤和修复反应在癌症发生与发展过程中作用已经得到了广泛的研究,对于癌症的发生与发展是一把双刃剑。一方面,DNA修复的破坏增加了基因组的不稳定性和突变,导致致癌基因表达的导常,或肿瘤抑制基因发生功能丧失的突变,这两种突变都可以驱动肿瘤生长,这是癌症的一个基本标志。另一方面,由于关键基因的突变、复制叉的停止或凋亡的触发,基因组稳定性的破坏和不受控制的突变可能对肿瘤细胞有害。参与DNA损伤和修复过程中的很多基因发生突变或异常表达,会促进肿瘤的发生与发展。例如,参与DNA修复过程中的BRCA1基因,其突变与乳腺癌和卵巢癌的发病有关[4,8-9]。核苷酸切除修复相关蛋白RAD23B可抑制乳腺癌的发生与发展[10]。起始DNA复制和延伸的GINS4复合物可以通过激活Rac1和CDC42促进胃癌细胞生长和进展[11]。
利用生物信息学分析方法筛选出新的肝癌诊断和预后生物标志物TIPIN。TIPIN参与正常DNA复制以维持基因组稳定性。TIPIN和其互作蛋白TIM形成的复合物TIM-TIPIN在协调复制解旋酶和聚合酶以调节单链DNA(ssDNA)聚合方面起着重要作用。本研究结果表明,在肝癌组织中TIPIN基因的表达水平显著高于正常的肝脏组织,经生存曲线图发现TIPIN基因低表达的患者生存率较好,而高表达患者生存率显著降低。通过临床相关性的探究表明TIPIN基因是肝癌患者的一个高危因素,且可作为肝癌患者的独立预后因素。之后针对TIPIN基因绘制肝癌3年的ROC曲线,线下面积AUC分别为0.622,说明TIPIN基因具有一定的临床诊断价值。此外,TIPIN高表达与膀胱癌、非小细胞性肺癌信号通路、子宫内膜癌、前列腺癌、脑胶质瘤等癌症密切相关,且NOTCH信号通路、P53信号通路、WNT信号通路和MAPK信号通路是TIPIN高表达富集的主要KEGG信号通路。GSEA结果表明TIPIN可能通过细胞周期,DNA复制等生理过程参与肝癌的发生发展过程。基因共表达分析显示TIPIN与其共表达基因FANCI可能共同促进了肝癌的发生与发展。
本文报道了TIPIN与肝癌之间的联系,研究TIPIN在肝癌中的表达及其与临床病理特征和预后价值,并揭示了TIPIN潜在的分子作用靶点。然而,关于TIPIN对肝癌细胞增殖、迁移和侵袭能力的影响,以及在荷瘤动物模型中TIPIN影响肝癌发生发展的功能还需进一步实验研究。总之,TIPIN可以作为肝癌诊断和预后的标志物之一,有望为临床上肝癌的早期诊断和治疗提供依据和关键技术支持。