石墨烯量子点在肿瘤诊断与治疗中的应用*
2022-08-18李慧倪频越缪臣琳龚艳乔玮陈付学冯诗倪
李慧,倪频越,缪臣琳,龚艳,乔玮,陈付学,冯诗倪
上海大学 生命科学学院,上海 200444
量子点(quantum dot, QD)是一种半导体纳米晶体,其粒径一般小于100 nm[1]。QD具有优异的光学性质,与传统的有机染料相比,QD展现出更加卓越的光化学稳定性、荧光量子产率、激发/发射光谱和生物相容性,因此逐渐被应用于生物成像和传感等领域[2-4]。石墨烯量子点(graphene quantum dot, GQD)是石墨烯材料的衍生物,其尺寸小于100 nm。GQD不但具备石墨烯的优异性能,且由于量子点的边界效应和限域效应使其具有独特的光致发光性质[5]。目前,基于GQD优异的荧光特性、生物毒性低、化学惰性以及易于表面功能化修饰等优势,其在功能材料、催化、光电器件及生物医学等领域都得到了极为广泛的应用[3,6-7]。在恶性肿瘤等疾病的诊断与治疗方面,可通过对石墨烯量子点的结构修饰,逐步实现大量重要疾病标志物的生物荧光检测,进而开发多样化的疾病诊断技术[8]。
恶性肿瘤是世界范围内公认的人类生命健康的主要威胁之一[9]。恶性肿瘤的常用治疗方式包括手术切除、放射疗法和化学疗法,这些方法广泛用于治疗各种类型的癌症,但存在易复发、副作用严重以及多重耐药性等缺点[10]。随着科技的进步,新型疗法迅速发展,如靶向治疗、嵌合抗原受体T(chimeric antigen receptor-T, CAR-T)细胞治疗等,在一定程度上弥补了传统治疗方法的不足,为恶性肿瘤患者带来新的希望。靶向治疗通过干扰特定分子以阻止肿瘤的生长、发展和转移[11],以高度的特异性有效递送药物,与传统化疗相比毒性更小[12]。但是,由于分子靶向治疗通过抑制对癌症进展至关重要的特定生物标志物发挥作用,因此该治疗仅对表达特定生物标志物的肿瘤患者有效,同时也存在耐药性风险[11]。CAR-T治疗利用基因工程技术将T细胞进行特异性改造用于肿瘤治疗,解决了过继性免疫细胞治疗特异性不足和体内缺乏持续杀伤作用的问题[13]。然而,CAR-T细胞在与肿瘤靶细胞表面抗原结合后,可能会引起靶向/非肿瘤毒性;或由于注入的CAR-T细胞被广泛激活,大量炎症细胞因子释放,引起靶向/肿瘤毒性[14]。新型疗法的出现虽然在一定程度上解决了传统肿瘤治疗手段的缺陷,但是其本身也存在耐药性、一定的毒性和治疗效率较低等问题,所以寻求高治疗效率、高生物安全性的新型治疗策略已经成为癌症治疗的热点[15]。
近年来随着纳米科技的迅猛发展,纳米技术逐渐被开发用于生物医学领域,基于纳米技术的药物递送系统在癌症治疗上的应用已被广泛研究(图1)。利用纳米材料设计并制备的药物递送系统能够提高药物的稳定性,增加药物的靶向性,增强肿瘤的治疗效果,同时还能够减少药物的毒副作用[16-18]。此外,基于纳米技术的治疗方法可联合传统肿瘤治疗方案,弥补单一治疗方式的不足,实现生物医学成像、药物的共同递送以及肿瘤的诊断与治疗一体化[19-22]。纳米技术与生物医学的交叉融合也有助于纳米治疗药物向临床方向的转化。

图1 纳米颗粒在诊断和治疗领域的探索[23]
GQD具有诸多优异的理化性质及良好的细胞相容性,在细胞成像、药物递送和肿瘤的诊断与治疗领域具有广阔的应用前景,是一种性能优越的多功能纳米材料。本文综述了GQD的制备和性质,以及其在生物成像、电化学传感器、催化剂和光伏器件方向上的应用,并着重介绍了GQD在药物递送、光动力治疗、光热治疗以及荧光成像与示踪等肿瘤诊断与治疗方面的研究进展。
1 石墨烯量子点的制备及性质
1.1 石墨烯量子点的制备
尺寸可调的GQD合成方法一般可分为自上而下法和自下而上法[24](图2)。自上而下的方法主要包括化学氧化法、电化学氧化法、氧等离子体处理法和溶剂热法等,一般是将石墨烯片、石墨或氧化石墨等材料切割成尺寸更小的GQD[25-28];自下而上的方法主要通过微波法、溶液化学法、超声波法等方法将小分子组合从而生成GQD[29-31]。通常,这些GQD具有富含羧酸功能的表面,可用于功能化修饰。此外,GQD的制备方法还包括电子束刻法和钌催化富勒烯法[32]。
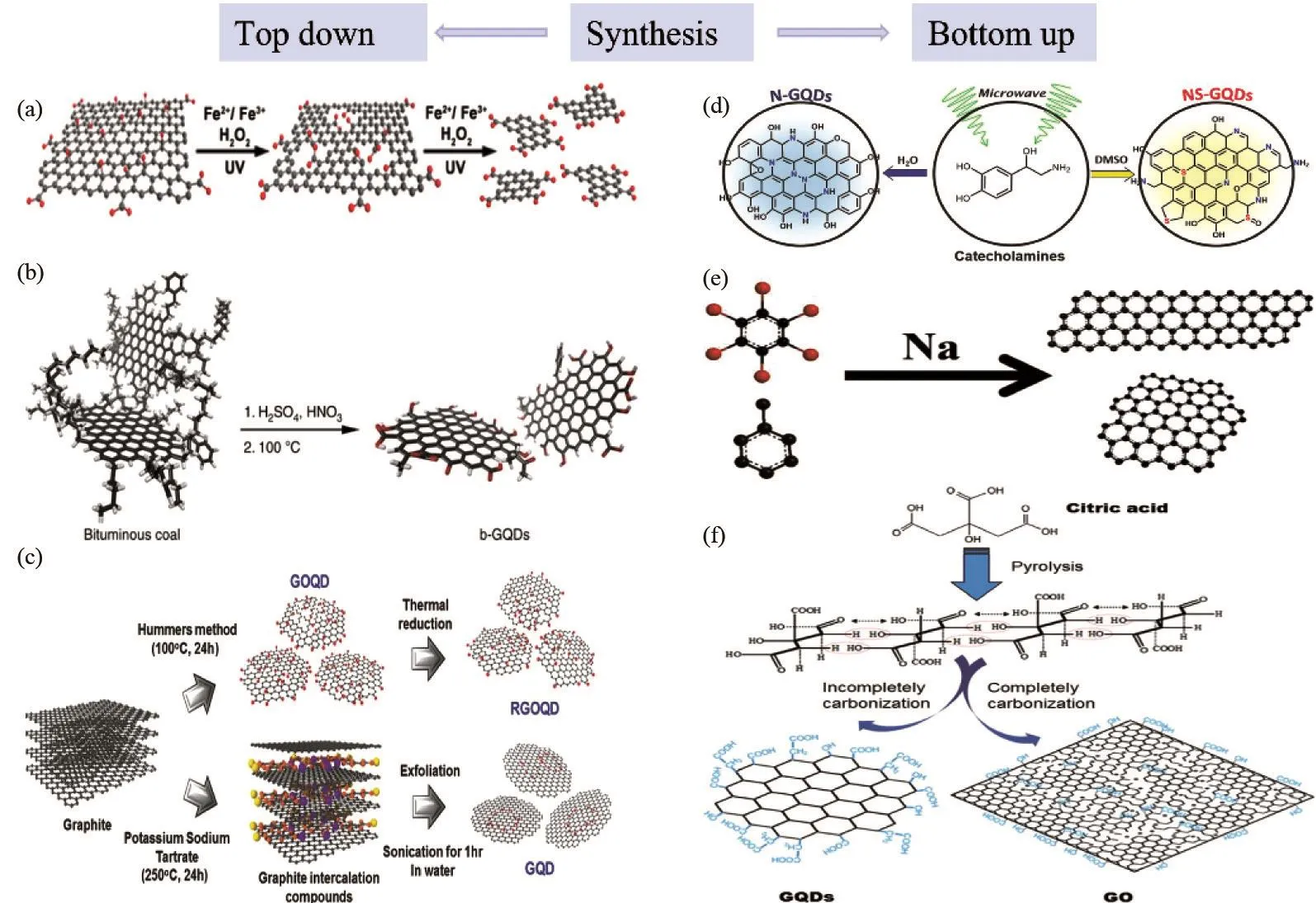
图2 GQD自上而下(a~c)和自下而上(d~f)合成:(a)氧化切割煤炭[25];(b)氧化切割氧化石墨烯[26];(c) Hummers法(氧化切割)和物理剥离[28];(d)用去甲肾上腺素[29];(e) 用六溴苯和甲苯[30];(f)用柠檬酸[31]
1.2 石墨烯量子点的性质
石墨烯量子点兼具石墨烯的片状结构和量子点自发荧光特性,除此之外,还具有一些独特的理化性质。
1.2.1 光学性质
GQD具有较强的光学吸收能力,其吸光强度通常在紫外区域(260~320 nm)较强,且随波长增大而减弱直至可见光范围逐渐消失[33-34]。GQD由于C=O键的n-π*跃迁和C=C键的π-π*跃迁,在230~280 nm波长范围产生一个吸收峰。GQD的光学吸收与石墨烯片上基团及量子点的结构密切相关。当制备方法及材料变化时GQD的粒径发生改变,产生不同的吸收峰。
GQD可通过量子限制效应产生可调谐的光致发光性(photoluminescence, PL)。GQD具有分层结构和良好的结晶度,与碳量子点(carbon quantum dots, CQD)相比具有更高的PL量子产率。Zhu等[35]合成具有不同荧光的GQD,其荧光范围可从紫外到红光区域。与传统的有机或无机荧光团相比,GQD的关键优势包括不闪烁的光致发光性和优异的光稳定性,其中前者可用于单分子跟踪,后者则允许长时间实时成像。以氧化石墨烯为材料通过溶剂热法制备的GQD,在低功率紫外灯或汞灯的照射下显示出极弱的光漂白,仅在使用1 000 W高压汞灯时才会观察到PL强度的降低。Li等[36]发现碱辅助电化学法制备的碳量子点具有优异的上转换发光性能,其激发光波长较长且能量低,对生物组织的穿透力强、伤害较小,在生物医药领域具有重要的应用价值[5]。
1.2.2 电学性质
与半量子点类似,GQD还具有电化学发光(electrochemiluminescence, ECL)特性。ECL是一种在溶液中的电化学反应过程产生的发光现象。作为一种分析技术,ECL结合了无背景光信号的化学发光分析和利用电极电位易于控制反应电化学分析的优点,还具备灵敏度高、选择性好、响应范围宽等突出优势。近年来,研究人员发现许多半导体量子点具有ECL活性[37-38],但通常稳定性、生物相容性较差[39]。
碳基点(carbon-based dot, CD)作为一种发光纳米材料,通常包括直径小于10 nm的碳纳米颗粒(即碳量子点)和横向尺寸通常小于100 nm的石墨烯纳米片(即GQD)。研究发现,CD同样具有ECL活性[40]。通常,GQD纳米片,尤其是单层GQD,比CQD纳米粒子具有更高的比表面积,这意味着GQD可能具有更丰富的表面态。因此,作为ECL发光体,GQD比CQD具有更大的应用潜力[41]。而与CQD相比,GQD具有更稳定的ECL和更接近0 V的起始电位,这可能是由于高含量的SP2碳加速了电子传输[9]。此外,氧化GQD由于含氧官能团的增多而增加了GQD的发射位点,从而产生更强的电化学发光效应。例如,由氧化石墨烯片制备的GQD水热起始电位可低至0.4 V,在连续循环扫描中测得相对标准偏差仅为1.0 %的稳定ECL信号[42]。
1.2.3 界/表面性质
除了光学和电学性质外,GQD还具有特殊的界/表面活性。通过控制不同的功能化基团合成亲水性、疏水性均强,或具有良好的两亲性质的GQD;通过在GQD中引入不同的边缘基团,改变亲水基团与疏水基团的种类数目,合成具有不同亲水亲油性质的GQD,满足不同表面活性需求[43]。Cho团队[44]将合成的亲水性GQD在40°C条件下与N,N′-二环己基碳二亚胺偶联和环氧开环同时反应,利用疏水性己胺改性,实现对GQD表面性质由高度亲水到完全疏水的广泛控制。除此之外,将表面修饰的GQD的荧光特性和表面活性剂性质有机结合还可以实现荧光标记和生物成像的协同作用。Kuo团队[45]制备了氨基功能化的N掺杂GQD(amino-N-GQD),与GQD相比amino-N-GQD表现出良好的双光子发光特性和稳定性,能够作为有效的双光子造影剂用于细菌的跟踪和定位。
2 石墨烯量子点的应用
2.1 生物成像
传统的半导体量子点,如硒化镉(CdSe)或硫化镉(CdS)等已被用于体外或体内光学成像实验[46]。然而,这些重金属元素量子点常引起严重的健康和环境问题。GQD具有低毒性、环保性和优异的PL特性,是一种极具潜力的新型生物成像剂。Zackery等[47]利用天冬氨酸和半胱氨酸两种天然前体,将N、S原子引入原始的量子点中合成荧光性能优异、易于修饰的强荧光NSGQD。该量子点具有量子产率高、官能团丰富等特点,且其在溶液和细胞内的荧光成像不受铜等金属离子的影响,有望成为一种优良的生物成像荧光探针。Nurunnabi等[48]将GQD和聚多巴胺涂层的GQD(D-GQD)通过尾部静脉注射到裸鼠体内,4 h后观察到GQD和D-GQD分布到心脏、肝脏、肺、脾脏和肾脏各个组织器官中,并且除肺部外其他器官内D-GQD的荧光强度均高于GQD。
2.2 电化学生物传感器
GQD具有自发荧光的性能,且其荧光强度与荧光发射波长、环境温度、pH值以及所处溶液的成分有关。因此,利用GQD的特殊性质,可将其运用于离子、分子或 pH值的检测。Qu等[49]基于N掺杂GQD (N-GQD),研制了用于酪氨酸酶(TYR)和酸性磷酸酶(ACP)活性检测的一种高灵敏荧光生物传感器。酪氨酸被TYR催化生成多巴醌,能有效地抑制N-GQD的荧光。在ACP的作用下L-抗坏血酸-2-磷酸(L-ascorbic acid-2-phosphate, AAP)被水解生成抗坏血酸(ascorbic acid, AA),并将多巴醌还原为左旋多巴,从而使猝灭的荧光得以恢复。Cui等[50]制备了新型N和S掺杂的GQD(N,S/GQD),并开发了基于适配体的aptamer@Fe3O4@GQD@MoS2复合物。此复合物利用aptamer@Fe3O4@GQD配合物作为供体,MoS2纳米片作为淬灭剂,能够用来检测癌细胞的生物标志物,上皮细胞黏附分子(epithelial cell adhesion molecular, EpCAM),因此可以快速识别和检测肿瘤细胞。
2.3 氧化还原反应催化剂
化学基团和掺杂剂赋予GQD特定的催化性能。此外,GQD还通过带隙排列、协同合作、形态调节、光吸附增强或促进电荷转移来提高许多催化剂的性能[51]。Qu等[52]利用电化学方法,以乙腈中的四丁基高氯酸铵作为电解质,将N原子原位引入到GQD中,由此制备了具有富氧官能团的N-GQD。该N-GQD具有发光和电催化活性。与不含N的对应物不同,N-GQD中的N/C原子比约为4.3%,具有蓝色荧光,展现出与Pt/C氧化还原反应催化剂相当的电催化活性。除了作为氧化还原反应的无金属催化剂,N-GQD独特的发光特性表明其在生物成像和发光二极管等许多领域的潜在应用。Chen等[6]合成一种由负载在钛网上的三元镍钴磷化物和GQD组成的异质复合材料(NCP/G NSs),可作为全解水的高性能双功能电催化剂,仅需119 mV过电位即可达到100 mA•cm-2的电流密度。在碱性介质中,电流密度为10 mA•cm-2时,全解水的工作电压为1.61 V,优于当前工业标准Pt/C-RuO2(1.73 V)。
2.4 光伏器件
胶体GQD具有良好的光电性能和溶液加工性能,因此在低成本、上转换PL和高性能光伏器件,如有机/无机混合太阳能电池、GQD敏化太阳能电池和有机发光二极管等领域中有着广阔的应用前景。Du等[53]利用GQD与3,4-乙烯二氧噻吩聚合物(3,4-ethylenedioxythiophene, PEDOT)链之间π-π键的强相互作用以及GQD与聚苯乙烯磺酸(polystyrene sulfonic acid, PSS)链之间亲水基团的强相互作用,致使PEDOT链与PSS链解耦和相分离,所得微结构(P-GQDs-10)同时提高了PEDOT:PSS的电导率和塞贝克系数。优化后的PEDOT:PSS/GQD复合材料的功率因数比原PEDOT:PSS提高550 %,可用于光伏器件中电荷的高效传输。
3 石墨烯量子点在肿瘤治疗中的应用
GQD作为一种新型的碳纳米材料,自发现以来的短短几年内,从制备方法到在各个领域的研究都取得重大突破,尤其在肿瘤治疗的药物递送系统、光动力疗法、光热治疗、荧光成像与示踪等方面取得了丰富的研究成果。
3.1 光动力疗法
光动力疗法(photodynamic therapy, PDT)是一种微创治疗方式,广泛应用于各种癌症的临床治疗[54-55]。PDT对肿瘤具有高度选择性,不会对周围组织造成严重损伤。PDT中,在适当波长的光照射下的光敏剂(PS)通过从光激发的光敏剂分子到氧分子的能量转移产生活性氧1O2(reactive oxygen species, ROS),例如单线态氧[56]。有效的PDT需要3个关键组成部分,光敏剂、光和氧。这三者的结合导致了活性氧的产生,打破了氧化还原平衡,并通过细胞凋亡和/或坏死激活与细胞死亡信号传导启动有关的转录因子。PDT的效果主要取决于单峰氧的产量和PS产生的其他活性氧,而该产量取决于所涉及的PS的性质[57-58]。Lin等[59]报道了一种由石墨片剥离和崩解而成的多功能GQD,它不仅具有理想的发光特性、高单线态氧产量,而且具有较小的生物毒性。Ju等[56]通过热分解柠檬酸合成N原子掺杂的GQD光敏剂,通过控制N掺杂量来调节GQD活性氧的生成,以实现效率可控PDT。实验证明优化与GQD结合的N原子数量,可以显著提高ROS产量,而无需使用额外的光敏剂(图3)。此外,该研究利用电荷反转(3-氨基丙基)三乙氧基硅烷((3-aminopropyl)triethoxysilane, APTES)在量子点表面进行核靶向给药的共轭修饰制备NGQD-DOX-APTES,将其作为药物载体和光敏剂能同时实现核靶向药物传递和高浓度活性氧生成。这为开发多功能的纳米生物医学治疗平台提供了一种有前景的策略。

图3 DOX、N-GQD-DOX 和 N-GQD-DOX-APTES在MDA-MB-231细胞内活性氧的生成[56]
3.2 光热疗法
光热疗法(photothermal therapy, PTT)通过具有电磁辐射的光学吸收剂治疗肿瘤等疾病。将具有较高光热转换效率的材料注入体内,当材料聚集于肿瘤组织时,通过外部光源(一般是近红外光)的照射将光能转化为热能来杀灭肿瘤。当PTT试剂吸收光时,电子从基态过渡到激发态,能量通过非辐射衰减而松弛,导致动能增加,从而使吸光物质周围的局部环境过热[60]。Cao等[61]设计了一种具有高单峰产氧能力和良好光学性能的量子点卟啉衍生物(GQD-PEG-P),可用于肿瘤细胞的胞内癌相关microRNA检测和荧光成像。经GQD-PEG-P处理的A549细胞在635 nm和980 nm激光照射下的细胞死亡率明显高于对照组,这表明基于GQD-PEG-P的协同治疗策略可高效清除癌细胞。Yao等[62]开发了一种多功能协同化学光热治疗平台,该体系以介孔二氧化硅纳米颗粒(mesoporous silica nanoparticle,MSN)作为化疗药物盐酸阿霉素(doxorubicin hydrochloride, DOX)载体,以GQD作为局部光热剂。DOX加载的GQD-MSN不仅表现出对酸碱度和温度敏感的药物释放行为,而且能够有效地产生热量,以满足PTT的温度要求。以乳腺癌4T1细胞系为模型的研究发现,GQD-MSN可被癌细胞高效摄取,且细胞毒性可忽略不计。重要的是,与单纯的化疗和PTT相比,DOX-GQD-MSN具有化疗/光热协同效应和优异的癌细胞杀伤作用(图4)。
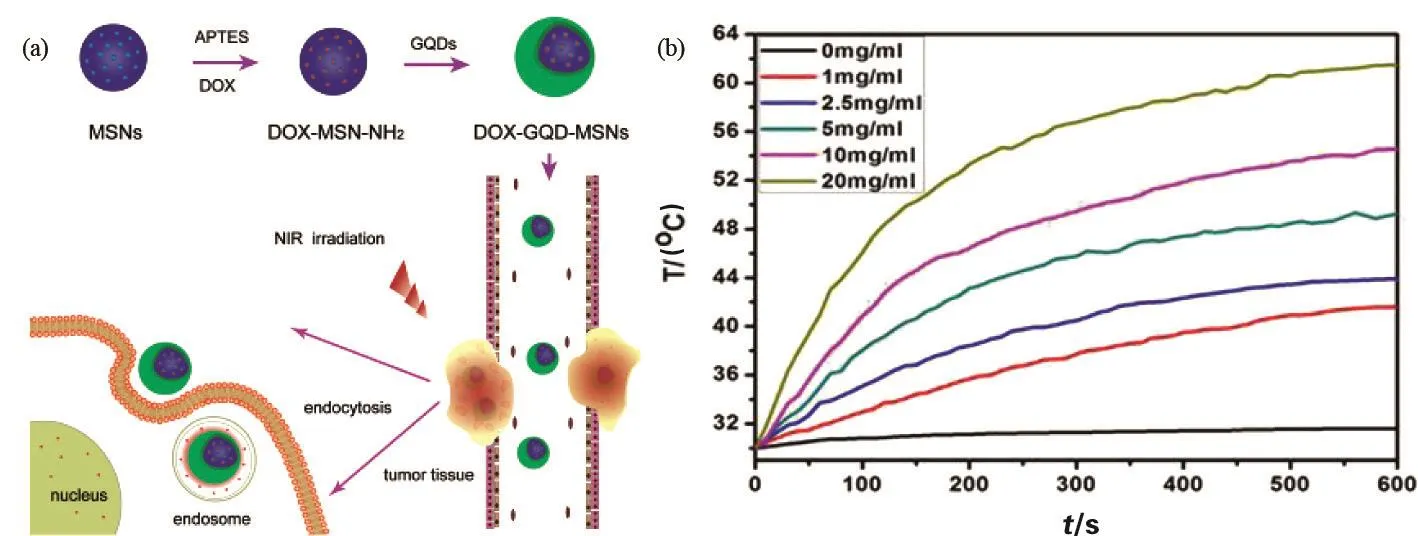
图4 DOX-GQD-MSN的合成过程(a)及光热曲线(b)[62]
3.3 药物递送系统
药物递送系统(drug delivery systems, DDS)通过吸附或包封等方式将药物加载于纳米材料中,形成药物纳米颗粒[63]。与游离药物分子相比DDS具有明显的优势,它能够通过肿瘤组织疏松的血管孔隙进入肿瘤组织,并在肿瘤部位产生高渗透和滞留效应(enhanced permeability and retention effect, EPR)[64]。DDS不仅能够实现多种药物共同递送或靶向递送,还能够增加药物的利用率,减少药物的副作用,延长循环半衰期并改善药代动力学[65-68]。
GQD较大的比表面积能与各种分子稳定相互作用,与石墨烯纳米片相比,其体积更小,生物相容性更强,更易于被细胞吸收且细胞毒性作用更小,因此被认为是安全、有效的药物传递载体[69]。Wang等[70]通过GQD与DOX的相互作用制备了稳定的DOX/GQD结合物。DOX/GQD结合物能将DOX特异性地输送到细胞核中,同时GQD还能够提高DOX对DNA的切割活性。DOX在核内累积浓度的提高和DNA切割活性的增强使其对耐药型癌细胞具有更高的细胞毒性。Sung团队[71]受海绵启发将GQD和光敏药物负载于多孔二氧化硅,并在其表面包裹固定有西妥昔单抗的红细胞膜制备了“纳米海绵”。西妥昔单抗的肿瘤靶向性增加了纳米颗粒在肿瘤部位的积累,在近红外光照射下,“纳米海绵”产生的热量能够触发GQD和药物的释放,进而有效地杀伤和抑制肿瘤(图5)。
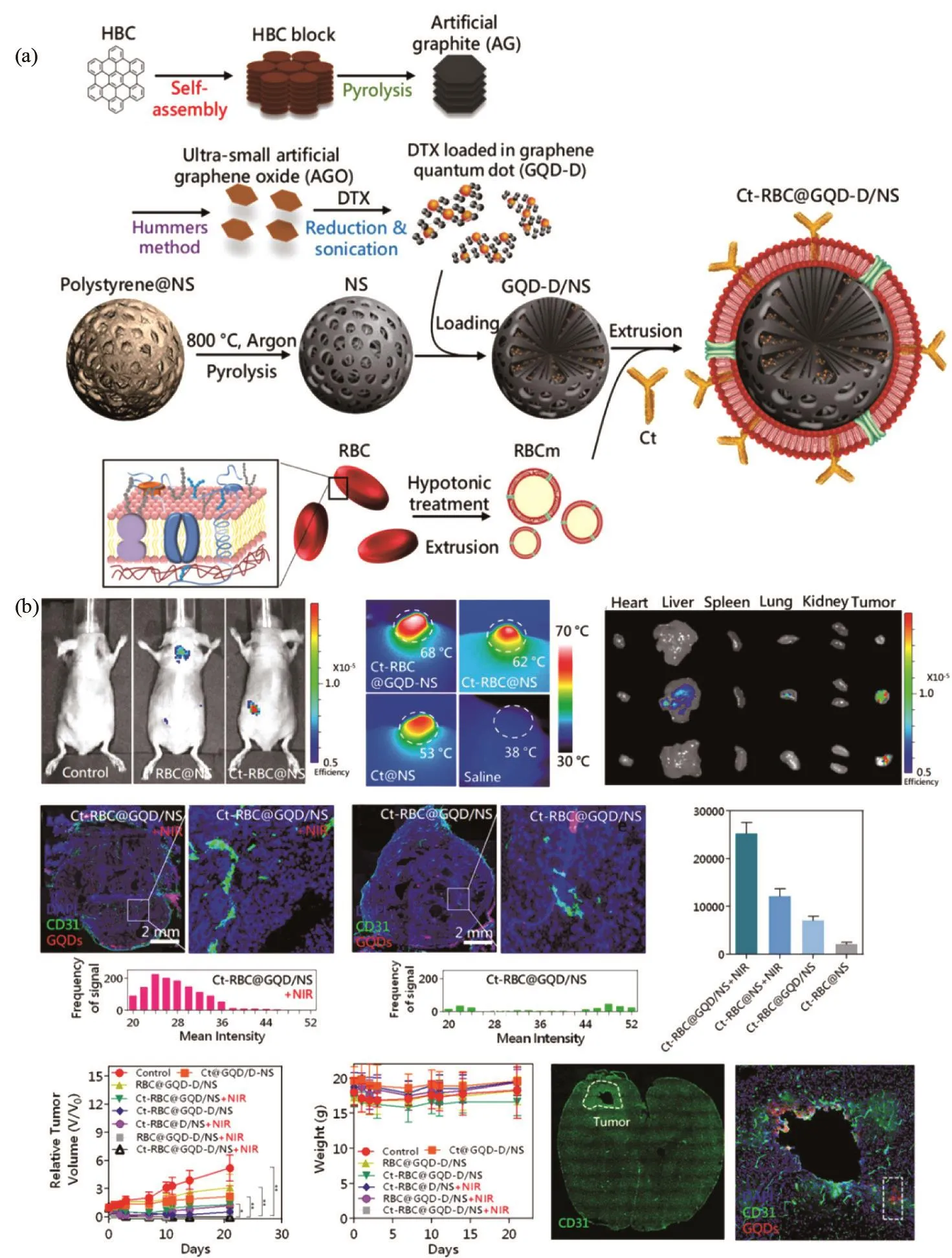
图5 Ct-RBC@GQD-D/NS的合成(a)及体内抗肿瘤研究(b)[71]
3.4 荧光成像及体内示踪
GQD的荧光稳定性强、生物相容性高等特性使其在生物医学成像与示踪方面也得到了广泛应用。Iannazzo等[72]设计合成GQD-PEGBFG,并利用该纳米材料与芘衍生物的稳定π-π相互作用,将核黄素与GQD表面结合,使得此纳米材料兼具靶向性和可用于体外追踪的荧光特性。Ge等[73]以聚噻吩作为前体利用水热法制备的GQD具有多种特性,包括从可见光到近红外波段的广泛吸收、良好的分散性、pH值稳定性以及优异的生物相容性,且具有较高1O2生成率,能够作为多功能纳米平台用于肿瘤的同步成像和体内PDT。将GQD水溶液注射到裸鼠背部,可观察到较强的高荧光信号。即使在注射后1周,注射部位也没有观察到明显的荧光强度衰减和扩散现象。Xu等[9]制备的环三磷腈掺杂GQD(C-GQD)具有出色的生物稳定性,能够应用于细胞内ROS水平的长效评估,其准确度可达98.3%。荷瘤小鼠在静脉注射C-GQD 4 h后可在肿瘤部位检测到强荧光信号,且该荧光在肿瘤部位滞留时间较长。此外,C-GQD还显示出对血液样本中肿瘤细胞的高识别率(82.33%)和灵敏度(79.65%),能够有效地“捕获”复杂血液微环境中的肿瘤细胞,表明C-GQD在临床循环肿瘤细胞(circulating tumor cell, CTC)的检测中也具有巨大的潜力(图6)。

图6 C-GQD在体外和体内对肿瘤的检测[9]
4 结语和展望
功能化的石墨烯和GQD作为高效的载药平台,已经得到了深入的研究,并进一步扩展到多基因、多分子、多组分药物运载。对于肿瘤光热治疗现趋向于将GQD功能化修饰或与其他材料协同作用。同样,在光动力治疗方面GQD已经不局限于产生活性氧自由基这单一作用,而是配合抗肿瘤药物实现多疗法协同。功能化GQD不仅能够与医学影像学和分子学诊断等诊断方式相结合,而且能与放疗、化疗、光动力治疗和光热治疗等治疗方式相结合,在实现肿瘤成像与定位的同时促进药物的精确、可控释放,从而更好地消灭肿瘤。基于GQD的纳米诊疗技术有望实现临床对肿瘤的精确诊断和治疗。
虽然目前已有关于GQD在肿瘤诊断与治疗一体化应用中的研究,包括将核磁共振成像与药物相结合、核磁共振成像与光热或光动力治疗相结合以及将肿瘤的光学成像与药物相结合的研究等,但是对肿瘤治疗过程中载体及药物分子同时进行实时监测的研究还较少,要真正实现肿瘤的精确诊断和实时监测,仍需更深入的研究。因此,发展兼具肿瘤光学成像、药物可控释放和药物释放实时监测的多功能GQD药物载体仍是一大挑战。
尽管本文我们将重点放在肿瘤的诊断与治疗应用上,但GQD在其他领域的应用也一直发展更新,包括能量存储和转换、光催化等,其发展潜力很大。我们相信,GQD将会为生物医药材料研究带来新的契机。
