慢性心力衰竭的诊疗现状
2022-08-18孙君怡薛睿聪梁玮昊董吁钢刘晨
孙君怡,薛睿聪,梁玮昊,董吁钢,刘晨†
①中山大学附属第一医院 心内科, 广州 510080;②中山大学 国家卫生健康委员会辅助循环重点实验室,广州510080
心力衰竭(heart failure, HF)简称心衰,是一组以肺循环和/或体循环淤血为主要表现(呼吸困难、疲乏和体液潴留、外周水肿)的临床综合征。心衰由各种心血管疾病(包括其他原因引起心脏结构和/或功能异常而使心脏收缩或舒张功能受损)导致的心排血量不能满足机体组织代谢需要所致,也是各种心血管疾病最严重的阶段。心衰死亡率和再住院率均较高,且预后不良。随着心血管疾病患病人数不断增长,深入了解心衰的病理过程、诊疗方法及预后管理对降低我国心血管疾病死亡率、改善心血管疾病预后具有重大意义。
基于对心衰的基础研究和临床研究,专家们结合各国的心衰诊疗状况,陆续发布了心衰诊疗指南。2018年中国专家发布的《中国心力衰竭诊断和治疗指南2018》(下文简称《中国指南》)[1]、2013年美国心脏学院基金会/美国心脏学会(ACCF/AHA)发布的《2013 ACCF/AHA心衰管理指南》(2017年对其部分更新,下文简称《ACCF/AHA指南》)[2]以及2021年欧洲心脏病学会(ESC)发布的《2021 ESC急慢性心力衰竭诊断和治疗指南》(下文简称《ESC指南》)[3]等均有较大的参考价值。
1 心力衰竭的分类
根据病理生理特点、临床特点和对治疗的不同反应,综合《中国指南》《ACCF/AHA指南》《ESC指南》,心衰有多种分类方法:根据病程分为急性心衰和慢性心衰;根据左心室射血分数(left ventricular ejection fraction, LVEF)分为射血分数降低的心衰(heart failure with reduced ejection fraction, HFrEF, LVEF≤40%)、射血分数中间值/轻度降低的心衰(heart failure with midrange/mildly reduced ejection fraction, HFmrEF,LVEF 40%~49%)以及射血分数保留的心衰(heart failure with preserved ejection fraction, HFpEF,LVEF≥50%);根据心衰的部位又可分为左心衰、右心衰及全心衰。目前研究发现,不同类型的心衰对同一治疗的反应不同,各类型心衰应有各自的针对性治疗方案。因此,细化心衰的分类对心衰的诊断和治疗策略优化具有重要意义,是心衰诊疗首先需要明确的。
2 流行病学
据统计,全球成年人的心衰患病率为1%~2%,且随着年龄的增长而上升[3,4-6]。目前我国心血管病患病率仍处于持续上升阶段,根据推算约有3.3亿国民患有心血管疾病[7-8]。心衰在心血管疾病中有较大的占比,且发病率逐年增加。对22 158名居民参与的中国高血压调查研究(CHS)2012—2015年的数据进行的分析发现,我国35岁以上人群心衰患病率为1.3%,较2000年增加44%,由此推测目前心衰患病人数约为1 370万,农村与城市居民患病率之间没有明显差异[9]。
中国心力衰竭注册登记研究(China-HF)对2012—2015年选出的心衰住院患者分析的结果表明,我国成年住院心衰患者中有39.7%为HFrEF,36.0%为HFpEF,总体在院死亡率为4.1%[10-11]。 目前,一方面人口老龄化呈加剧态势,高血压、冠心病、糖尿病、肥胖等慢性基础疾病的发病率不断上升;另一方面随着医疗水平的不断进步,心脏疾病患者的生存期延长,这些均导致我国心衰的患病率逐年升高[1]。
欧洲一项长期随访研究表明,HFrEF、HFmrEF和HFpEF患者分别约占心衰患者的60%、24%及16%,且女性患者占比更大[12]。一项对美国明尼苏达州奥姆斯特德县所有类型心衰患者的队列研究显示,1年与5年死亡率分别为20%和53%[13]。心衰住院的负担和费用亦在不断增长,美国2012年用于治疗心衰的总费用估计为307亿美元,而到2030年这一数字预计将增加127%[5,14]。
3 病因与诱因
早期识别心衰的基础病因[1,3](表1)对于心衰诊断十分重要,尽早针对基础病因采取针对性的治疗可明显改善患者的预后。

表1 心力衰竭的常见病因
慢性心衰急性发作和急性心衰均可由一定的诱因诱发,因而针对诱因的治疗能更有效地改善心衰症状。呼吸系统感染是诱发心衰最常见的诱因,感染性心内膜炎因其发病较隐匿而易漏诊[15],应引起临床医生的关注。此外,过量体力活动、情绪激动、气候突变、饮食过度或摄盐过多、输液过多过快及电解质紊乱等均可诱发或加重心衰[16]。因此在日常临床治疗过程中,医生应及时关注患者的电解质情况并准确计算入量与速度,防止发生医源性心衰。
4 慢性心衰的阶段与心功能分级
心脏作为机体的“泵”通过不断“做功”来保持良好的血液循环。心脏暴露于诱发心衰的各种危险因素时,虽未发生结构和功能的病理性改变,但机体的神经-体液-细胞因子调节系统代偿性激活,产生适应性代偿以维持心脏输出量。当危险因素无法解除、心血管原发病未能改善时,该代偿反应超过机体所能承受的最大限度并长期持续存在,最终导致心室重构的出现,心脏随之产生结构和功能的病理性改变。心功能从代偿向失代偿进展,出现心衰的各种临床表现。ACC/AHA在2001年首次提出根据心衰的发生、发展过程将心衰分为A、B、C、D四个阶段,强调在临床心衰阶段(阶段C)出现前尽早筛查危险因素识别心衰高危人群并进行早期干预。
纽约心脏协会(New York Heart Association,NYHA)的心功能分级[1-3,17-18]是目前临床最常用的心功能的评估指标,主要根据患者的症状进行评级,与心衰临床阶段结合分析(表2)可以更准确地评估患者的疾病阶段和病情严重程度,有助于指导制定心衰的治疗方案。

表2 心力衰竭的发展阶段与NYHA心功能分级对照表
5 心衰的诊断
早期识别和诊断慢性心衰有助于改善患者预后[19],是心衰规范化诊疗的关键。目前各大指南均已根据临床表现、实验室检查、心脏影像学、功能学检查等方面制定了慢性心衰的诊断流程[1-3](图1),临床医生可以据此对患者病情进行判断,寻找病因诱因,从而指导治疗。

图1 慢性心力衰竭的诊断流程
首诊的心衰患者均应积极筛查危险因素,并识别心衰的症状和体征,初步判断心衰诊断的可能性,并据此判定心衰的临床阶段和NYHA分级,同时应采集有鉴别诊断意义的症状和体征,以排除其他疾病。心衰的诊断需通过心电图、胸片、利钠肽水平和超声心动图等基本检查来明确,其中超声心动图是明确心脏结构和心衰分类的关键。此外,应关注心衰合并症和并发症的相关临床表现和辅助检查,进一步确定心衰的基本病因、诱因,并判断有无心衰的并发症和合并症。通过上述的临床线索全面评估心衰病情的严重程度和预后,以制定更完善的心衰诊疗方案[1]。
5.1 临床表现
症状和体征是临床医生能迅速得到的第一手资料,目前的临床工作越来越依赖于辅助检查而忽视了病史采集以及体格检查的重要作用,心衰诊断和鉴别均需要以患者的症状和体征为基础。研究表明,3项病史(年龄、冠心病史、袢利尿剂的使用)和6项体格检查(心率、心律、心尖搏动位置偏移、肺部啰音、心脏杂音以及颈静脉充盈)对于慢性心衰有独立的诊断价值[19]。然而,由于心衰代偿的程度不同及个体差异的存在,心衰的临床表现会有比较大的差别[1]。
(1)症状:左心衰主要表现为呼吸困难、端坐呼吸、夜间阵发性呼吸困难、咳嗽、喘息、活动耐量减低;右心衰典型表现为颈静脉怒张、双下肢水肿、腹胀、食欲不振、易疲乏、易乏力、活动后恢复时间延长。除此之外,亦可有意识障碍、抑郁、心悸、头晕、晕厥等不典型表现[3]。
(2)体征:心脏功能代偿良好的患者,可能没有明显的阳性体征。当心衰发展到一定阶段,患者可能出现如颈静脉充盈、肝颈静脉回流征阳性、第三心音奔马律、心尖搏动位置改变等特异性体征,某些患者亦可出现非特异性体征,如体重增加(>2 kg/周)、体重减轻(终末期心衰)、恶病质、呼吸急促、肺部啰音、胸腔积液、心动过速、心脏杂音、脉律不齐、肝肿大、腹水、少尿、肢端厥冷、外周性水肿等[3]。
5.2 基本检查
(1)心电图:3部指南都推荐对于所有疑似心衰患者,都应尽早进行心电图检查[1-3],以明确心律、心率、QRS形态、QRS宽度[1]。通常可发现房颤、病理性Q波、左室肥大等异常[3],心衰患者的心电图完全正常的可能性较小[1,3,20]。
(2)胸部X片或胸部CT:胸片或胸部CT是临床上方便快捷且应用广泛的影像学检查,因其可以提供肺淤血、肺水肿及心脏增大的证据并可识别/排除肺部疾病或其他引起呼吸困难的疾病,被《中国指南》和《ESC指南》列为心衰的基本检查[1,3]。《中国指南》已将其纳入心衰的诊断流程[1],体现出二者在我国临床实践中的指导意义。
(3)心衰特异性生物学标记物:利钠肽(natriuretic peptide, NP)是感知心肌牵拉而释放的一种激素,其主要作用机制为通过增加环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)合成来抵抗心肌纤维化和肥大进程,同时促进尿钠排泄及扩张血管以对抗肾上腺素、肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的水钠潴留效应[21-22]。N-末端B型利钠肽原(N-terminal pro-BNP, NT-proBNP)是B型利钠肽(B-type natriuretic peptide, BNP)激素原分解后没有活性的N-末端片段,前者半衰期较长,更能反映 BNP 通路的激活。二者已被多项临床研究证明可用于心衰的筛查、诊断及鉴别诊断,并且与病情的严重程度及预后密切相关,3部指南都积极推荐[1-3,23-25],其中《中国指南》与《ESC指南》提出当BNP<35 pg/mL或NT-proBNP<125 pg/mL时,可基本上排除慢性心衰[1,3]。然而值得注意的是,BNP或NT-proBNP的升高并不仅仅见于心衰,在房颤、高龄和急/慢性肾功能不全等多种疾病中均可发现异常[26],另外在肥胖患者中利钠肽的浓度往往较低[3,27],因此应结合患者自身的病情多方考虑、综合评估,以期得到最准确的诊断。此外,《中国指南》推荐联合使用心脏肌钙蛋白(cardiac troponin, cTn)、可溶性ST2、半乳糖凝集素3和生长分化因子15等多种生物标志物用于病因诊断、危险分层及预后评估[1]。
(4)经胸超声心动图:3部指南都推荐经胸超声心动图为评估心脏功能的首选方法,它不仅可以通过测得的LVEF对心衰进行临床分型,还可以得到房室容量、室壁厚度、瓣膜功能、肺动脉压力、左右心室舒张功能等多个结构和功能信息[1-3],帮助临床医生对病因及分期等进行判断。目前推荐改良双平面Simpson法,在图像质量较差时可适当加入对比剂使心内膜轮廓显示更加清晰[1,28]。
(5)实验室检查:血常规、血钠、血钾、血钙、血镁、空腹血糖、糖化血红蛋白、血脂、肝酶、尿素氮、肌酐、促甲状腺激素、转铁蛋白饱和度和血清铁蛋白等均可以作为心衰患者的初始检查,为病因及并发症诊断提供线索[1-3]。
5.3 特殊检查
特殊检查如有创或无创的心脏影像学及功能学检查,主要用于明确病因、判断并发症、评估病情及预后。
5.3.1 无创检查
(1)心脏磁共振(cardiac magnetic resonance,CMR):当超声心动图无法明确心衰的基本病因时,CMR可作为评估心脏结构与功能的首选辅助手段[3]。使用延迟钆增强(late gadolinium enhancement, LGE)、T1成像以及细胞外液容量可以识别出心肌纤维化或瘢痕组织,并可根据纤维瘢痕组织位于心内膜下还是心室肌壁内来鉴别缺血性心脏病和扩张型心肌病[1,3,29]。此外,CMR可发现各种病因所致心肌病变的组织特征,因此,《中国指南》和《ESC指南》均推荐通过CMR鉴别心肌炎、心肌淀粉样变、硬结病、Chagas病、Fabry病、左室致密化不全性心肌病、血色病以及致心律失常性心肌病等疾病[1,3]。
(2)冠脉CT(computed tomography coronary angiography, CTCA):有低中危冠心病风险和无创性负荷试验中无法确定是否存在心肌缺血的患者,可首选CTCA而非冠脉造影以排除冠心病[3,30]。
(3)运动或药物负荷超声心动图:适用于评估病因可能为冠心病而需要血运重建的患者,对于 HFpEF、瓣膜性心脏病或存在无法解释的呼吸困难的患者的诊断可能有一定辅助作用[1,3,31-32],但因其在心衰患者中的安全性尚存争议,指南中仅为IIb类推荐[3]。
(4)核素心室造影及核素心肌灌注和/或代谢显像:单光子发射计算机断层成像(single-photon emission computed tomography, SPECT)及正电子发射计算机断层成像(positron emission computed tomography, PET)均可用于心衰合并冠心病患者在冠脉血运重建之前的心肌缺血情况评估[1,3]。
5.3.2 有创检查
(1)冠状动脉造影:主要适用于可能需要冠脉血运重建,尤其是经药物治疗无效的心绞痛或有症状的室性心律失常的病人[3,30]。对有中高危冠心病风险和无创性负荷试验中存在心肌缺血的HFrEF患者,亦可考虑冠状动脉造影,但获益的可能性不大[3]。
(2)右心导管检查:推荐重症心衰并考虑心脏移植或机械辅助循环患者的术前评估[1,3]。《ESC指南》特别指出,若怀疑患者是因为缩窄型心包炎、限制性心肌病、先天性心脏病和高输出状态引起的心衰,或可能为HFpEF的患者,亦建议进行右心导管检查[3]。
(3)心内膜活检:心内膜活检是具有一定风险的有创检查,因此仅推荐用于经标准治疗后心衰仍急剧进展,怀疑是由特殊病因引起的且只能通过心内膜活检来明确诊断的患者[1,3,33]。
5.3.3 心功能评估
(1)心肺运动试验:因本试验可以量化患者的运动能力,所以也推荐用于重症心衰并考虑心脏移植或机械辅助循环患者的术前评估[34]。另外本试验结果可以指导优化运动训练,并在一定程度上帮助鉴别原因不明的呼吸困难和/或运动耐量减低[1,3]。
(2)6 min步行试验:用于评估慢性心力衰竭患者的运动耐力。患者在平直走廊里尽可能快地行走6 min,测量步行距离,<150 m为重度心衰,150~450 m为中度心衰,>450 m为轻度心衰[1]。
5.3.4 其他
生活质量评估可通过问卷、量表评价患者的主观症状,有助于指导心衰患者日常管理。对于有相关家族史的心衰患者,可通过基因检测筛查突变基因进一步明确病因[1]。
6 慢性心衰的治疗
6.1 射血分数降低的心衰(HFrEF)
HFrEF是慢性心衰中最常见的类型,其诊断详见图1。HFrEF的治疗近年来取得了较多突破性进展,主要包括药物治疗及心脏植入型电子器械治疗[1,3]。HFrEF的治疗目标为降低死亡率、预防心衰恶化再住院、改善临床症状和心功能、提高生活质量[3,35]。
6.1.1 药物治疗
药物是治疗HFrEF的基石。肾素-血管紧张素-醛固酮系统和交感神经系统的“金三角”抗心衰药物,血管紧张素转换酶抑制剂(angiotensinconverting enzyme inhibitor, ACEI)/血管紧张素受体脑啡肽酶抑制剂(angiotensin-receptor neprilysin inhibitor, ARNI)、β受体阻滞剂(β-blockers)、盐皮质激素受体拮抗剂(MRA)被明确可改善心衰患者的预后,并已广泛应用于临床[36-50]。随着多项临床试验阳性结果的公布[51-52],钠-葡萄糖共转运体2抑制剂(sodium-glucose co-transporter 2 inhibitors, SGLT2i)也被证明可在“金三角”基础上改善心衰患者的预后。在《ESC指南》中,SGLT2i与“金三角”药物共同被推荐为HFrEF患者的一线用药,成为治疗HFrEF的“新四联”药物[3]。近期研究发现,可溶性鸟苷酸环化酶受体激动剂维利西呱可进一步改善HFrEF患者的预后,有望成为指南中继SGLT2i后HFrEF的高推荐级别药物。此外,针对心衰患者的液体潴留、药物耐受等个体情况,根据实际情况可以使用利尿剂、血管紧张素II受体阻滞剂(angiotensin II type I receptor blockers, ARB)、If通道阻滞剂(If-channel inhibitor)、地高辛,以期改善患者的生活质量和临床症状。表3列出HFrEF药物治疗的主要临床研究。

表3 HFrEF患者药物治疗的主要临床研究
(1) 血管紧张素转换酶抑制剂( ACEI)
ACEI 是第一类被证明能降低 HFrEF 患者死亡率和发病率的药物[3]。在所有ACEI类药物治疗心衰的临床试验中,CONSENSUS研究是最早的一项,其结果发现使用依那普利的重症心衰患者6个月死亡率为26%,比安慰剂对照组的44%显著降低[36]。此后的研究中陆续涌现出卡托普利、赖诺普利、雷米普利等多种ACEI类药物,并均被证明在降低死亡率及改善症状和预后等方面有着重要的作用[37-39]。因此,指南推荐对于所有的慢性HFrEF患者,如无禁忌证或不能耐受,均需尽早应用ACEI类药物,并且应从小剂量开始,逐渐增加至最大耐受量或目标剂量[1-3]。
(2)血管紧张素受体脑啡肽酶抑制剂(ARNI)
ARNI的代表药物为沙库巴曲缬沙坦钠,其中沙库巴曲成分作为脑啡肽酶抑制剂,具有升高利钠肽、缓激肽、肾上腺髓质素及其他内源性血管活性物水平的作用[1]。PARADIGM-HF试验首次将ARNI用于心衰治疗,发现相对于依那普利,ARNI更显著地降低HFrEF患者心衰住院和心血管死亡的复合终点风险,并可以明显改善症状提高患者的生活质量[40]。其后,PIONEER-HF和TRANSITION两个研究更加证实了ARNI对预后的改善作用[41-42],因此《ESC指南》推荐可以考虑将ARNI替代ACEI作为HFrEF降低生物标志物水平、改善预后的一线用药[3]。
(3) β受体阻滞剂
β受体阻滞剂可抑制交感活性、平衡自主神经功能以及降低心室应力,从而改善患者症状及预后,是治疗HFrEF的经典药物之一。很多大型研究证实β受体阻滞剂可以明显减少全因死亡、心血管住院事件的发生,并且具有改善症状和生活质量的作用[43-48]。目前指南推荐对无禁忌证的有症状HFrEF患者,应早期联用ACEI类药物和β受体阻滞剂[3]。由于β受体阻滞剂的负性肌力作用有诱发和加重心衰的可能,对于NYHA心功能IV级患者应在血流动力学稳定后再使用[1]。目前推荐以静息心率为60 次/min时β受体阻滞剂的剂量为目标剂量或最大耐受剂量[1]。
(4)盐皮质激素受体拮抗剂(mineralocorticoid receptor antagonist, MRA)
醛固酮在心肌细胞外基质重塑中起重要作用。当发生心衰时,心室中的醛固酮生成及活性增加,与心衰的严重程度成正比,在长期应用ACEI类药物的心衰患者中,常会出现循环醛固酮水平不能稳定持续地降低而产生的“醛固酮逃逸现象”[16]。RALES和EMPHASIS-HF等多项大型临床研究发现,螺内酯和依普利酮等主要靶向醛固酮受体的MRA类药物可以降低全因死亡、心血管死亡和心衰住院的发生率,并对症状具有一定的改善作用,但同时也无可避免地会影响糖皮质激素、性激素等其他甾体类激素,导致男性乳房发育等不良反应[49-50]。目前指南中推荐对于所有无禁忌证HFrEF患者,均应在ACEI和β受体阻滞剂的基础上加用 MRA[1-3]。

续表

续表

续表

续表
(5)钠-葡萄糖共转运体2抑制剂(SGLT2i)
SGLT2i于2012年作为新型降糖药首次上市。在后续的多项研究中发现,此类药物具有强大的组织间液容量调节和血压调节作用,应用于充血性心衰的患者可改善心衰症状。此外,SGLT2i可通过调整心脏底物利用结构、改善心脏能量供应、降低心肌耗氧量等机制使得心衰患者获益[51]。大型临床试验DAPA-HF和EMPERORReduced结果发现,达格列净和恩格列净可显著降低糖尿病和非糖尿病HFrEF患者的心血管死亡和心衰住院率[51-52],是有效改善HFrEF患者预后的新型药物。虽然SGLT2i改善心衰的具体机制仍待阐明,但《ESC指南》推荐对无论是否患有糖尿病的HFrEF患者,均可在ACEI/ARNI、β受体阻滞剂和MRA的基础上联合应用达格列净或恩格列净,以最大程度改善患者预后[3]。
(6)利尿剂
利尿剂可有效缓解HFrEF患者的气促、肺部啰音、双下肢水肿等液体潴留症状体征,一直以来被各指南推荐为缓解心衰症状的一线药物[1-3]。由于缺乏关于利尿剂对心衰患者死亡率及患病率影响的大型临床研究,因此尚未推荐利尿剂作为改善心衰患者长期预后的药物[3]。利尿剂主要包括袢利尿剂、噻嗪类利尿剂、保钾利尿剂及血管加压素V2受体拮抗剂等类型,需根据患者体液潴留症状、体征、血压、肾功能和电解质情况进行选择[1]。
(7)血管紧张素II受体阻滞剂(ARB)
Val-HeFT[53]和CHARM-Alternative[54]两项研究发现缬沙坦和坎地沙坦都可以降低心衰住院率。近年随着ARNI的推出,各项临床试验也均无法证明ARB有降低全因死亡率的作用,ARB在心衰治疗领域的地位逐渐下降,指南中仅将其作为ACEI/ARNI不耐受者的替代药物[3]。
(8)If通道阻滞剂
伊伐布雷定通过特异性地作用于窦房结起搏电流(If)以降低窦性心率,因而仅用于窦性心律的HFrEF患者治疗[1,3]。2010年,SHIFT研究发现,接受伊伐布雷定治疗的HFrEF患者在心血管死亡和心衰住院复合终点发生率比安慰剂组降低18%(24% vs. 29%, P<0.000 1),且不良反应发生率较低,对于症状亦有改善作用[55],被各指南推荐。伊伐布雷定仅适用于β受体阻滞剂已到达目标剂量或最大耐受剂量但心率仍不低于70次/min的心衰患者[1,3]。伊伐布雷定最常见的不良反应为心动过缓和光幻症,当心率<50次/min或出现相应症状后应及时停药[1,55]。
(9)地高辛
地高辛属于洋地黄类药物的一种,主要通过抑制细胞膜Na+/K+-ATP酶产生正性肌力的作用,同时也可增加副交感神经活性来产生负性传导效应[1]。1997年,DIG研究发现地高辛并不会降低全因死亡率,但可以显著减少心衰住院率[56]。目前指南推荐地高辛可用于在利尿剂、ACEI/ARB/ARNI、β受体阻滞剂和MRA治疗后仍持续有心衰症状的HFrEF患者。地高辛的治疗窗口较窄,可能引起洋地黄中毒甚至死亡等不良事件,因此在应用时需谨慎并应实时监测血地高辛浓度,将其保持在1.2 ng/mL以下[1,3]。
(10)可溶性鸟苷酸环化酶受体激动剂转行维利西呱是一种新型口服可溶性鸟苷酸环化酶激动剂,可直接刺激可溶性鸟苷酸环化酶(sGC)并激活环磷酸鸟苷(cGMP)通路,也可以稳定NO与其受体的结合,使sGC对内源性NO敏感[57]。2020年,VICTORIA研究小组试验结果公布,在42个国家或地区的616个中心招募的5 050名受试者中,与安慰剂组相比,维利西呱组心血管死亡和心衰住院复合终点发生率降低了10%(35.5% vs.38.5%, P=0.02)[57]。《ESC指南》建议可将其作为HFrEF标准治疗的辅助治疗,以减少不良事件的发生并改善心衰患者的预后[3]。目前美国食品药品监督管理局(FDA)已批准维利西呱用于治疗具有症状的HFrEF患者,日前维利西呱也在中国提交了上市申请。
(11)心肌肌球蛋白激动剂(cardiac myosin activator)
心肌肌球蛋白激动剂通过直接增强心肌细胞的肌小节功能来改善心肌收缩。GALACTICHF研究是迄今为止心衰治疗领域规模最大的III期临床研究之一,在全球35个国家或地区的945个中心招募了8 232名受试者,21.8个月(中位随访时间)后,发现心肌肌球蛋白激活剂Omecamtiv mecarbil对于降低首次心衰事件和心血管死亡的复合终点发生率有着显著效应[58]。目前该药尚未获批上市,但它在临床上的应用前景值得期待。
(12)硝酸异山梨酯/肼屈嗪联合应用
研究表明,一氧化氮生物利用率下降和氧化应激也是心衰及心室重构的一个重要机制。在“金三角”的基础上联合应用一氧化氮生成剂硝酸异山梨酯和抗氧化剂肼屈嗪,可提高严重心衰患者的生存率[59]。该研究仅为小型临床试验,研究人群为非裔NYHA III-IV级的HFrEF患者[3,59],因此硝酸异山梨酯联合肼屈嗪是否能推广仍需进一步临床研究佐证。
(13)中医中药治疗
中医药是我国的国粹,是中国原创的医学体系,汇聚着无数中华医者的经验与智慧。在慢性心衰方面,目前已有研究表明在标准治疗的基础上加用中成药“芪苈强心胶囊”可以降低生物标志物NT-proBNP水平,改善心功能分级、缓解症状[60],其具有较大的应用潜力。中药治疗仍需要进一步大规模临床试验,我们期待这块“千年瑰宝”可以在新时代焕发出别样的光彩。
6.1.2 心脏植入型电子器械治疗
对于慢性心衰病人,当药物治疗无效时,需考虑器械治疗以改善患者的症状。最常用的心脏植入型电子器械治疗为植入式心律转复除颤器(implantable cardioverter defibrillator, ICD)和心脏再同步化治疗(cardiac resynchronization therapy, CRT),除此之外亦有心脏肌肉收缩调节器(cardiac contractility modulation, CCM)等一些设备或技术正处在临床验证阶段。
(1)植入式心律转复除颤器(ICD)
在心衰的病理发展过程中,不仅存在着心脏结构的变化,还有电流紊乱及电重构的发生,以致恶性心律失常甚至心源性猝死的风险显著增加。SCD-HeFT研究探究了在标准治疗的基础上应用胺碘酮或ICD对于NYHA心功能分级 II~III级、LVEF≤35%的缺血性或非缺血性心衰患者全因死亡的影响,结果表明与安慰剂组相比,胺碘酮并不会降低全因死亡率,在NYHA心功能分级III级的患者中反而会增加死亡风险,ICD可以将死亡风险降低23%(P=0.007)[61]。2002年,MADIT-II研究发现ICD可使心梗后心衰患者全因死亡风险降低31%(P=0.016)[62],而对于非缺血性心衰患者,DANISH研究显示,ICD植入虽然对全因死亡没有影响但可以显著降低心源性猝死的发生率[63]。
目前指南推荐ICD可用于曾有血流动力学不稳定的室性心律失常(除非有可逆原因或发生在心梗后48 h内)、机体功能状态良好、预期生存期大于1年的心衰患者的二级预防,也可以被用于NYHA心功能分级II~III级、在优化药物治疗3个月后LVEF≤35%、预期生存期大于1年的缺血或非缺血患者的一级预防。然而,目前不建议对心肌梗死后未满40天的患者植入ICD,因其无法改善此类患者的临床预后[1-3]。
(2)心脏再同步化治疗(CRT)
CRT通过纠正心衰患者的心脏失同步来提升左室射血分数,从而改善心衰症状[1]。CAREHF研究纳入813位NYHA心功能分级III~IV级、LVEF≤35%、QRS时限不少于120 ms的HFrEF患者,分别使用单独药物治疗及药物治疗基础上加用CRT,经过平均29.4个月的随访发现,加用CRT组的全因死亡和心血管住院的复合结局发生率显著降低了37%(P<0.001),全因死亡减少36%(P<0.002)。此外,CRT亦可降低心室机械延迟、收缩末期容积指数和二尖瓣反流面积,增加左心室射血分数,从而改善症状并提高生活质量[64]。
在后续的大量临床试验中,CRT的各项适应证得到进一步明确。目前推荐对于窦性心律、QRS时限不少于150 ms、左束支传导阻滞(left bundle branch block, LBBB)、经过药物优化治疗后LVEF≤35%的症状性心衰患者可植入CRT,以减轻患者症状并较大程度改善预后[1,3]。
6.2 射血分数中间值/轻度降低的心衰(HFmrEF)
HFmrEF的概念于2014年首次被提出,2016年ESC首次将其写入心衰指南,当时定义为“射血分数中间值的心衰”(即LVEF 41%~49%),因而普遍认为HFmrEF处于“灰色地带”,兼具HFrEF和HFpEF的特点。HFmrEF似乎总能为临床医生提供一些治疗的灵感,但仔细推敲却发现它有自己的特征,之前与HFrEF或HFpEF的“捆绑式研究”也并不再成为强有力的治疗依据。随着研究的深入,人们意识到HFmrEF整体上与HFrEF更加相似,尤其是在发病人群多数是男性、发病年龄较轻、缺血性心脏病或心肌病的比例较高、房颤及其他非心血管系统并发症发生率低等方面[65]。《ESC指南》中将HFmrEF的定义更正为“射血分数轻度降低的心衰”[3]。
具有心衰的症状或体征的患者(LVEF41%~49%、BNP≥35 pg/mL或NT-proBNP≥125 pg/mL)还有其他心脏结构异常(左室肥厚、左房增大、左室舒张功能异常或充盈压升高)时,即可诊断为患有HFmrEF[1,3](图1)。目前主流观点认为HFmrEF可能是与HFrEF或HFpEF不同的阶段。HFmrEF患者中既有HFrEF经过治疗后LVEF升高者,也有HFpEF病情“恶化”导致LVEF降低者,而HFmrEF患者亦可转变为HFrEF或HFpEF[66]。未来对于HFmrEF的病理生理过程及其分子机制需要更加细致而精准的研究。
目前HFmrEF患者中有较大部分在应用改善HFrEF的药物,如ACEI/ARB/ARNI、β受体阻滞剂、MRA、地高辛等[3],但尚未有一项专门的HFmrEF临床试验对这些药物进行探索验证,只是根据HFrEF和HFpEF研究中包含有HFmrEF的一部分数据进行再分析,发现这些药物对于HFmrEF的全因死亡、心血管死亡、心衰住院等事件的发生率有着减少的趋势。如一项对CHARM研究的再分析发现,与安慰剂组相比,HFmrEF患者中使用坎地沙坦心血管死亡或心衰入院的复合终点发生率可以降低24%(P=0.02),心衰再入院率也大幅降低52%(P<0.001)[67]。这也可能是因为HFmrEF患者多数有高血压、冠心病、房颤等基础疾病,药物对这些基础疾病的治疗作用体现在心衰预后上。此外,利尿剂也被推荐用于减轻HFmrEF患者的体液潴留症状和体征[1,3]。总之,对于HFmrEF的研究工作目前尚处于起步阶段,后续仍需大量基础与临床研究来探寻其中的机制,以便更好地指导治疗。
6.3 射血分数保留的心衰(HFpEF)
2003年CHARM 研究首次提出“射血分数保留的心衰”这一概念,并将其定义为 LVEF>40%的心衰[68]。随着研究的开展,HFpEF的LVEF界值一直存在着争议,有学者提出应根据性别、年龄或种族来界定。目前《中国指南》和《ESC指南》均将 LVEF>50%作为诊断HFpEF的必要条件[1,3]。
与HFrEF或HFmrEF相比,HFpEF的患病人群中老年、女性占比较大,且肥胖、高血压、慢性肾脏病、糖尿病及代谢综合征等合并症的发生率更高,其中的潜在机制尚未完全阐明,目前认为可能与间歇性压力超负荷、代谢紊乱、血管内皮和冠状动脉微血管功能障碍、组织缺血和纤维化等病理机制相关[69]。在HFpEF动物模型中,初步发现由一氧化氮合酶(iNOS)驱动的IRE1α-XBP1通路失调是HFpEF心肌细胞功能障碍的关键机制[70]。然而,基于HFpEF的病因和病理过程的复杂性,仍需要更多的基础研究来深入阐明其发病机制。
HFpEF的复杂性亦体现在诊断方面。《ESC指南》中HFpEF诊断流程与其他两种类型相似,如患者具有心衰的症状或体征,LVEF>50%,BNP≥35 pg/mL或NT-proBNP≥125 pg/mL(合并房颤患者BNP≥105 pg/mL或NT-proBNP≥365 pg/mL),并且有其他心脏结构或功能异常(左心室质量指数:女性不小于95 g/m2,男性不小于115 g/m2;相对室壁厚度大于0.42;左心房容积指数:窦性心律大于34 mL/m2,房颤大于40 mL/m2;静息状态 E/e’>9;肺动脉收缩压大于35 mmHg(1 mmHg≈133.3 Pa);静息状态三尖瓣反流速度大于2.8 m/s)即可诊断[3]。此外,H2FPEF评分[71]和HFA-PEFF评分[72]可量化评估HFpEF的可能性,但二者的诊断效果并不稳定[3]。复旦大学附属中山医院葛均波院士根据HFpEF的病因和临床表型将其细化为血管疾病相关HFpEF、心肌病相关HFpEF、右心和肺动脉疾病相关HFpEF、瓣膜病和心律失常相关HFpEF以及心脏外疾病相关HFpEF等5种类型,为HFpEF的诊治提供了新的思路。
基于临床研究证据,绝大多数可改善HFrEF预后的药物对HFpEF患者均无显著疗效[69,73-87](表4)。2021年8月,EMPEROR-Preserved研究III期临床结果的公布为HFpEF的治疗带来一丝曙光。该研究在世界范围内共招募5 988位NYHA心功能II~IV级、LVEF>40%的患者,随机分为两组,在常规治疗的基础上分别加用恩格列净(10 mg)或安慰剂,经过26.2个月的中位随访时间,最终发现恩格列净可以将心血管死亡或心衰住院率明显降低21%(13.8% vs. 17.1%, P<0.001),其中心衰住院率降低27%(P<0.001),且不论患者是否患有糖尿病,结论均保持一致[80]。HFpEF的治疗研究现状也从侧面反映了其与HFrEF在发生发展机制方面有着比较大的差别,也因此目前指南推荐对于HFpEF患者最重要的手段是使用利尿剂缓解症状和体征,同时积极探寻病因,诊治并发症及合并症[3]。

表4 药物治疗HFpEF的主要临床研究

续表
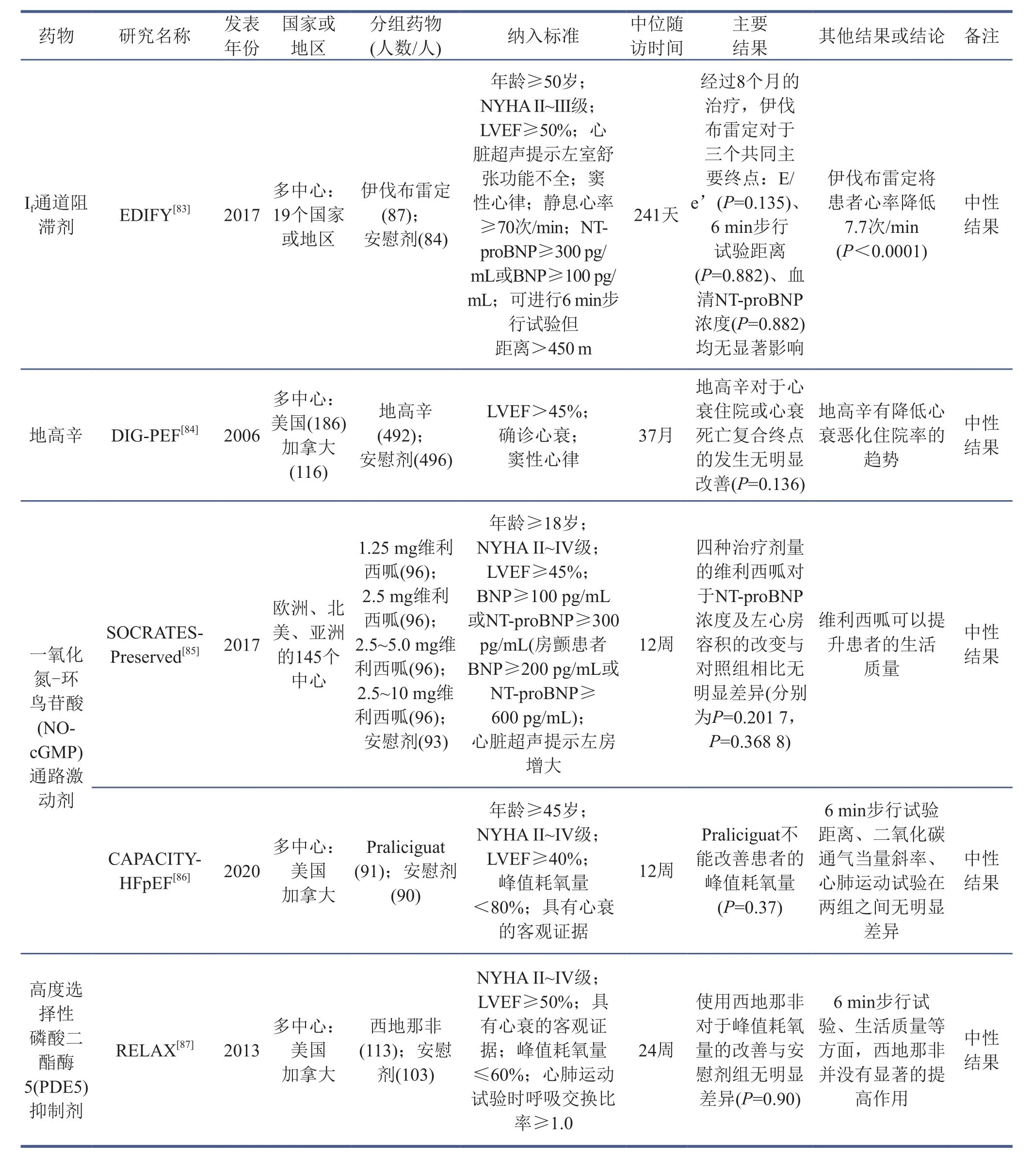
续表
7 心衰常见合并症的治疗
心衰患者常伴有多种心血管(如心律失常、慢性冠状动脉综合征、瓣膜性心脏病、高血压、卒中)和非心血管(如糖尿病、甲状腺疾病、肥胖、缺铁性贫血、肾功能不全、电解质紊乱、肺部疾病、高脂血症、痛风与关节炎、勃起功能障碍、抑郁障碍、恶性肿瘤、感染等)系统合并症[1-3]。合并症导致心衰患者基础情况较差,且与不良预后明显相关。因此,基于改善患者预后这一目标,治疗不应局限于心衰本身,而应同时积极治疗各种合并症。目前各指南中对于并发症的治疗均有较为详细的阐述,在临床工作中也应积极开展多学科合作,以期为患者制定最佳的治疗方案。
8 慢性心衰患者的日常随访和管理
心衰患者的管理需要在以患者为中心,以预防疾病发展、控制症状、提升生活质量为目标,以多学科合作为依靠的模式下共同进行,包括对患者的生活方式、药物选择、辅助设备的优化;加强患者自我管理与症状识别方面的教育,提高依从性;定期随访,并根据患者情况灵活调整治疗方案等。此外,运动康复及心理治疗对于提高患者的预后也是必不可少的一部分[1,3]。
9 结语
心脏病学泰斗Eugene Braunwald教授认为,心衰是21世纪心血管领域最后亟待攻克的两大堡垒之一。漫漫40余年,慢性心衰的治疗从“强心、利尿、扩血管”,逐步发展至面向神经内分泌功能失调、心室重构,再到植入型电子器械辅助治疗,心衰理念一次次革新的背后是无数医学科学家对于发病机制的不断探寻,也由许多严谨而精密的临床研究的铺就。如今站在巨人的肩膀上,一个更宏大的心衰研究世界正在展开,更多的可能性正等待着我们去探寻,这里面也许有免疫、干细胞、基因编辑与靶向治疗,也会有更多的机器辅助装置。相信经过一代代医者的不懈努力,心衰这个终极难题终会迎来更加完善的解决方案。
