1株人源抑制致病菌的粪肠球菌性能评价
2022-08-18唐乐邓淑芬秦嫚嫚江友裘梁
唐乐 邓淑芬 秦嫚嫚 江友 裘梁,*
(1 江西中医药大学 医学转化中心,南昌 330006;2 江西中医药大学 江西省中药防治血管重塑相关疾病重点实验室,南昌 330006;3 深圳市宝安区石岩人民医院,深圳 518108)
肠道微生态与肠道菌群有着直接联系,肠道菌群的种类及数量直接影响着肠道微生态的改变。肠道菌群可以分为益生菌、致病菌和条件致病菌。常见的益生菌有双歧杆菌和乳酸杆菌等,是一类可以通过调节肠道菌群平衡来对宿主产生有益作用的活的微生物。如,它具有缓解便秘[1]、治疗非酒精性脂肪性肝病[2]、改善中枢神经系统疾病及精神疾病[3]和预防肿瘤[4]等作用。条件致病菌则是指与宿主间的生态平衡在某些情况下被打破,形成生态失调而导致疾病发生的正常菌群,如人体共生菌之一的肠球菌即是一种条件致病菌。由于菌株差异,肠球菌具有益生和潜在致病双重性。一方面肠球菌在机体内发挥着重要的益生功能,能够调整肠道菌群微生态平衡,促进肠道环境健康[5]。另一方面,肠球菌也具有潜在的致病性。临床实验证实,肠球菌不仅可引起皮肤创伤和尿路感染,而且可能引发新生儿早产[6]、新生儿极低体重[7]、新生儿脑膜炎[8]和新生儿败血症[9]等。粪肠球菌是肠球菌的一种,它是一种革兰阳性细菌,一般没有荚膜。它存在于人体的口腔、呼吸道、肠道、泌尿道和生殖道。它可以作为益生菌使用,抑制其他病原菌的生长,调节肠道微环境,在调节人体免疫方面发挥重要作用[10-11]。本研究从健康成人粪便分离出一株能产生抑菌圈的粪肠球菌,评价了其耐酸耐胆盐能力、抗生素敏感性和拮抗致病菌等生物学特性,从而为该菌株做微生态制剂防治致病菌方面提供理论依据。
1 材料与方法
1.1 材料
1.1.1 样品及细胞
粪便样品取自健康成人。人结直肠腺癌细胞(Caco-2)来自本实验室保存。
1.1.2 指示菌
粪肠球菌(Enterococcus faecalis)V583、产气肠杆菌(Enterobacter aerogenes)ZDY01、植物乳杆菌(Lactobacillus plantarum)ZDY04、干酪乳杆菌(Lactobacillus casei)ZDY08、嗜热链球菌(Streptococcus thermophilus)、鼠李糖乳杆菌(Lactobacillus rhamnosusGG)均来自本实验室保存。
1.1.3 主要试剂
MRS固体培养基、MRS肉汤培养基、脑心浸液肉汤(BHI)、牛胆盐购自北京索莱宝科技有限公司;DMEM培养基、PBS和胎牛血清购自北京海克隆生物化学制品有限公司;甘油购自西陇化工股份有限公司;抗生素药敏试纸片购自杭州微生物试剂有限公司;肠球菌编码鉴定盒购自杭州滨和微生物有限公司。
1.2 实验方法
1.2.1 菌株的分离、筛选
将4.5 g粪便样品溶解至30 mL MRS肉汤培养基,梯度稀释到1×10-6涂布至MRS固体培养基表面,37℃厌氧培养48 h,挑选产生抑菌圈的单个菌落接种至1 mL MRS液体培养基中,37℃厌氧培养24 h,将培养后的菌液再次涂布至MRS固体培养基表面,得到纯的菌株。同时,将菌株用20%甘油冻存于-80℃冰箱。
1.2.2 菌株的鉴定
(1)生化鉴定 根据肠球菌成套编码鉴定盒说明书对菌株进行生理生化鉴定,参照编码手册进行鉴别。
(2)16S rDNA鉴定 将菌株用MRS固体培养基活化之后,接种于MRS液体培养中,37℃过夜培养,12000 r/min离心5 min,收集菌体。采用细菌基因组DNA提取试剂盒(生工生物工程(上海)股份有限公司)提取基因组DNA。以基因组DNA为模板,细菌16S rDNA的通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-CTACGGCTACCTTGTTACGA-3')进行PCR扩增16S rDNA序列,PCR反应条件为:94℃预变热5 min;94℃变性1 min,56℃退火30 s,72℃延伸2 min,循环30次;72℃延伸10 min。琼脂糖凝胶电泳检测:利用2% 琼脂糖对PCR产物进行检测,每孔加入反应产物5 μL,电压120 V,电泳时间 20 min,电泳结束后,利用凝胶成像仪进行观察。并将PCR产物送至生物工程(上海)股份有限公司进行测序。
(3)系统发育树构建 将测序序列与Genebank数据库中的相关菌16S rDNA序比对,并用MEGA 7.0软件构建系统发育树确定菌株的种属。
1.2.3 毒力基因鉴定
将QT01菌株用MRS固体培养基活化之后,接种于MRS液体培养中,37℃过夜培养,12000 r/min离心5 min,收集菌体。采用细菌基因组DNA提取试剂盒[生工生物工程(上海)股份有限公司]提取基因组DNA。以基因组DNA为模板,分别以efαM、efαS、hyi、gei、ccf、cob、cyiA、cyiB、cyiM、cpd、esp和agg引物进行PCR扩增,PCR反应条件为:94℃预变热5 min;94℃变性1 min,56℃退火30 s,72℃延伸2 min,循环30次;72℃延伸10 min。琼脂糖凝胶电泳检测:利用2% 琼脂糖对PCR产物进行检测,每孔加入反应产物5 μL,电压120 V,电泳时间 20 min,电泳结束后,利用凝胶成像仪进行观察。
1.2.4 药敏试验
采用K-B纸片扩散法[12],测定分离菌QT01对 14种常见抗生素的药敏试验。将QT01菌接种到 BHI 液体培养基中,37℃ 过夜厌氧培养。取500 μL QT01菌液离心(8000 r/min,3 min),菌体经PBS洗涤2次,重悬于PBS中,将细菌浓度稀释至1×106CFU/mL,取100 μL涂布于BHI固体平板上,晾干,用镊子将药敏纸片贴于培养基表面,放置于37℃培养箱厌氧培养24 h,用游标卡尺测量抑菌圈的大小。抑菌圈大小按2016年美国临床和实验室标准协会(clinical and laboratory standards institute,CLSI)制订的标准进行供试菌及药物敏感性鉴定和判断。
1.2.5 耐胆盐试验
将QT01菌株接种于BHI液体培养基中,置于37℃培养箱过夜厌氧培养,分别配制不含牛胆盐及含0.3%、0.5%和1%牛胆盐的BHI液体培养基。将培养后的QT01菌液以1:100的比例加入到不含牛胆盐及含有不同浓度牛胆盐的BHI液体培养基中,每个浓度做3个复孔,放至37℃厌氧培养箱,分别在0、4、8、12和24 h检测培养液A600值,并进行平板计数。
1.2.6 耐酸试验
将QT01菌株接种于BHI液体培养基中,置于37℃培养箱过夜厌氧培养。用0.1 mol/L HCL将BHI液体培养基pH值分别调成2.0、3.0、4.0、5.0和6.0,分别取不同pH值的培养基10 mL分装到15 mL的离心管中,每个pH值做3个复孔,在每个管中加入100 μL QT01菌液,放至 37℃培养箱厌氧培养,分别在0、2、4、6、8、10和12 h时进行平板计数。
1.2.7 模拟胃肠道试验
人工胃液制备[13]:含7 mmol/L NaCl、 7 mmol/L KCl、 45 mmol/L NaHCO3、0.30%胃蛋白酶,以0.1 mol/L HCl 调 pH至2.5,过滤除菌备用。人工肠液制备[13]:含0.1 g/L胰蛋白酶、3 g/L牛胆盐、0.835 g/L KCl、6.5 g/L NaCl、0.22 g/L CaCl2、1.386 g/L NaHCO3,以0.1 mol/L HCl调 pH至7.5,过滤除菌备用。将QT01菌株接种于BHI液体培养基中,置于37℃培养箱过夜厌氧培养,取500 μL QT01菌液离心(12000 r/min,10 min),弃上清,菌体重悬于10%脱脂乳中。取100 μL菌悬液与10 mL的人工胃液或人工肠液混合后,37℃厌氧培养,分别在0和2 h取样检测培养液A600值,并进行平板计数。
1.2.8 抑菌试验
QT01菌株充分活化后,以1%接种量接种于MRS培养基中,37℃厌氧培养。取屎肠球菌Ab、 屎肠球菌As、粪肠球菌V583、 产气肠杆菌ZDY01、植物乳杆菌ZDY04、干酪乳杆菌、 嗜热链球菌、 鼠李糖乳杆菌作为指示菌,分别将菌体量为1×106CFU的指示菌涂布于MRS固体平板上,静置晾干。用移液枪吸取2 μL过夜培养的QT01菌液(菌体量约为1×105CFU) 滴至MRS固体平板 (每个平板5滴) 。置于37 ℃培养箱厌氧培养20~24 h,用游标卡尺测量抑菌圈的大小。
1.2.9 黏附能力及抑菌能力测定
Caco-2细胞经活化后,按1×105个细胞/孔的细胞量铺至24孔板,以DMEM培养基(不含双抗)培养,置于37℃、5%CO2条件下培养至单层达98%。QT01过夜培养后,无菌PBS清洗两次,重悬于DMEM培养基(不含双抗),将125 μL QT01菌悬液(浓度约1×108CFU/mL)与Caco-2细胞共孵育2 h后,PBS洗去未黏附的细菌,经含0.25% EDTA的胰酶消化后,收集细胞悬浮液,涂布于BHI固体培养基上,置于37℃培养箱厌氧培养12 h,计算平板上菌落数。采用同样方法制备致病菌V583菌悬液,抑制V583实验通过3种方式进行:①竞争试验:QT01菌与致病菌V583同时与Caco-2细胞共孵育2 h。②排斥试验:QT01菌与Caco-2细胞共孵育1 h后,PBS洗去未黏附的细菌,再加入致病菌V583共孵育1 h。③置换试验:致病菌V583与 Caco-2 细胞共孵育1 h后,PBS洗去未黏附的细菌,再加入QT01菌共孵育1 h。最后,PBS洗去未黏附的细菌,经0.25% EDTA的胰酶消化后,收集溶液,涂布于BHI固体培养基上,置于37℃培养箱厌氧培养12 h,计算平板上菌落数。
1.3 数据处理
采用Graphpad Prism version 8.4.3软件和SPSS 20.0软件进行数据分析,所得数据均表示为均值±标准差(±s),采用单因素和两因素方差分析法 (ANOVA)比较组间显著性差异,用Tukey' spost hoc 进行检验。P<0.05表示差异有统计学意义。
2 结果
2.1 菌株分离与鉴定
PYR、VP、蔗糖、精氨酸、MAG、蕈糖、蔗糖和山梨醇试验为阳性;DPP、PMG和TMZ为阴性。参考编码手册,该分离菌株与粪肠球菌一致,故初步判定为粪肠球菌,详见表1。
将来源于健康成人的粪便经梯度稀释后,涂布于MRS固体培养基上,37℃过夜厌氧培养后,MRS固体培养基上出现一具有显著透明圈菌株,将其命名为QT01,该菌落形态为圆形、边缘整齐、表面光滑、白色菌落,菌落直径1.0~2.0 mm。另随机挑取QT01周围的2个菌落,分别命名为Ab和As。对3株菌进行16S rDNA基因序列的测定及与GenBank核酸数据库比对分析,结果表明QT01为粪肠球菌,Ab和As分别为屎肠球菌。生理生化鉴定结果见表1。通过与粪肠球菌模式菌株生理生化特征进行对比,可初步确定QT01为粪肠球菌。进一步将QT01、Ab和As与肠球菌属其他菌株进行系统进化树分析,结果如图1所示,QT01与肠球菌属其他粪肠球菌进化水平相当,与里氏肠球菌S299株和肠道共生性肠球菌LMG7937株等关系接近。Ab和As均为屎肠球菌。
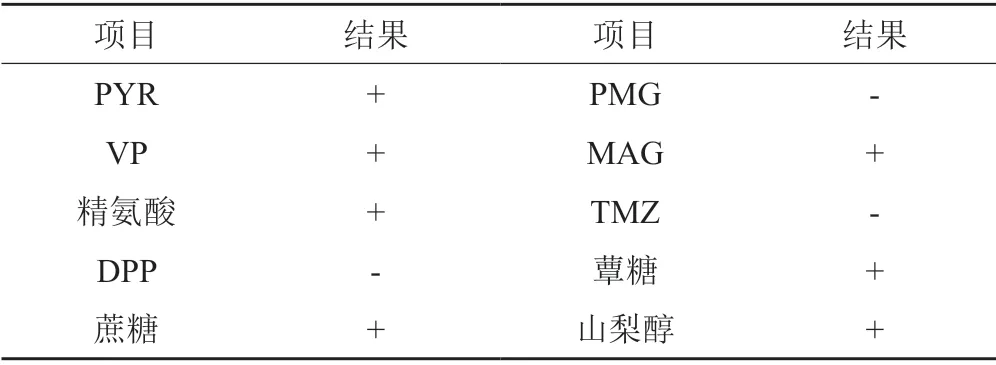
表1 分离菌生化特性试验结果Tab.1 Results of the biochemical characteristics test of the isolate
2.2 粪肠球菌毒力基因鉴定
采用表2中引物,PCR扩增QT01毒力基因,结果如图2所示。QT01含毒力基因agg,cylA,esp,efaS,cpd和cob,且大小与理论值相符,但不含毒力基因gelE,cylM,cylB,ccf和hyl。

表2 粪肠球菌毒力基因及引物Tab.2 Enterococcus faecalis virulence genes and primers
2.3 药敏试验结果
根据药敏试验获得的药敏环直径大小判断QT01对抗生素的敏感性,结果显示:QT01对阿莫西林、青霉素、氯霉素、环丙沙星和万古霉素敏感;对利福平、庆大霉素和链霉素中度敏感;对四环素、卡那霉素、杆肽菌、多黏菌素B、红霉素和头孢西丁耐药。说明QT01对大部分常见抗生素敏感。具体结果见表3。
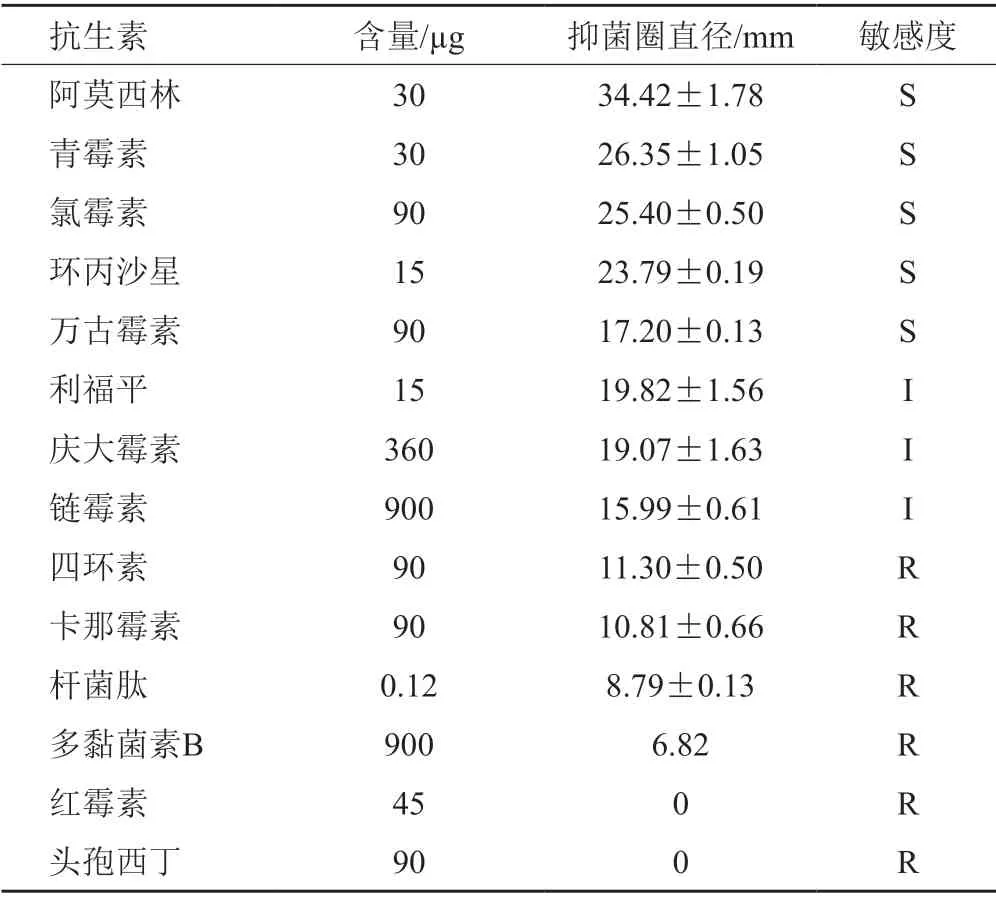
表3 QT01药敏试验结果Tab.3 Results of drug sensitivity test of QT01
2.4 抑菌试验结果
为进一步确定QT01是否能抑制其他致病菌生长,将QT01与其他菌相互作用。从表4可以看出,QT01对条件致病菌V583、As、Ab和ZDY01等菌株都有不同程度的抑制作用,其中对V583的抑菌圈直径为(1.59±0.51) mm,抑菌效果最好;对As、Ab和ZDY01的抑菌圈直径分别为(1.01±0.22) mm,(0.824±0.206) mm,(0.634±0.266) mm,抑菌效果次之;此外,QT01对益生菌ZDY04的抑菌圈直径为(0.345±0.025) mm,抑菌效果较弱,而对益生菌Streptococcus thermophilus和Lactobacillus rhamnosusGG的抑菌效果并不明显。以上结果表明QT01能抑制条件致病菌,而不能抑制益生菌的生长(图3)。
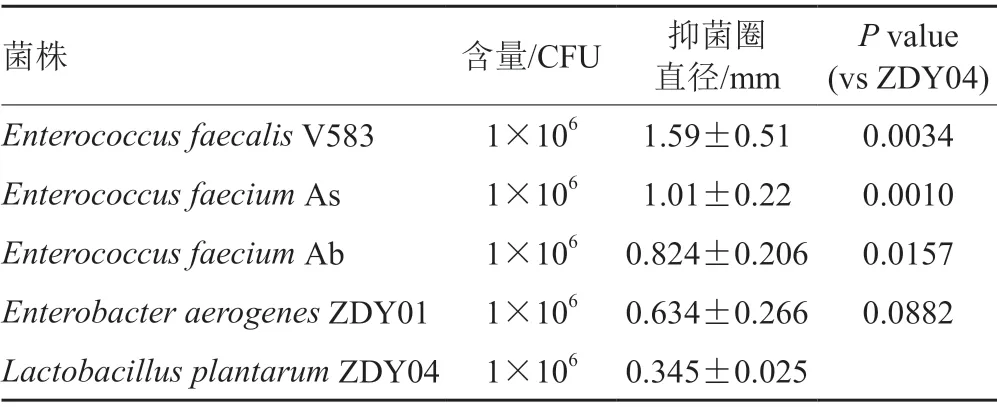
表4 QT01抑菌试验结果Tab.4 Results of Bacteriostatic Test of QT01
2.5 细胞黏附试验结果
以粪肠球菌V583为指示菌,采用竞争、排斥和替换3种方式进行实验考察QT01拮抗V583黏附肠上皮细胞作用。结果如表5所示:与对照组相比,在竞争实验中, QT01 显著抑制了粪肠球菌V583对Caco-2细胞的黏附;但在排斥和替换试验中, QT01对V583 黏附Caco-2细胞的能力并无明显影响。
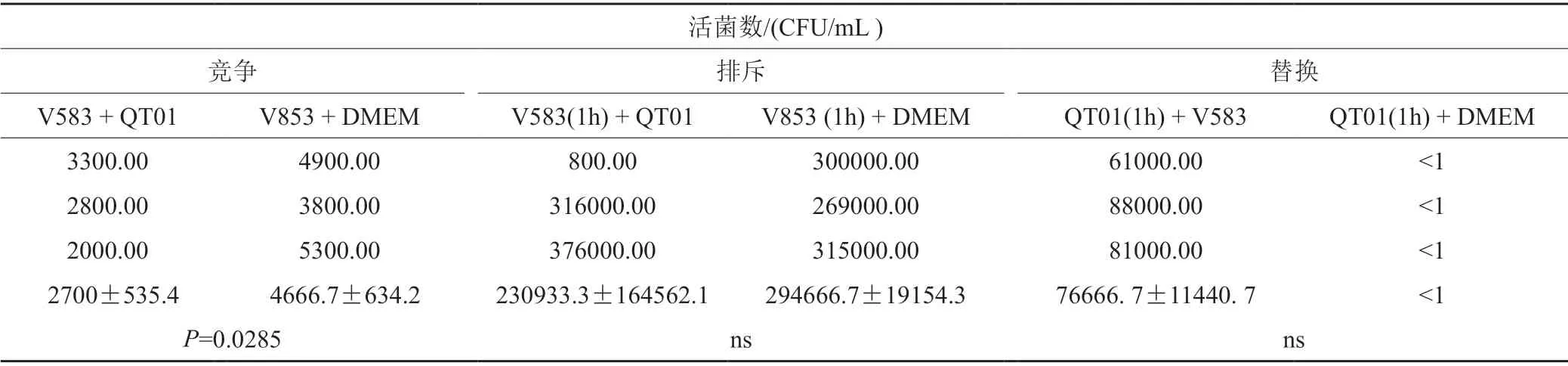
表5 QT01对 V583的黏附拮抗作用Tab.5 Adhesion antagonism of QT01 to V583
2.6 耐酸试验结果
将QT01分别接种于不同p H值( 2.0、3.0、4.0 、5.0和6.0)的BHI液体培养基中厌氧生长12 h,随后进行平板菌落计数。结果如图4所示:在pH 6.0时,QT01仍保持一定的生长速度,而在pH≤5.0时,QT01几乎不能生长。
2.7 模拟胃肠道试验结果
我们采用模拟胃肠液确定QT01菌株耐受胃肠道能力。如图5所示,QT01在模拟胃液中维持初始活菌计数水平。而在模拟肠液中,2 h后的QT01的活菌计数增加了1.902×108CFU/mL,提高了1.2倍。因此,QT01虽不能在胃液中增殖,但能耐受胃液2 h,同时亦能耐受肠液。
2.8 耐胆盐试验结果
将QT01接种于含不同胆盐浓度(0.3%、0.5%和1%)的BHI液体培养基中,考察其胆盐耐受能力。结果如图6所示:与不加胆盐的对照组相比,QT01在0.3%、0.5%和1%胆盐浓度下处理4 h后生长速度较慢,但在8 h后各实验组与对照组间已无明显差异。说明在胆盐环境中并不会影响QT01菌株的生长,其具有耐胆盐特性。
3 讨论和结论
本实验以成人粪便分离出的粪肠球菌QT01为研究对象,通过耐酸、耐胆盐、药敏试验、模拟胃肠道实验和抑菌试验等表明该菌株耐酸但不能在酸性条件增殖,耐胆盐并能增殖;对常见抗生素如阿莫西林、青霉素、氯霉素和环丙沙星等敏感;能抑制粪肠球菌致病株V583和产气肠杆菌,但不能抑制植物乳杆菌和嗜热链球菌。不同菌株具有不同的抑菌物质,其抑菌机理也并不相同。Claes等[15]称,LGG对沙门菌的强烈抑制作用来自乳酸的积累。Vimont等[16]研究发现屎肠球菌LCW44对单核细胞李斯特菌的抑制是由于细菌素的产生。同时,有研究表明菌体的自聚集与致病菌的共聚集效应对抑菌活性也起到了一定的作用。然而本文所涉及的粪肠球菌QT01究竟是通过何种机理产生抑菌作用还有待进一步研究。
能够抵抗较强的酸性环境是外源菌体能在肠道中存活和发挥作用的先决条件。胃液pH会随着饮食结构的变化而出现波动,pH通常为3左右[17],空腹食用酸性食品可达1.5,食用碱性食品可达4~5,且食物尤其是流食通过胃的时间相对较短,一般1~2 h[18]。本实验中Enterococcus faecalisQT01经 pH2、3、4、5和6的培养基处理12 h后,菌株仅在pH6条件下维持一定的生长能力,pH2、3、4和5均无法正常生长。模拟胃肠道实验也证明,QT01在人工胃液处理2 h后,活菌数量虽没有发生明显变化,但仍能存活。因此,研究者判断该粪肠球菌菌株QT01能够耐受胃内低酸环境,但不能在酸性环境下增殖。将在下一步研究中拟对pH<5条件培养的细菌移除酸性条件进行培养,以判断其是否能耐受酸性环境。
外源菌体被食入人体后,不仅要抵抗胃液,还要抵抗具有抑菌作用的胆盐。高浓度胆盐形成的渗透压使肠液内的微生物质壁分离从而抑制其生长。人体小肠中胆汁盐的含量在0.03%~0.3%范围波动,只有具有较强耐胆汁盐能力的菌株才能顺利通过小肠而到达大肠[19]。本试验中粪肠球菌经质量分数为0.3%、0.5%和1%的胆盐处理4 h后平均活菌数密度分别为 4.24×109、3.92×109和3.29×109CFU/mL,8 h时活菌数达到峰值,分别为9.44×109、9.99×109和9.57×109CFU/mL,说明粪肠球菌不仅能够耐受高胆盐,还能在高胆盐环境下增殖。
耐万古霉素肠球菌是引起院内感染的主要因素之一[20-21],而采用抗生素治疗会导致肠内耐万古霉素肠球菌增殖,使患者更容易发生血液感染[22]。其中,肠球菌约占感染性心内膜炎病原菌的5%~15%,也有少数病例报道早产儿败血症和脑膜炎中也检测到粪肠球菌和屎肠球菌。Enterococcus faecalisQT01除对红霉素和头孢西丁有耐药性外,对其他抗生素均敏感。此外,QT01能够有效抑制如粪肠球菌致病菌V583等肠球菌的生长,文献报道粪肠球菌产生的细菌素能抑制革兰阳性细菌如梭状芽胞杆菌、李斯特菌、葡萄球菌和乳酸杆菌等[16,23],但对于QT01是否通过分泌的抑菌物质抑制V583增殖以及是否在体内能有效缓解万古霉素抗性肠球菌引起的感染有待进一步研究。
综上所述,Enterococcus faecalisQT01具有很好的耐酸、耐胆盐和抑菌生物学特性,或可将其作为微生态制剂使用[25]。
