米黑根毛霉甘露聚糖酶的定向进化、高效表达与应用
2022-08-17李延啸马俊文闫巧娟江正强
李延啸, 马俊文, 闫巧娟, 武 建, 张 伟, 江正强
(1. 中国农业大学 工学院/中国轻工业食品生物工程重点实验室, 北京 100083;2. 北京瓜尔润科技股份有限公司,北京 100101;3. 中国农业大学 食品科学与营养工程学院,北京 100083;4. 南京财经大学 食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心,江苏 南京 210023)
魔芋粉是一种来源于魔芋(Amorophophallus konjac)块茎的天然植物胶,具有多种功能活性,如控制餐后血糖、增强饱腹感、润肠通便等,被国际上誉为“十大健康食品”之一[1]。 魔芋粉具有良好的持水力、增稠性和稳定性,广泛用于多种食品中,以改善食品品质。 魔芋粉的主要成分是葡甘露聚糖,是一种由葡萄糖和甘露糖 (物质的量比为1.0∶1.6)通过β-1,4-糖苷键连接而成的线性多糖,可作为生产甘露寡糖的重要原料[2]。 魔芋粉在低浓度下即可形成高黏度凝胶状溶液,阻碍了水解时体系内分子移动和传质传热,严重降低了魔芋甘露寡糖的生产效率[3]。 因此,需要开发一种能够高效水解高浓度魔芋粉的生产方法,以提高魔芋甘露寡糖的生产效率。
与化学和物理降解法相比,酶法水解魔芋粉生产甘露寡糖具有条件温和、过程可控、绿色环保等多种优势, 是最具应用潜力的甘露寡糖生产方法。酶法生产过程中,最重要的酶是甘露聚糖酶(mannanase,EC 3.2.1.78), 能够随机水解甘露聚糖主链中的β-1,4-糖苷键,产生低聚合度的甘露寡糖[4]。 目前,已有一些甘露聚糖酶用于水解魔芋粉生产甘露寡糖,但这些甘露聚糖酶水解时所用底物浓度通常较低。例如白曲霉(Aspergillus kawachii)来源的甘露聚糖酶水解10 mg/mL 魔芋粉, 可以产生聚合度2~4的甘露寡糖,产物重均分子量约为2 000[5];枯草芽孢杆菌 (Bacillus subtilis) 来源的甘露聚糖酶水解50 mg/mL 魔芋粉,可以产生聚合度大于2 的一系列甘露寡糖[6]。 因此,发掘一种能够高效水解魔芋粉的甘露聚糖酶,对魔芋甘露寡糖的工业化生产至关重要。
定向进化、理性设计等分子改造手段是提高甘露聚糖酶酶学性质和催化效率的有效手段。 白曲霉甘露聚糖酶通过理性设计实现了分子改造,所得突变体D273-V308 的最适温度提高了5 ℃,75 ℃下的半衰期增加了73.9%[7]。 通过理性设计对黑曲霉(A. niger)甘露聚糖酶进行了分子改造,使其水解特性发生明显改变,产物中高聚合度的寡糖组分含量明显增多[8]。 通过定向进化对米黑根毛霉(Rhizomucor miehei)甘露聚糖酶进行了分子改造,所得突变体与野生型甘露聚糖酶相比, 最适pH 降低2.5,最适温度提高10 ℃, 在酸性高温下的催化效率提高3 倍以上[9]。 此外,高产的甘露聚糖酶是工业化生产甘露寡糖的前提与基础。 目前,已有一些甘露聚糖酶在毕赤酵母(Pichia pastoris) 中实现了高效表达,如来源于樟绒枝霉和枯草芽孢杆菌的McMan5B和Bman26-MEIR[10-11]。 由于水解特性和催化效率不足,这些甘露聚糖酶不适合用于水解魔芋粉生产甘露寡糖。 因此,对现有甘露聚糖酶进行分子改造,实现甘露聚糖酶的高效表达,提高其对魔芋粉的水解效率,对魔芋甘露寡糖的工业化生产具有重要意义。
米黑根毛霉是一种重要的丝状真菌,能够产生多种脂肪酶、蛋白酶和半纤维素酶[12-14]。 作者所在团队前期研究中,从米黑根毛霉中发掘了一个糖苷水解酶(glycoside hydrolase,GH)5 家族的甘露聚糖酶,该酶具有优良的酶学特性和水解特性,水解魔芋粉主要产生聚合度2~5 的甘露寡糖,在魔芋甘露寡糖生产中具有良好的应用潜力[15]。 作者通过定向进化技术对该酶进行分子改造,以期提高该酶对魔芋粉的水解效率, 并将该酶在毕赤酵母中高效表达,为魔芋甘露寡糖的高效生产提供依据。
1 材料与方法
1.1 菌种与质粒
1.2 试剂与仪器
甘露寡糖(甘露二糖、甘露三塘、甘露四糖、甘露五糖、甘露六糖)、DP10 葡聚糖:爱尔兰Megazyme公司产品;槐豆胶(LBG):美国Sigma-Aldrich 公司产品;魔芋粉(葡甘露聚糖质量分数≥80%,甘露糖与葡萄糖物质的量比为1.62∶1.00): 湖北强森魔芋科技有限公司产品;其他试剂均为市售国产分析纯。
1260 Infinity II system 高效液相色谱仪、G7162A 型示差折光检测器: 美国Agilent 公司产品;Shodex Sugar KS-802 色谱柱:日本Shodex 公司产品;ÄKTA 蛋白纯化系统: 美国GE Healthcare 公司产品;100 L 发酵罐:上海国强生化工程装备有限公司产品。
1.3 甘露聚糖酶(RmMan5A)突变体文库构建
易 错 PCR 利 用 引 物RmMan5AF(CGCGGATCCGCTTCTTCGTTTGTCCAGACAAG)和RmMan5AR (CCGCTCGAGCTACTTCTTGGCCATGG CATCAGC), 以质粒pET-28a-RmMan5A为模板进行扩增。 产物经1 g/dL 琼脂糖凝胶回收后,用DNaseI 进行随机片段化处理, 随后用过酚/氯仿/异戊醇(体积比为25∶24∶1)和氯仿/异戊醇(体积比为24∶1)两步抽提纯化,得到随机片段化后的DNA 片段。 以上述DNA 片段为模板,进行无引物重叠延伸PCR,得到重叠延伸PCR 产物。 再以上述重叠延伸PCR 产物为模板, 使用引物RmMan5AF 和RmMan5AR 进行PCR 扩增。 PCR 扩增产物经限制性内切酶BamH I 和XhoI 双酶切,与载体pET-28a连接后电转化大肠杆菌BL21(DE3),即得到甘露聚糖酶(RmMan5A)突变体文库。
1.4 甘露聚糖酶(RmMan5A)突变体文库高通量筛选
甘露聚糖酶(RmMan5A)突变体文库的高通量筛选分为初筛和复筛。 首先,使用LBG-刚果红平板法对突变体文库进行初筛,筛选具有甘露聚糖酶活性的阳性克隆。 再利用LB 摇瓶培养基对阳性克隆进行复筛:将初筛获得的阳性克隆接种于10 mL LB培养基中, 在37 ℃、200 r/min 下培养至发酵液在600 nm 处的吸光度(OD600)达0.6~0.8,加入终浓度为1 mmol/L 的IPTG, 在30 ℃、200 r/min 下继续培养4 h 诱导菌株产酶,离心(10 000g、5 min)收集菌体,经超声破壁获得阳性克隆的粗酶液,测定粗酶液在pH 7.0、55 ℃下对魔芋粉的比酶活力, 并以比酶活力有所提高的突变体为正向突变体。
1.5 甘露聚糖酶突变体(RmMan5AM2)在大肠杆菌中表达与纯化
重组大肠杆菌接种于10 mL 含有50 μg/mL 卡那霉素的LB 培养基中, 在37 ℃、200 r/min 下培养过夜制备种子液。种子液以体积分数1%接种量接种于200 mL 相同的LB 培养基中,在相同条件下培养至发酵液OD600达0.6~0.8 后, 加入终浓度为1 mmol/L 的IPTG,在30 ℃、200 r/min 下诱导过夜。离心(10 000g、5 min) 收集菌体, 并用缓冲液A(20 mmol/L 磷 酸 缓 冲 液、pH 8.0,300 mmol/L NaCl,20 mmol/L 咪唑)悬浮菌体,超声破壁,离心(10 000g、10 min)收集上清液(即粗酶液)。
利用Ni-NTA 亲和层析柱对甘露聚糖酶进行纯化。用缓冲液A 平衡亲和层析柱,粗酶液以0.5 mL/min的流量上样,分别用缓冲液A 和B(20 mmol/L 磷酸缓冲液、pH 8.0,300 mmol/L NaCl,50 mmol/L 咪唑)洗脱5 个柱体积,再用缓冲液C(20 mmol/L 磷酸缓冲 液、pH 8.0,300 mmol/L NaCl,200 mmol/L 咪 唑)洗脱目的蛋白。 洗脱过程在ÄKTA 蛋白纯化系统上进行,流动相流量为1.0 mL/min。收集有酶活的组分后,在50 mmol/L 柠檬酸-磷酸缓冲液(pH 7.0)中低温透析过夜,用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析蛋白质纯度。
肇庆市政府指定疏浚物处理项目由肇庆市国资委管理,肇庆市国资委委托城投公司组织公开招投标。最终,方少瑜名下的广州市安邦装饰工程有限公司以约6500万元中标。
1.6 甘露聚糖酶酶活力和蛋白质质量浓度测定
甘露聚糖酶酶活力的测定采用3,5-二硝基水杨 酸 法 (DNS 法)[16], 以0.5 g/dL 槐 豆 胶 溶 液(50 mmol/L 柠檬酸-磷酸缓冲液、pH 7.0)作为底物,900 μL 底物与100 μL 用50 mmol/L 柠檬酸-磷酸缓冲液(pH 7.0)适当稀释后的酶液混合在55 ℃下反应10 min。加入1 mL DNS 试剂,沸水浴15 min 后加入1 mL 40 g/dL 酒石酸钾钠,冷却至室温后在540 nm下测定吸光度。 以甘露糖为标准计算反应生成还原糖的含量。 在上述反应条件下,每分钟释放1 μmol还原糖所需要的酶量为一个酶活力单位(U)。
酶液中蛋白质质量浓度的测定采用Lowry 等的方法,以牛血清白蛋白(BSA)为标准蛋白质[17]。
1.7 甘露聚糖酶突变体(RmMan5AM2)的酶学性质
1)最适pH 和pH 稳定性的测定 在不同pH 下按照标准方法测定突变体酶活力, 以最大值为100%,计算各pH 下的相对酶活力。所用缓冲液(50 mmol/L)包括柠檬酸-磷酸缓冲液(pH 3.0~7.0)、醋酸缓冲液(pH 4.0~6.0)、磷酸缓冲液(pH 6.0~8.0)、Tirs-HCl 缓冲液 (pH 7.0~9.0)、CHES 缓冲液(pH 8.0~10.0) 和甘氨酸-氢氧化钠缓冲液 (pH 9.5~11.0)。用上述缓冲液适当稀释酶液后,置于50 ℃下处理30 min, 按照标准方法测定不同pH 下的残余酶活力,以未经处理的酶液为对照。
2)最适温度和温度稳定性的测定 在30~90 ℃下按照标准方法测定突变体酶活力, 以最大值为100%,计算不同温度下的相对酶活力。用50 mmol/L柠檬酸-磷酸缓冲液(pH 7.0)将酶液适当稀释后在不同温度下保温30 min,按照标准方法测定不同温度下的残余酶活力,以未经处理的酶液为对照。
3)底物特异性的测定 以0.5 g/dL 槐豆胶、魔芋粉、瓜尔胶为底物,按照标准方法测定甘露聚糖酶酶活力。 槐豆胶为底物时测定的酶活力为100%,分别计算甘露聚糖酶对不同底物的相对酶活力。
4)动力学参数的测定 以不同质量浓度槐豆胶(1.0~6.0 mg/mL)、魔芋粉(9.0~35.0 mg/mL)和瓜尔胶(3.0~14.0 mg/mL)为底物,与适当稀释后的酶液混合均匀后,在最适条件下反应5 min,按照标准方法测定酶活力。利用Grafit 软件计算米氏常数Km和最大反应速率Vmax。
1.8 甘露聚糖酶突变体(RmMan5AM2)在毕赤酵母中表达和高密度发酵
PCR 扩增甘露聚糖酶突变体基因(RmMan5AM2)时,以RmMan5AM2F(CCATGTACG TAGCTTCTTCGTTTGTCCAGACAAG) 和RmMan5AM2R(CCGCCTAGGCTACTTCTTGGCCAT GGCATC)为引物,以质粒pET-28a-RmMan5AM2为模板。 扩增产物用1 g/dL 琼脂糖凝胶回收纯化后,利用限制性内切酶SnaB I 和AvrII 双酶切, 与载体pPIC9k 连接后获得质粒pPIK9k-RmMan5AM2。将上述质粒用限制性内切酶SalI 线性化后电转化毕赤酵母GS115,获得重组菌株。
在不同质量浓度遗传霉素G418(1.0~4.0 mg/mL)下,对重组菌株进行高拷贝筛选,选取摇瓶发酵酶活力最高的重组菌株在100 L 发酵罐中进行高密度发酵,整个过程包括种子液培养、分批发酵培养、甘油流加培养、100%甲醇诱导培养。 将酶活力最高的重组菌株接种于200 mL BMGY 培养基中, 在30℃、200 r/min 下培养过夜, 接种于3 L BMGY 培养基中,在相同条件下培养至OD600达10.0,得到种子液。种子液接种于装有30 L BSM 培养基的100 L发酵罐内, 在30 ℃、pH 4.0、600 r/min 下发酵至罐内甘油耗尽后,开始流加50%(体积分数)甘油4~5 h;待发酵液OD600达180 后,停止流加甘油饥饿30 min;随后流加100%甲醇诱导培养基,在30 ℃、pH 6.0、800 r/min 下继续发酵168 h; 于不同时间点取样,分析发酵液中甘露聚糖酶酶活力、蛋白质质量浓度和菌体质量浓度(单位体积发酵液酵母的湿质量)的变化。
1.9 甘露聚糖酶突变体(RmMan5AM2)水解魔芋粉
甘露聚糖酶突变体以300 U/mL 加入500 mL柠檬酸-磷酸缓冲液(50 mmol/L、pH 7.0)中,在搅拌下加入150 g 魔芋粉, 置于50 ℃、200 r/min 下水解8 h,再沸水浴灭酶20 min,离心(10 000g、10 min)后取上清液冻干后即为魔芋甘露寡糖。
魔芋甘露寡糖(10 mg/mL)过膜(0.22 μm)后,用高效液相色谱- 示差折光检测器(high performance liquid chromatography - differential refractive index detector,HPLC-RID)进行分析,色谱柱为Shodex Sugar KS-802(7.8 mm× 300 mm),柱温为65 ℃,流动相为纯水,流量为0.6 mL/min,以甘露糖、甘露二糖、甘露三糖、甘露四糖、甘露五糖、甘露六糖和葡聚糖(PD10)为标准品。
2 结果与讨论
2.1 甘露聚糖酶(RmMan5A)突变体文库的高通量筛选
甘露聚糖酶突变体文库含有12 000 多个克隆,随机挑选10 个克隆进行测序分析, 结果表明该突变体文库中的基因突变率为0.72%, 这一突变率略高于定向进化的推荐突变率 (2~5 bp/kp)[18]。 利用LBG-刚果红初筛培养基对突变体文库进行初筛,30%以上的克隆能够形成清晰的透明圈, 即可以产生有活性的甘露聚糖酶。其中,894 个克隆形成了能够准确测量直径的透明圈(≥3 mm)。 随后,对上述894 个克隆进行复筛, 测定其最适催化条件和对魔芋粉的比酶活力,最终筛选到一株在pH 7.0 下对魔芋粉催化效率明显提高的正向突变, 命名为RmMan5AM2。
基因测序分析结果表明该突变体基因(RmMan5AM2)中有7 个碱基发生突变,其中3 个为同义突变(Asn128 中aat-aac、Ala280 中gct-gcc、Lys306 中aag-aaa),4 个为错义突变,导致该突变体中4 个氨基酸残基在野生型甘露聚糖酶上发生改变, 分别是Leu122His (ctt-cat)、Lys162Arg (aagagg)、Glu194Asp(gaa-gac)和Asp305Gly(gac-ggc)。该突变体的氨基酸序列与其他GH5 家族甘露聚糖酶的多重序列比对表明:Leu122 和Glu194 均为严格保守氨基酸,Lys162 为部分保守氨基酸,Asp305为非保守氨基酸(见图1)。

图1 甘露聚糖酶突变体(RmMan5AM2)与其他GH5 家族甘露聚糖酶氨基酸序列多重比对分析Fig. 1 Amino acid sequence similarity of RmMan5AM2 with other GH family 5 mannanases
2.2 突变体(RmMan5AM2)的表达与纯化
甘露聚糖酶突变体RmMan5AM2 在大肠杆菌BL21(DE3)中可溶表达。 该突变体经Ni-NTA 亲和层析柱进一步纯化得到电泳级纯酶, 纯化倍数为7.5 倍,回收率为60.8%。 经SDS-PAGE 分析,该突变体的相对分子质量为44 000(见图2),与野生型甘露聚糖酶(RmMan5A)的相对分子质量一致[15]。

图2 甘露聚糖酶突变体(RmMan5AM2)的纯化图Fig. 2 SDS-PAGE analysis of purified RmMan5AM2
2.3 突变体(RmMan5AM2)的酶学性质
甘露聚糖酶突变体RmMan5AM2 的酶学性质如图3 所示。该突变体的最适pH 为7.0,在pH 5.0~8.5 表现出50%以上的酶活力。 该突变体具有优良的pH 稳定性, 在pH 4.0~10.0 下处理30 min 仍能保留80%以上的酶活力。 该酶的最适温度为65 ℃,在70、75 ℃下分别具有90%和50%左右的酶活力。该突变体具有良好的温度稳定性, 在60 ℃以下处理30 min 仍能保留90%以上的酶活力。

图3 甘露聚糖酶突变体(RmMan5AM2)的最适pH、pH 稳定性、最适温度和温度稳定性Fig. 3 Optimal pH,pH stability,optimal temperature,and thermostability of RmMan5AM2
与野生型甘露聚糖酶RmMan5A 相比, 该突变体的最适pH 和pH 稳定性没有发生明显改变[15]。该突变体在中性条件下具有最高的酶活力,这与大多数真菌来源的甘露聚糖酶明显不同,如嗜热毁丝菌(Myceliophthora thermophila)和米曲霉(A. oryzae)来源的甘露聚糖酶[19-20]。 该突变体在pH 5.0~8.5 仍具有50%以上的酶活力, 且在pH 4.0~10.0 具有良好的稳定性, 表明其能够在宽泛的pH 范围内表现出较高催化活性。 此外,与野生型甘露聚糖酶相比,该突变体的最适温度提高了10 ℃, 热稳定性温度提高5 ℃[15]。该突变体最适温度明显提高,高于许多天然甘露聚糖酶的最适温度, 如嗜热裂孢菌(Thermobifida fusca) 和芽孢杆菌 (Bacillussp.)来源的甘露聚糖酶[21-22]。 较高的反应温度有利于提高水解时的底物浓度和催化反应效率,并减少反应过程中微生物污染的风险[23]。
2.4 突变体(RmMan5AM2)的底物特异性和动力学参数
甘露聚糖酶突变体RmMan5AM2 保留了野生型甘露聚糖酶高比酶活力的特点,对槐豆胶具有最高比酶活力,为10 371.4 U/mg,其次分别为魔芋粉(6 430.3 U/mg)和瓜尔胶(2 604.0 U/mg)。 该突变体对魔芋粉和瓜尔胶的比酶活力有明显提高,分别为野生型甘露聚糖酶的20.9%和74.5%[15]。 定向进化后,突变体对槐豆胶的比酶活力显著高于大部分甘露聚糖酶,如来源于短小芽孢杆菌(B. pumilus,3 462.0 U/mg)和 白 曲 霉(763.6 U/mg)的 甘 露 聚糖 酶[5,24]。
甘露聚糖酶突变体RmMan5AM2 的动力学参数如表1 所示。 可以看出,该突变体对魔芋粉的最大反应速率(Vmax)最高,为36 696.0 μmol/(min·mg);对槐豆胶的亲和能力(Km)最高,为3.1 mg/mL。 与野生型甘露聚糖酶相比,突变体对不同底物的最大反应速率没有明显改变,但对槐豆胶、魔芋粉和瓜尔胶的Km值分别提高了18.4%、16.7%和12.8%[15],表明定向进化后突变体对甘露聚糖底物的亲和力有明显提升。 此外,在最适条件下,该突变体对槐豆胶、魔芋粉和瓜尔胶的催化效率(kcat/Km)分别较野生型甘露聚糖酶提高了37.4%、28.9%和34.4%。 高比酶活力和高催化效率能够有效降低甘露聚糖酶使用成本,提高魔芋甘露寡糖生产效率,对甘露聚糖酶的商业化应用和魔芋甘露寡糖的工业化生产至关重要。
2.5 突变体(RmMan5AM2)的结构分析
野生型甘露聚糖酶RmMan5A 的分子结构呈经典的(β/α)8-TIM 桶结构。 根据其分子结构可知,突变Leu122His 位于分子内部, 突变Lys162Arg、Glu194Asp 和Asp305Gly 位于分子表面 (见图4)。突变体中,疏水的Leu122 突变为亲水的His122,有利于稳定该酶的α2 螺旋,从而提高该酶的稳定性。突变Lys162Arg 和Asp305Gly 距离该酶催化中心较远,其中酸性的Asp305 突变为中性的Gly305,可能在一定程度上改变了酶分子局部与溶剂的相互作用,从而有利于酶分子稳定。 突变Glu194Asp 位于催化位点中心, 长侧链的Glu194 突变为短侧链的Asp194,使突变体催化凹槽变得开阔,便于底物与产物的进入和离去。 同时,与Glu194 相同,突变后的Asp194 也是带有羧基的酸性氨基酸, 该突变并不改变催化凹槽内的电荷分布及其与周围分子的相互作用。 这可能是该突变体比酶活力显著提高的原因之一。
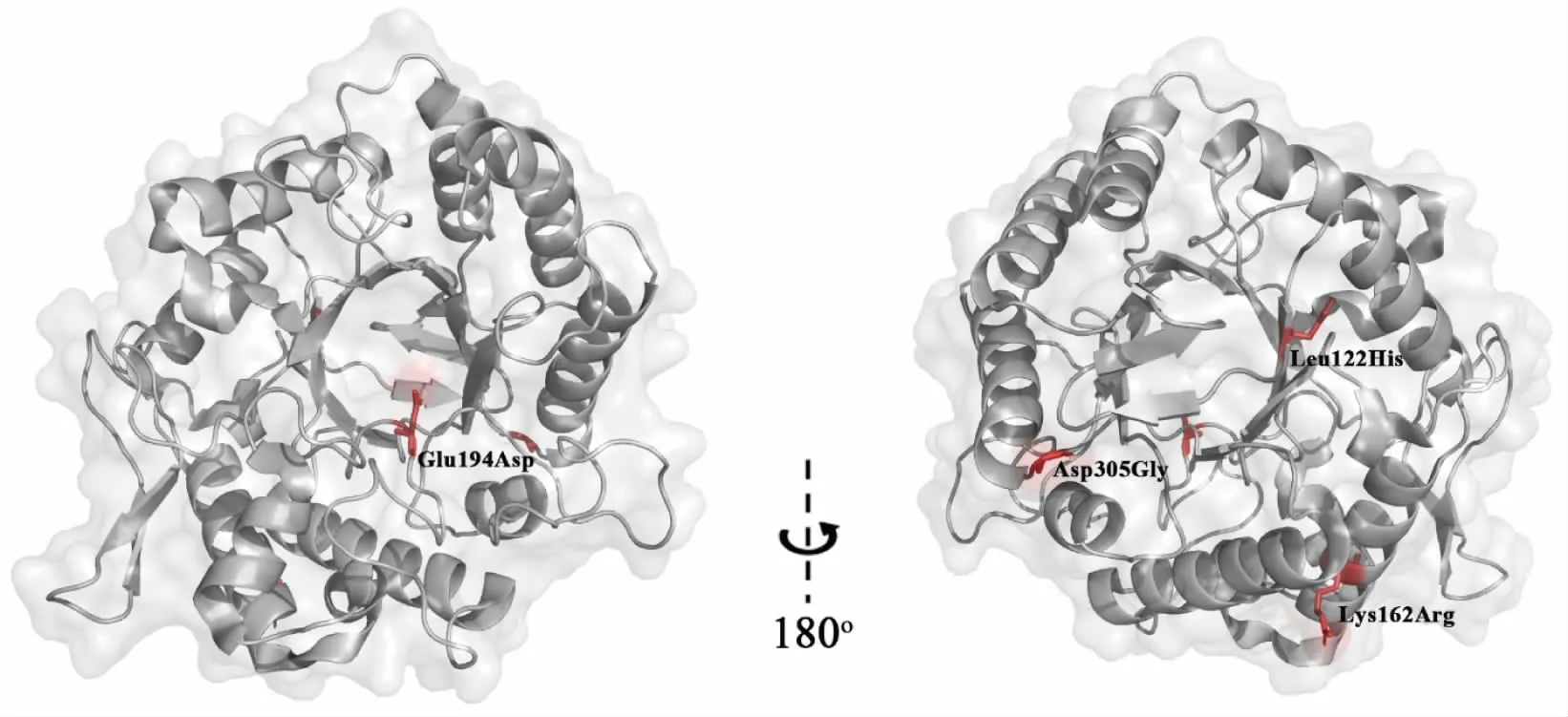
图4 甘露聚糖酶突变体(RmMan5AM2)的分子结构Fig. 4 Overall structure of RmMan5AM2
2.6 高密度发酵产甘露聚糖酶
甘露聚糖酶突变体基因RmMan5AM2在毕赤酵母GS115 中成功表达,经高拷贝转化子筛选,从含有1.0 mg/mL 遗传霉素G418 的筛选培养基中得到一株高产重组菌株, 摇瓶发酵的酶活力达862.8 U/mL。该重组菌株在100 L 发酵罐中进行高密度发酵,随着发酵进行发酵液中甘露聚糖酶酶活力、蛋白质质量浓度和菌体质量浓度都逐渐增加。 发酵至156 h,甘露聚糖酶酶活力达到最高值, 为176 000 U/mL,此时蛋白质质量浓度和菌体质量浓度分别为22.6 mg/mL 和421 g/L(见图5)。
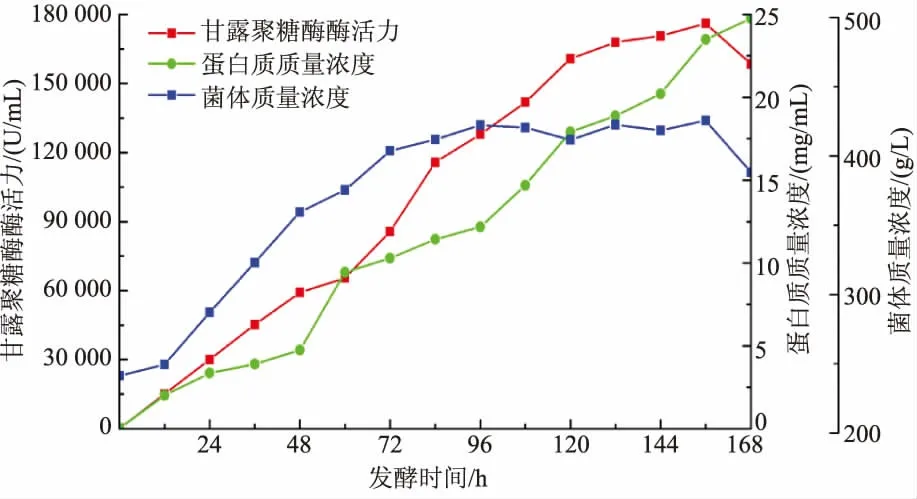
图5 毕赤酵母高密度发酵产甘露聚糖酶突变体(RmMan5AM2)历程Fig. 5 Time course of RmMan5AM2 expression in Pichia pastoris
甘露聚糖酶突变体RmMan5AM2 在毕赤酵母中表达表现出很高的酶活力,大大高于野生型甘露聚糖酶RmMan5A 在毕赤酵母中的酶活力(85 200 U/mL)[25]。迄今,已有多种甘露聚糖酶在毕赤酵母中实现了高效表达,如枯草芽孢杆菌(105 836 U/mL)和樟绒枝霉(42 200 U/mL)来源的甘露聚糖酶[10-11]。 该突变体发酵液胞外酶活力显著高于其他已报道甘露聚糖酶,是目前甘露聚糖酶的最高表达水平。 同时,该突变体发酵液中的蛋白质质量浓度也显著高于毕赤酵母表达的大多数甘露聚糖酶(2~10 mg/mL)[26-27]。
2.7 突变体(RmMan5AM2)制备魔芋甘露寡糖
甘露聚糖酶突变体RmMan5AM2 在最适条件下(加酶量300 U/mL、底物质量浓度300 g/L)水解魔芋粉8 h,魔芋粉的水解率达90.2%,魔芋甘露寡糖的得率达88.5%。 HPLC 分析结果表明(见图6):产物主要为聚合度2~6 的甘露寡糖,这些组分的峰面积超过总峰面积的85%; 聚合度2~10 的甘露寡糖组分峰面积超过总峰面积的95%。 该突变体水解魔芋粉制备的魔芋甘露寡糖符合我国 “新食品原料”目录(2013 年第10 号公告)中甘露寡糖组分的有关规定。

图6 魔芋甘露寡糖的组成分析Fig.6 HPLC analysis of the composition of konjac mannooligosaccharides
通常,底物质量浓度是影响多糖水解效率的重要因素[28]。 水解时提高魔芋粉质量浓度在一定程度上可以提高产物得率,但魔芋粉质量浓度高会显著增加反应体系黏度,阻碍体系中甘露聚糖酶分子移动及其与底物结合,反而降低魔芋粉水解率。 因此,水解魔芋粉制备魔芋甘露寡糖时,所用底物质量浓度一般在5~20 g/L[29-30]。 硫色曲霉(A. sulphureus)甘露聚糖酶水解10 g/L 魔芋粉时, 水解率达74%;但当魔芋粉质量浓度增加到100 g/L 时, 水解率显著降低至53%[31]。 甘露聚糖酶突变体RmMan5AM2 制备魔芋甘露寡糖时,所用魔芋粉质量浓度及其水解率分别达300 g/L 和90.2%, 均显著高于大多数已报道的甘露聚糖酶。 此外,利用该突变体制备的魔芋甘露寡糖主要为聚合度2~6 的寡糖组分,这与枯草芽孢杆菌和产黄青霉来源的甘露聚糖酶明显不同, 其水解魔芋粉主要产生聚合度7~12 的甘露寡糖[11,26]。 本研究中制备的魔芋甘露寡糖主要在人体近端结肠中发挥作用,能够有效预防小鼠的便秘情况,改善小鼠的胰岛素水平和瘦素抵抗[32-33]。
3 结 语
利用定向进化技术对米黑根毛霉来源的甘露聚糖酶(RmMan5A)进行了分子改造,获得了一个正向突变体(RmMan5AM2)。 该突变体对甘露聚糖的比酶活力和催化效率显著提高,同时保留了野生型甘露聚糖酶优良的酶学性质。 利用毕赤酵母实现了该突变体的高效生产, 发酵液胞外酶活力最高达176 000 U/mL,是目前甘露聚糖酶的最高产酶水平。该突变体能够水解高质量浓度魔芋粉制备低聚合度的魔芋甘露寡糖,在甘露寡糖生产应用具有很好的应用潜力。 本研究为甘露聚糖酶的分子改造、高效表达及其在生产甘露寡糖中的应用提供了理论基础和实践依据。
