调控miR-152对骨质疏松大鼠模型骨生物力学、骨重建平衡及骨组织Hedgehog信号通路的影响
2022-08-17王建武李晓妮李文高贾承明
王建武,李晓妮,赵 强,李文高,贾承明
(陕西省中医医院骨伤一科,陕西 西安 710004)
随着全球人口老龄化社会加剧,骨质疏松症发生群体日趋庞大,所带来的并发症如骨痛、骨折等问题愈发明显[1],因此明确骨质疏松的发生病理机制,可为骨质疏松的治疗、预防提供参考依据。骨代谢紊乱、低骨矿物密度是骨质疏松症发生的主要原因。有研究[2-3]表明,微小RNA(microRNA,miRNA)在骨代谢发生、发展过程中占据着重要作用。miRNA是一种内源性调节RNA,可有效调控基因表达及成骨细胞、破骨细胞活性,改善骨的发育功能及稳态[4]。Hedgehog-Gli信号通路是由Hedgehog信号蛋白、Ptched、Gli蛋白、Smoothened 特异性受体、下游靶基因组成,通过调控成骨细胞的增殖、分化及活性过程,从而促进骨稳态[5-6]。因此本研究分析调控miR-152对骨质疏松大鼠模型骨生物力学、骨重建平衡及骨组织Hedgehog信号通路的影响,现报告如下。
1 材料与方法
1.1 实验动物 32只SD大鼠(南方医科大学实验动物中心),SPF级,雌性,8~12周龄,平均(10.15±0.41)周;体重150~230 g,平均(182.58±8.63)g。饲养环境:每笼2只,温度20~24 ℃,空气湿度50%~60%,12 h交替光照,自由进食、饮水,饲养1周。
1.2 试剂与仪器 含各种氨基酸和葡萄糖的培养基(DMEM,上海恒斐生物科技有限公司),胎牛血清(FBS,Hyclone公司),维甲酸(上海嵘崴达实业有限公司), Ⅰ型原胶原N端前肽(PINP)、人Ⅰ型胶原C端肽(CTX-Ⅰ)、核心结合因子α1(CBF-α1)酶联试剂盒(北京百奥莱博科技有限公司),多功能酶标仪(美国Molecular Devices),miRNA提取试剂盒(上海泽叶生物科技有限公司),胶质瘤相关癌基因1蛋白(GLI1)抗体、兔抗人蛋白音猬因子(SHH)抗体、骨保护蛋白(OPG)抗体、 骨形态发生蛋白(BMP-2)抗体、小鼠多克隆抗体(RUNX2)、小鼠单克隆抗体(RANKL)(武汉菲恩生物科技有限公司),CO2细胞培养箱(Forma 3110,Thermo Fisher Scientific)。
1.3 实验方法
1.3.1 模型制备:除正常对照组(8只大鼠)之外,其他大鼠采用维甲酸灌胃,90 mg/(kg·d),灌胃期间正常饮食、饮水、活动,连续灌胃14 d后分为模型组、过表达组、沉默组,各8只。模型建立成功后,构建miR-152慢病毒载体,采用Gen Bank 查找序列获取脂蛋白脂酶(LPL)基因序列,建立过表达转染质粒、沉默转染质粒,测定慢病毒滴度(1×109TU/ml)。过表达组注射miR-152 过表达慢病毒悬液10 μl,沉默组注射miR-152 沉默慢病毒悬液10 μl,2周后处死大鼠。
1.3.2 血清样本检测:处死大鼠前,留取静脉血,分离血清,测定血清骨代谢指标:血钙、碱性磷酸酶(ALP)、磷、CBF-α1、PINP、CTX-Ⅰ水平。
1.3.3 病理组织学检查:大鼠处死后,留取股骨组织,固定24 h,常规脱水、石蜡包埋、切片、HE染色,光学显微镜下观察股骨组织病理变化。
1.3.4 骨密度值、骨矿物质含量测定:处死大鼠后,分离右侧股骨,剔除筋膜、肌肉,采用X线骨密度仪(美国GE公司)测股骨骨密度值。将左侧股骨、第四腰椎椎体进行矿化,使用比色法测定骨矿物质含量。
1.3.5 骨生物学力学检查: 将右侧股骨置于生物力学仪,支点跨距为18 mm,中点为加压点,加载速度为2 mm/min,记录股骨折断时的最大力量(最大荷载)、抵抗弯曲变形能力(刚度)。
1.3.6 骨组织Hedgehog信号通路相关蛋白及骨重建平衡指标检测:采用Western blot法测定胶质瘤相关癌基因 1蛋白(GLI-1)、蛋白音猬因子(SHH)、骨保护蛋白(OPG)、BPM-2的表达水平。
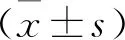
2 结 果
2.1 病理组织学 见图1。对照组大鼠股骨骨髓腔小,骨小梁形态、结构完整、清晰,数量多、粗壮。模型组骨髓腔增大、骨小梁断裂,骨膜内存在骨原细胞;过表达组骨髓腔增加,骨小梁形态、结构破坏,骨小梁断裂;沉默组骨髓腔紧密缩小,骨外膜有骨膜细胞。
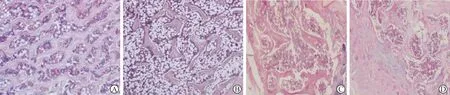
A:对照组;B:模型组;C:过表达组;D:沉默组
2.2 四组大鼠血钙、血磷、ALP含量比较 见表1。与对照组相比,建立骨质疏松模型后大鼠血钙、ALP水平明显下降,血磷明显升高(均P<0.05),其中沉默组ALP表达高于模型组、过表达组,血钙、血磷低于模型组、过表达组(均P<0.05)。

表1 四组大鼠血钙、血磷、ALP含量比较
2.3 四组大鼠股骨密度值及骨矿物质含量比较 见表2。与对照组比较,建立骨质疏松模型后大鼠股骨密度值、骨矿物质含量均明显降低,其中沉默组股骨密度值、骨矿物质含量高于模型组、过表达组(均P<0.05)。

表2 四组大鼠股骨密度值及骨矿物质含量比较
2.4 四组大鼠骨代谢指标比较 见表3。与对照组比较,建立骨质疏松模型后大鼠CBF-α1、PINP、CTX-Ⅰ表达明显下降,但沉默组骨代谢指标高于模型组、过表达组(均P<0.05)。

表3 四组大鼠骨代谢指标比较(μg/L)
2.5 四组大鼠骨生物力学与骨重建平衡指标比较 见表4。与对照组比较,建立骨质疏松模型后大鼠最大荷载、刚度、OPG、BPM-2表达均明显下降,其中沉默组最大荷载、刚度、OPG、BPM-2表达高于模型组、过表达组(均P<0.05)。

表4 四组大鼠骨生物力学与骨重建平衡指标比较
2.6 四组大鼠Hedgehog信号通路蛋白表达比较 见表5。与对照组比较,建立骨质疏松模型后大鼠SHH、GLI-1表达明显下降,但沉默组SHH、GLI-1表达高于模型组、过表达组(P<0.05)。

表5 四组大鼠Hedgehog信号通路蛋白表达比较
3 讨 论
骨质疏松症是临床常见的代谢性骨病,以低骨量、骨组织微结构破坏为主要病理特征,是导致个体骨质脆性增加、患者骨折的主要原因[7]。由于因骨质疏松而发生骨折人数越来越多,因此对骨质疏松的预防及治疗刻不容缓,明确疾病发生机制是临床研究热点。有学者基于炎性相关因子调节通路TRAF6/NF-κB p65/NFATc1探讨瑞香素治疗绝经后骨质疏松的作用机制[8]。韩鹏勃等[9]应用中医药通过正向调控Wnt/β-catenin信号通路,提高骨密度、改善骨组织形态。信号通路的研究是认识及治疗骨质疏松的一个切入点。
miRNA是一种单链小分子RNA,由22个核苷酸组成,具有促进mRNA降解、抑制mRNA翻译的作用[10]。有研究[11]表明,骨质疏松多伴有多种miRNA表达失衡问题,通过调控骨代谢,发挥促进或抑制骨质疏松的发生、进展的作用。miR-152是miRNA家族主要成员,已证实在细胞生长、增殖、分化、凋亡及免疫反应等多种生理病理过程起到重要作用[12-13]。
本组研究发现骨质疏松模型组大鼠骨髓腔增大、骨小梁断裂,骨膜内存在骨原细胞;但miR-152过表达组骨髓腔增加,骨小梁形态、结构不完整,骨小梁断裂;而沉默组骨髓腔紧密缩小,骨外膜有骨膜细胞。结果表明,骨质疏松大鼠骨骼解剖结构破坏明显,研究显示,骨质疏松大鼠血钙、ALP表达明显下降,血磷明显升高,其中沉默组ALP表达高于模型组、过表达组,血钙、血磷低于模型组、过表达组。结果表明在沉默miR-152表达后,可相应改善骨代谢异常。本组研究还显示,沉默miR-152表达后,大鼠骨密度、骨矿物质明显增加,以此能抑制骨质疏松进展,可作为以后治疗骨质疏松的新途径。
当发生骨质疏松后,患者普遍出现骨重建失衡、骨生物力学下降现象。其中骨重建平衡有维持骨骼形成、重塑骨骼周期特性、维持骨量及骨质的作用[14]。骨生物力学表明了骨骼抵抗外力的最大力量、抵抗弯曲变形能力,当骨生物力学下降,说明对抗能力下降,极易出现骨折现象[15-17]。本组研究,骨质疏松大鼠骨重建失衡明显,且骨生物力学下降,但沉默miR-152表达后,骨重建失衡有所改善,骨生物力学有所提高。分析其具体机制:Hedgehog信号通路基因高度保守,可正向调控骨髓间充质干细胞分化为成骨细胞,并能调控成骨细胞的增殖、分化及活性,以此维持骨稳态[18-19];同时Hedgehog-Gli蛋白通过调控骨保护素表达,间接抑制破骨细胞的形成。本研究显示,骨质疏松大鼠SHH、GLI-1表达明显下降,但沉默组SHH、GLI-1表达高于模型组、过表达组。结果表明,骨质疏松大鼠存在Hedgehog信号蛋白活性抑制情况,但沉默miR-152后,使Hedgehog信号通路被激活,增加骨量、促进骨形成、改善骨代谢、诱导骨重建,故能增加骨生物力学水平、改善骨重建失衡问题[20]。
综上所述,骨质疏松大鼠存在骨生物力学下降、骨重建失衡问题,通过沉默miR-152表达,可调控骨组织Hedgehog信号通路,激活Hedgehog信号相关蛋白,起到改善骨重建平衡、增加骨生物力学的作用。但人类基因组中有多达1000多种miRNA,由于miRNA之间也会相互调节,导致整个调节过程异常复杂[21],有继续深入研究的必要。
