医疗器械唯一标识标签质量
2022-08-17中国物品编码中心刘睿智
中国物品编码中心 刘睿智
我国于2012年《国家药品安全“十二五”规划》中提出启动高风险医疗器械国家统一编码工作,2017年《“十三五”国家药品安全规划》明确提出制定医疗器械编码规则,构建医疗器械编码体系。2019年8月国家药监局发布《医疗器械唯一标识系统规则》,正式在全国范围内启动医疗器械唯一标识(UDI)系统建设,根据医疗器械产品风险等级逐步推进实施。2019年,国家药监局《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》中确定部分有源植入类、无源植入类等64种高风险第三类医疗器械作为第一批医疗器械唯一标识实施品种,并于2021年1月1日开始实施。2021年9月,国家药监局、国家卫生健康委、国家医保局《关于做好第二批实施医疗器械唯一标识工作的公告》要求将其余第三类医疗器械(含体外诊断试剂)纳入第二批实施唯一标识范围,支持和鼓励其他医疗器械品种实施唯一标识。唯一标识赋码、唯一标识注册系统提交、唯一标识数据库提交的均为2022年6月1日起实施。
UDI的实施具有深远意义
首先,医疗器械的产品、型号、规格十分庞杂,在医院使用过程中因耗材使用错误出现的医疗安全事故并不少见,统一医疗器械编码能够有效地减少此类错误的发生。同时,对于提高院内耗材的精细化管理水平以及维护患者安全具有重要作用。其次,从政府管理的角度出发,建立医疗器械唯一标识能够规范医疗器械市场;构建监管大数据,提高卫生管理效率,对于医疗器械的来源、去向以及责任都可追溯;丰富政府监管工具和智慧监管手段,提高市场监管效能。在采购招标环节,能够实现结算透明化,打击欺诈和滥用行为。最后,建立医疗器械唯一标识对于医疗器械的生产和流通环节影响最为深远。对于生产企业而言,统一标识能够建立产品完善的追溯体系,提升医疗器械产业高质量发展。对于经营企业而言,利用统一标识,能够实现供应链的透明化、可视化、智能化。
医疗器械唯一标识的实施对于保障患者安全,提高医院管理水平,促进行业发展及加强政府监管发挥着关键作用。
医疗器械唯一标识与通用商品条码相比,监管更加严格。另外,医疗器械产品的应用场景多样,对标识的条码符号要求不同,检测时选择测量孔径也不同。根据《医疗器械说明书和标签管理规定》,医疗器械标签应印制生产日期,使用期限或者失效日期等文字内容,医疗器械唯一标识条码与供人识别字符应与这些文字内容相一致。为保证设备能够准确识读并解析条码信息,条码符号的数据结构应符合标准要求。
UDI标签质量的重要性
医疗器械唯一标识系统由医疗器械唯一标识、数据载体和数据库三部分组成。其中,医疗器械唯一标识是对医疗器械身份唯一识别的代码,是系统的基础与核心。其数据载体包括一维条码、二维码和射频标签。其中一维条码和二维码应用最为广泛,大多数医疗器械唯一标识数据载体印制在标签上,然后粘贴在医疗器械的包装上。医疗器械唯一标识标签内容包括条码、供人识别字符以及其他文字信息。良好的标签质量是快速、准确识别并读取产品信息的关键,直接影响到医疗器械产品信息传输与共享的准确性和效率。
UDI标签质量评价分析
UDI标签内容包括条码符号和文字信息。标签质量是对条码符号质量和文字信息一致性的评价,应从应用符合性、条码符号印制质量、数据符合性、条码放置位置、标签信息一致性等方面进行评价。
应用符合性
应用符合性是指医疗器械唯一标识条码符号是否与其被使用应用场景的技术要求相符合。常见问题包括码制选择、条码符号大小、条高等。
码制选择
生产企业生成UDI标签条码符号时,码制选择错误会导致识读设备无法识读,信息无法传输到计算机系统中。目前,基于GS1标准的UDI数据载体常见的有一维条码、GS1-128码、二维码GS1 DataMatrix码,如图1所示。GS1-128条码码制规范参见GB/T 15425-2014《商品条码128条码》;GS1 DataMatrix码的码制规范参见GB/T 41208-2021《数据矩阵码》。

图1 GS1-128条码与GS1 DataMatrix码示例
条码符号大小
在不同的应用场景下,识读设备不同,其光栅长度不同,能够识读的条码符号的大小也不同,因此条码符号的大小要与应用场景中使用的识读设备相匹配。X尺寸是指窄单元或模块尺寸的标称值,在GS1-128条码中X尺寸指的是窄单元的标称值,在GS1 DataMatrix码中X尺寸指的是模块尺寸的标称值,X尺寸的大小决定了条码符号的大小,因此,在不同应用场景中,条码符号的X尺寸不同,《GS1通用规范》中对条码符号X尺寸的要求见表1和表2(见下页)。如果条码符号的X尺寸过大,当条码识读设备的光栅或视野太小时,条码符号无法被完整读取;如果条码符号的X尺寸过小,当条码识读设备的分辨率不够时,会导致条码符号无法译码。
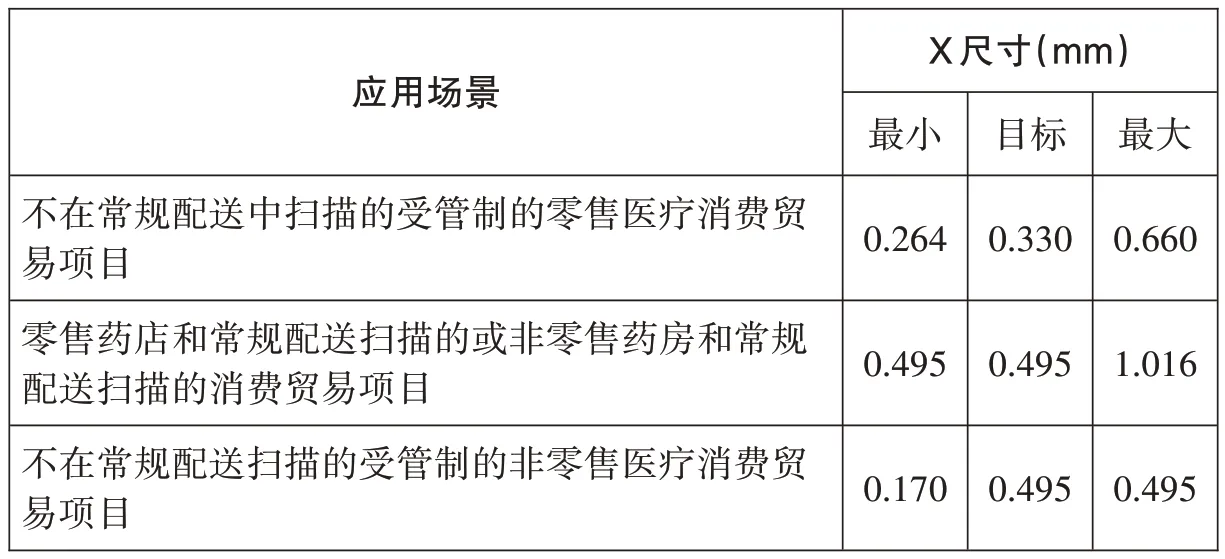
表1 GS1-128条码X尺寸要求
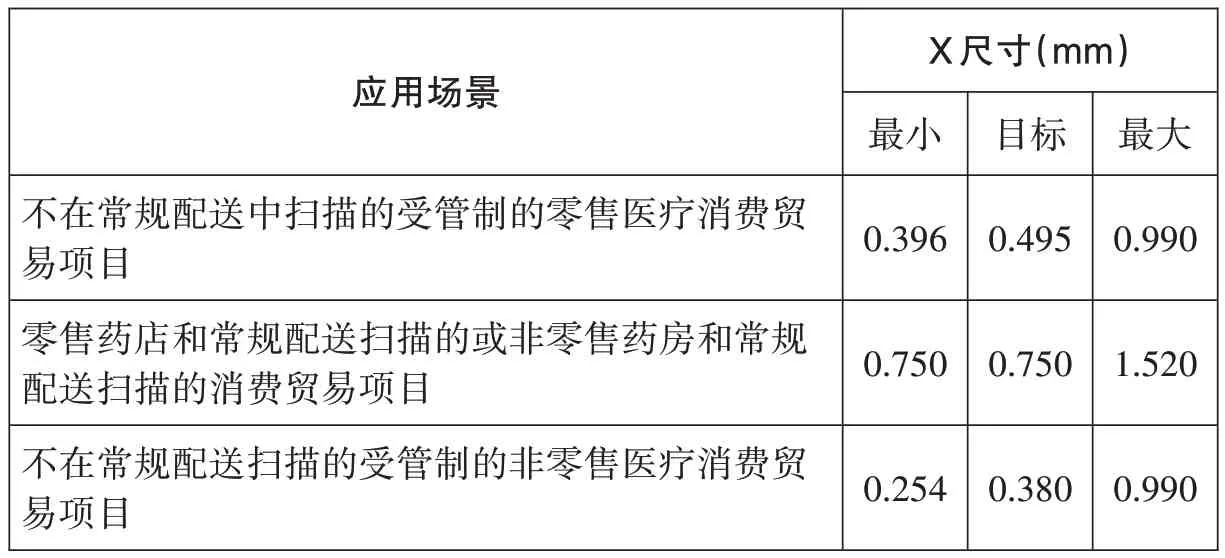
表2 GS1 DataMatrix码X尺寸要求
GS1-128码的条高
足够的条高是为了保证扫描识读的效率,这对于扫描效率高的全向扫描方式尤为重要。条高足够时,识读器光栅贯穿整个条码符号的几率更大;条高不够时,会影响条码扫描识读的效率,条码扫描示意如图2 所示。《GS1 通用规范》中对GS1-128条码X尺寸的要求见表3。
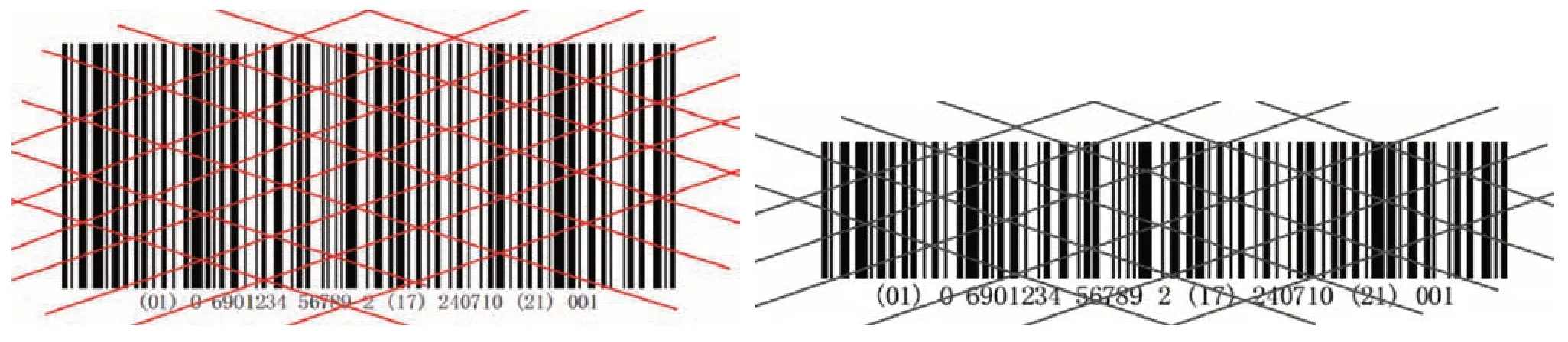
图2 GS1-128条码扫描示意图

表3 GS1-128条码条高高度要求
印制质量常见问题分析
条码符号印制质量是评价条码符号印刷质量的参数。常见问题包括印制质量差,等级低,空白区不足,最大物理长度过长或数据字符个数过多等。
条码符号印制质量检测
条码符号的印制质量检测需要专业条码检测仪。
一维条码符号印制质量检测采用扫描反射率曲线分析法。以对条码符号扫描测量得到的扫描反射率曲线为基础,用参考译码(包括单元确定、边缘确定、译码正确性)、五个反射率参数(最低反射率、符号反差、最小边缘反差、调制比、缺陷度)、一个与条空宽度尺寸偏差相关的参数(可译码度)来评价条码符号的质量并依据这些参数为条码符号评定符号等级。符号等级以G/A/W 的形式来表示,其中G 是符号等级值,精确至小数点后一位;A 是测量孔径的参考号;W 是测量光波长以纳米为单位的数值。例如,2.7/06/660 表示,符号等级值为2.7,测量时使用的是参考号为06 的、标称直径为0.15mm 的孔径,测量光波长为660nm。不同应用场景中,GS1-128条码的最低符号等级要求,见表4(见下页)。
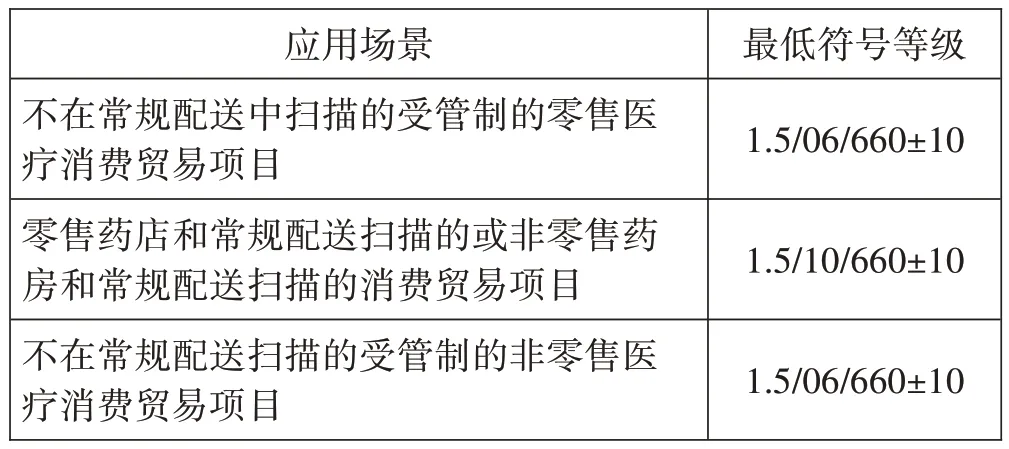
表4 GS1-128条码最低符号等级要求
二维码符号印制质量检测方法基于符号反射率的测量。在一定的照明和采集视角条件下,获取一个高分辨率的原始灰度图像,用合成的圆形孔径对原始图像进行卷积运算,得到参考灰度图像;从参考灰度图像测量出符号反差、调制度和固有图形污损等参数值,并对这些参数进行分级,采用整体阈值(Rmax 和Rmin的算术平均值)将参考灰度图像转化为二值化图像;分析二值化图像,得出参考译码、轴向不一致性、网格不一致性、未使用的纠错,以及符号或应用标准规定的其他参数值。扫描等级是符号反差、调制度、固有图形污损、参考译码、轴向不一致性、网格不一致性和未使用的纠错7 个参数等级、以及码制标准或应用标准规定的其他参数等级的最低值。不同应用场景中,GS1 DataMatrix码的最低符号等级要求,见表5(见下页)。
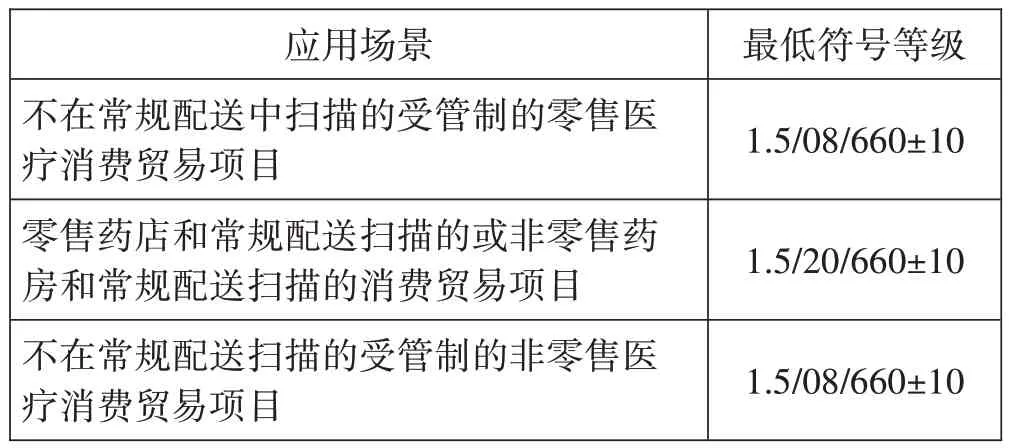
表5 GS1 DataMatrix码最低符号等级要求
GS1-128条码常见的印制质量问题有参考译码错误、可译码度低、边缘反差太小、调制比太低、缺陷度太大等;二维码符号GS1 DataMatrix 常见的印制质量问题有符号反差太小,轴向不一致性太高,固有图形污损太高,未使用的纠错太少,调制比和模校调制比太小等。条码符号的印制质量与印刷材料、打印设备、印刷条件(温度、打印速度)等众多因素密切相关。条码符号等级太低应根据实际情况具体问题具体分析。
空白区
GS1-128 左右两侧需要留有空白区,在一维条码中空白区的作用是提示识读器,两个空白区信号(静区信号)之间的扫描信号是有用的,应提取并译码。二维码四周也要留有一定的空白区,空白区的作用是与周周的其他图形分离,提高识读效率。受医疗器械唯一标识标签大小的限制,很多生产企业没有将空白区留足,导致识读设备无法译码或译码错误。
GS1-128条码最大物理长度
由于条码识读设备的光栅和存储容量是有限的,能够识读的条码符号长度及储存的数据内容是有限的,当条码过长或数据字符个数过多时,会导致无法识读或数据丢失的情况,所以条码符号最大物理长度一般不超过165mm,数据字符个数不能超过48个。
多条码的放置
多条码符号位置放置不合理,如图3所示,产品标识条码符号纵向放置,生产标识条码符号横向放置,这样将会导致扫描效率低下,降低识读速度。两个条码符号宜同一方向上下排列放置,位置相邻,便于查找,提高扫描效率。

图3 多条码符号位置放置不合理示例
条码符号数据结构
条码符号的数据结构不符合《GS1通用规范》的要求,变长数据(如批号和序列号)之间缺少分隔字符,识读设备在识读时就无法确定在哪分隔数据段;应用标识符使用错误,导致系统获取的信息错误;生产日期和有效期中的月份两位数字大于12,日期两位数字大于31,不合逻辑。应用标识符的使用及数据形式应符合标准要求。编码数据内容中的定长部分建议放在前面,变长部分放在后面。变长与定长数据之间,变长与变长数据之间需要用FNC1 分隔字符进行分隔,从而提高解码效率。医疗器械唯一标识中常用的应用标识符数据形式,见表6。
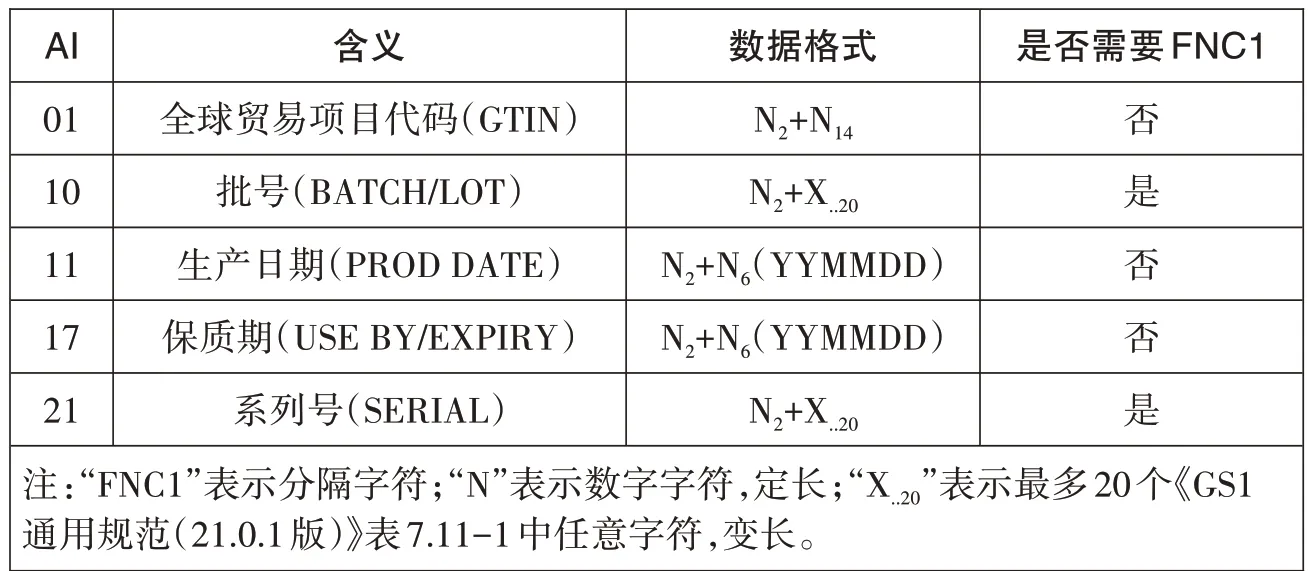
表6 常用应用标识符数据形式
标签信息不一致问题
另外,标签信息包括条码符号、供人识别字符以及标签上的其他文字信息。标签信息中,三者信息应一致。企业在实施过程中,会出现供人识别字符与条码符号或标签上的其他文字信息不一致的情况。