三氮脒通过激活ACE2减轻光气诱导的大鼠急性肺损伤
2022-08-17李宏伟何改花刘江正于卫华孔德钦李文丽
李宏伟,何改花,刘江正,于卫华,孔德钦,龙 子,刘 瑞,李文丽
(空军军医大学军事预防医学系军事毒理学与防化医学教研室,陕西省自由基生物学与医学重点实验室,教育部特殊作业环境危害评估与防治重点实验室,陕西 西安 710032)
光气,化学结构式为COCl2,是一种具有烂水果味的无色剧毒气体,分子量为98.916,比空气重3.4倍,常作为化学中间体用于合成农药、塑料和药品等。我国作为全球最大的化工国家,光气产量巨大,中毒事件时有发生。一般而言,光气对人体的致死浓时积约为41 mg/m3×30 min,其主要靶器官是肺脏,经过一段潜伏期后可导致急性肺损伤(acute lung injury,ALI),进一步引起急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),严重者可导致死亡。因此,光气致死的核心原因是ALI。但光气中毒后在临床上没有特效的救治药物,主要以呼吸支持和对症治疗为主,但上述临床干预的效果有限,迫切需要找到新的、更安全和更有效的救治方法。
光气诱导的ALI机制十分复杂,迄今为止仍不明确。目前公认的发病机制有酸烧伤、氧化应激、炎症作用、肺脏细胞凋亡、肺血气屏障破坏等[1-2]。研究报道,肾素-血管紧张素系统(renin-angiotensin system,RAS)在维持血压稳态以及水盐平衡方面起着关键作用。血管紧张素转化酶(angiotensin converting enzyme,ACE)和ACE2在发挥催化作用方面具有较高的同源性。ACE 主要催化血管紧张素(angiotensin,Ang)Ⅰ产生AngⅡ,进而诱导血管收缩。而 ACE2与 ACE 相互拮抗,主要是催化AngⅡ生成Ang-(1-7),其功能主要是作为RAS的负向调节剂发挥作用。以往的研究表明,RAS 在ALI和ARDS中也发挥了重要的调控作用[3]。目前,ACE2在光气诱导ALI中的作用还不明确。本研究将探讨ACE2激动剂三氮脒(diminazene aceturate,DIZE)对光气诱导的ALI的保护作用及其机制,为临床防治光气中毒策略提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级Sprague-Dawley(SD)雄性大鼠40只,体质量(200±20)g,购于空军军医大学动物实验中心,大鼠在本教研室SPF级动物饲养,自由摄入水和饲料,实验前适应性喂养1周。动物实验环境相对湿度(50±10) %,温度(22±2 ) ℃,12 h/12 h交替昼夜循环, 每日观察动物一般情况。
1.1.2 主要试剂 光气(德国林德公司);DIZE(Med Chem Express公司);光气染毒装置(德国拜耳公司吸入毒理实验室馈赠);双目生物显微镜(日本OLYMPUS公司);高速冷冻离心机(美国Du Pont公司);ACE2、AngⅡ、Ang-(1-7)、IL-6和TNF-α的ELISA试剂盒(上海江莱生物科技有限公司);无水乙醇、二甲苯(国药集团化学试剂有限公司);一抗ACE2、AngⅡ、Ang-(1-7)(Abcam公司);8-OH-dG(博奥森公司);EDTA抗原修复液(Service-bio公司);DAPI、荧光二抗、CY3山羊抗小鼠、CY3山羊抗兔(谷歌生物有限公司)。
1.2 方法
SD雄性大鼠随机分为4组:空气对照组、DIZE对照组、光气染毒组、DIZE干预组,每组10只。光气暴露为动态染毒,吸入浓度为41 mg/m3,持续染毒30 min,对照组采用空气模拟暴露。DIZE对照组和DIZE干预组分别在空气暴露或光气染毒前8、16、24 h分别三次预先腹腔注射DIZE,每次剂量为7.5 mg/kg,空气对照组和光气染毒组分别注射等体积生理盐水。
染毒结束后6 h,使用50 g/L苯巴比妥钠腹腔注射麻醉大鼠,开腹后腹主动脉取血,取出肺脏,保存于-80 ℃。将全血在室温下放置2 h,1 000 g离心20 min,取上清,保存于-80 ℃。
1.2.1 病理组织学检测 将右侧肺浸泡于40 g/L多聚甲醛溶液中,对肺组织进行石蜡包埋处理,切片厚度为5 μm,然后进行HE染色,显微镜下观察肺组织形态改变。显微镜下病理改变主要有4种类型:①肺泡出血;②肺泡壁和血管壁炎细胞浸润;③肺泡壁增厚;④支气管上皮细胞脱落。组织病变程度采用五级分法,无病变或损伤范围极少为0分;有轻度病变或病变范围<25%为1分;有中度病变或病变范围在25%~50%为2分;有重度病变或病变范围在51%~75%为3分;有极重度病变或病变范围>75%为4分。计算视野中4种病变损伤程度的得分总和;随机选取每只小鼠右肺组织切片的10个随机视野,计算平均值为每组最终得分。
1.2.2 组织免疫荧光染色法检测肺组织8-OH-dG的表达 将各组大鼠的石蜡包埋肺组织切片之后,石蜡切片脱蜡,抗原修复,人工画圆圈自发荧光淬灭,血清封闭,加一抗,盒内4 ℃孵育过夜,然后进行洗涤,再加二抗,室温避光孵育50 min,PBS洗涤,DAPI复染细胞核,室温避光孵育10 min,PBS洗涤后进行封片,最后荧光显微镜拍照。
1.2.3 ELISA法检测血清ACE2、AngⅡ、Ang-(1-7)、 IL-6和TNF-α的含量 应用商品化ELISA试剂盒测定血清ACE2、AngⅡ、Ang-(1-7)、IL-6和TNF-α含量。具体步骤简述如下:制定标准品孔、空白孔、样本孔对应加样,然后加入辣根过氧化物酶标记的检测抗体避光恒温箱温育60 min;重复洗板5次;每孔加入底物A和B,37 ℃避光孵育15 min,加入终止液,测定各孔A450 nm值,绘制标准曲线,按回归方程计算各个样本相应分子的浓度值。
2 结果
2.1 DIZE干预对光气诱导大鼠ALI的影响
光镜下观察肺组织病理切片显示,空气对照组的肺泡结构完整,肺泡腔无渗出物,肺泡间质无增厚和炎症细胞浸润;光气染毒组出现血管壁和支气管壁炎细胞浸润,肺泡壁紊乱,肺泡腔大量嗜酸性物质渗出,肺泡间隔增厚伴炎细胞浸润;但DIZE干预组病理变化较染毒组轻(图1)。对肺损伤进行评分,与对照组相比,光气染毒组的肺损伤评分明显增加,DIZE干预组的肺损伤评分显著降低(P<0.05,图2)。

A:空气对照组; B:DIZE对照组; C:光气染毒组; D:DIZE干预组。HE ×200。 图1 大鼠肺组织病理变化

aP<0.05 vs空气对照组; cP<0.05 vs光气染毒组(n=8)。 图2 急性肺损伤评分
2.2 DIZE干预对大鼠血清ACE2、AngⅡ和Ang-(1-7)含量的影响
我们通过ELISA方法测定了大鼠血清中ACE2、AngⅡ、Ang-(1-7)的含量。与对照组相比,光气染毒组血清ACE2和Ang-(1-7)含量降低, 而AngⅡ含量显著升高(P<0.05);与光气染毒组相比,DIZE干预后明显升高了ACE2和Ang-(1-7)含量,AngⅡ含量降低(P<0.05,图3)。
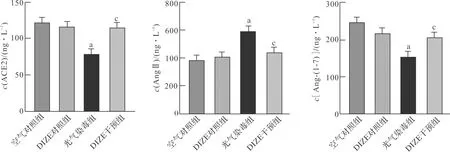
aP<0.05 vs空气对照组; cP<0.05 vs光气染毒组(n=8)。图3 DIZE干预对大鼠血清ACE2、AngⅡ和Ang-(1-7)含量的影响
2.3 DIZE干预对光气诱导大鼠肺组织氧化应激损伤的影响
我们通过免疫荧光染色测定了大鼠肺脏中8-OH-dG的表达,与对照组相比,光气染毒组肺组织8-OH-dG的表达显著升高;与光气染毒组相比,DIZE干预组的8-OH-dG表达明显降低(图4)。
2.4 DIZE干预对光气诱导大鼠血清炎症反应的影响
我们测定了血清中TNF-α和IL-6的含量,结果显示,与对照组相比,光气染毒组大鼠血清中TNF-α和IL-6的水平明显升高(P<0.05);与光气染毒组相比,DIZE干预组大鼠血清中TNF-α和IL-6的水平显著下降(P<0.05,图5)。
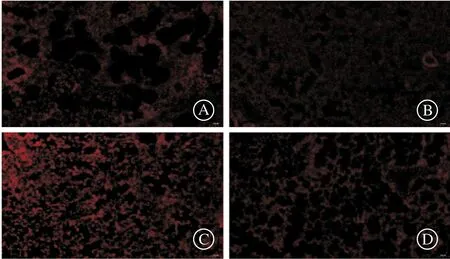
A:空气对照组;B:DIZE对照组;C:光气染毒组;D:DIZE干预组。图4 DIZE干预对光气诱导大鼠肺组织8-OH-dG表达的影响

aP<0.05 vs空气对照组; cP<0.05 vs光气染毒组(n=8)。图5 DIZE干预对光气诱导大鼠血清炎症反应的影响
3 讨论
光气作为一种重要的窒息性毒剂和化工原料,被广泛用于战争和工业生产中。我国是光气生产大国,年均生产量超过300万吨。光气泄露导致人员中毒事件在我国时有发生。光气中毒后可引发ALI,导致肺水肿,患者可以死于ARDS。目前光气所致的ALI机制不清,没有特效救治药物。研究表明,亚致死剂量的光气中毒与氧化损伤、炎症作用密切相关。
研究报道,RAS在ALI和ARDS中发挥了重要的调控作用。ACE2是RAS系统中一个重要的因子。许多研究已经验证ACE2在多种疾病中的作用,包括治疗肺纤维化、心肌梗死、心力衰竭和肝纤维化。肺脏中,ACE2在肺血管内皮细胞、支气管纤毛上皮细胞和Ⅱ型肺泡上皮细胞中表达较多,ACE2主要发挥分解AngⅡ生成Ang-(1-7)的作用,即ACE2将AngⅡ代谢为 Ang-(1-7)[4]。众多研究表明[5-6],在ACE2基因敲除小鼠可以免受SARS-Cov和SARS-Cov-2的感染。此外,在盐酸吸入以及感染导致ALI模型中,AngⅡ是诱导肺损伤发生和发展的致病因子,上调或激活ACE2通过拮抗AngⅡ的作用对ALI具有良好的保护作用。DIZE是一种经典的ACE2的激活剂,在临床上主要用来治疗伊锥虫病,安全性较好。DIZE通过激活ACE2,可将Ang Ⅱ 裂解生成Ang-(1-7)。文献[7-10]表明,DIZE干预在心脏、脑、肾脏等方面发挥着强而有效的抗炎特性,对机体具有保护作用。例如DIZE治疗可以通过抑制炎症和凋亡,减轻LPS引起的暴发性肝炎。目前为止,DIZE作为ACE2激动剂在光气诱导ALI中是否具有保护性作用未见报道。
我们的实验结果表明,光气染毒组大鼠血清中ACE2含量降低,发生了肺损伤; DIZE干预后,血清中ACE2含量升高,肺损伤减轻,由此说明DIZE具有激动ACE2的功能,可能发挥保护肺损伤功能。据报道,Ang-(1-7) 是由天门冬氨酸、精氨酸、缬氨酸、酪氨酸、异亮氨酸、组氨酸、脯氨酸组成的7肽[11]。Ang-(1-7)除了通过上述途径生成,也可以通过 ACE的水解直接从Ang-(1-9)生成。Ang-(1-7) 通过与Mas受体特异性结合拮抗AngⅡ的作用,发挥舒张血管、抗炎、抗增生、抗纤维化和抗肺泡上皮细胞凋亡的作用。Ang-(1-7)活化可促进一氧化氮释放、升高超氧化物歧化酶-2表达、减少炎症因子的产生。作为AngⅡ和Ang-(1-7)之间的桥梁,抑制 ACE2将导致AngⅡ升高和Ang-(1-7)减少。研究证明 AngⅡ水平升高是乳腺癌、COVID-19和PAH的重要危险因素。AngⅡ是RAS中目前已知最强的致炎因子。AngⅡ可以使肺部血管收缩、诱导炎症因子表达,从而导致血管细胞膜通透性升高及肺泡上皮细胞凋亡。文献[12]报道甲型H5N1流感病毒、H7N9禽流感病毒等感染引起的小鼠ALI模型中,同样出现AngⅡ水平显著升高。AngⅡ可通过活化NF-κB信号通路,诱导TNF-α、IL-1β等炎症因子表达,进一步导致ALI。我们观察到光气诱导大鼠ALI的血清中 Ang Ⅱ水平升高,Ang-(1-7)水平降低,而DIZE干预后,染毒大鼠血清中 Ang Ⅱ 水平下降,Ang-(1-7)水平升高,肺组织损伤明显改善。上述结果表明,DIZE可以有效激动ACE2,使其含量增加,水解AngⅡ的能力增加,因而水解产物Ang-(1-7)进一步增加,通过该途径达到保护光气诱导的肺损伤的作用。
炎症和氧化应激之间是相互作用的,两者在光气诱导的ALI 中起到至关重要的作用[13]。大量文献报道DIZE具有抗炎和减轻LPS诱导的 ALI 的功效。炎症细胞在早期阶段被激活,过度产生炎症细胞因子(如TNF-α、IL-6)。这些炎症因子导致肺泡上皮细胞等其他细胞的破坏,损伤肺泡毛细血管屏障,导致气体交换异常和肺顺应性降低。因此,抑制促炎细胞因子产生对于预防炎症反应至关重要。8-OH-dG是活性氧(reactive oxygen species, ROS)使DNA氧化损伤的产物[14], 8-OH-dG在实验和临床中应用普遍,在生化检测中作为指标之一常用来评价氧化损伤。过多的炎症细胞的激活、促炎因子释放可以促进ROS生成,ROS进一步使DNA氧化损伤,使8-OH-dG表达升高,导致肺组织进一步损伤。在本研究中,光气染毒大鼠8-OH-dG 表达显著升高,血清TNF-α、IL-6含量显著增加,结合我们之前的研究结果,证实氧化应激和炎症作用是光气导致的ALI的主要机制。DIZE干预后显著降低光气诱导大鼠TNF-α、IL-6这两种重要促炎因子的血清含量,同时还降低了肺组织的8-OH-dG表达,提示DIZE在光气诱导的ALI中具有较好的抗炎和抗氧化作用。
综上所述,DIZE通过激活ACE2,使AngⅡ水平下降,Ang-(1-7)水平升高,进而减轻炎症反应和氧化损伤,最终减轻光气诱导的大鼠ALI。上述结果表明,Ang Ⅱ-ACE2-Ang-(1-7)轴可能是光气诱导肺水肿的重要药理学干预靶点,ACE2激动剂是一种潜在的光气救治药物,其保护机制还待进一步研究。
