光生物调节通过抑制氧化应激和继发炎症促进脊髓损伤修复
2022-08-17朱志杰王选康左晓霜梁卓文胡学昱
朱志杰,王选康,左晓霜,梁卓文,李 鑫,胡学昱,王 哲
(空军军医大学西京医院骨科,陕西 西安 710032)
脊髓损伤(spinal cord injury,SCI)分为原发性损伤和继发性损伤两个过程,原发性损伤一般是由暴力创伤等因素导致的脊髓组织连续性破坏,组织受压导致神经元死亡[1]。伴随而来的继发性损伤包括氧化应激、钙离子超载、组织凋亡、炎症反应等[2]。在过去的几十年里,损伤急性期的常用治疗手段如手术减压、血流动力学控制和糖皮质激素的应用[3],均不能很好地减轻继发性损伤。
光生物调节(photobiomodulation,PBM)是近十年来备受关注的方法之一,基团吸收光的能量后,激发基态电子向高能轨道运动,该过程产生的质子梯度有助于ATP的产生[4]。此外,PBM还可以调控ROS生成及激活多种转录因子[5-6]。作为中枢神经系统损伤的有效疗法,PBM已被用于治疗SCI、创伤性脑损伤、缺血性脑卒中、阿尔茨海默病、帕金森病等[7-9]。既往对于PBM的应用方式一般是经损伤区皮肤间接照射受损组织,但有研究证明只有约6%的能量能够达到SCI部位,大大降低了能量利用率[10-11]。本课题组前期开发了一种360°可发光激光光纤,可以埋置在动物椎旁棘突,直接将光能量投射到脊髓组织表面。该光纤埋置的可行性和810 nm波长的安全性已经在猪模型上得到了验证[12]。但是该方案对于促进SCI后组织修复和运动功能恢复的有效性尚未明确,因此,我们设计了如下实验证明其有效性,以便将PBM更好地推进临床转化与应用。
1 材料与方法
1.1 材料
主要一抗:SOD-1(sc-17767);NF-E2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)(sc-365949);HO-1(Abcam,189491);β-actin (Proteintech,66009-1-Ig);MAP2(CST,8707S)。HRP二抗:羊抗兔IgG(InCellGenE,SA10011);羊抗鼠IgG(InCellGenE,SA10010)。荧光二抗:Cy3-Donkey Anti Rabbit (Jackson,152432)。TUNEL试剂盒(碧云天,C1089)。大鼠IL-1β、IL-6、TNF-α、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNG)、神经生长因子(nerve growth factor, NGF)的ELISA试剂盒购自江苏酶免实业有限公司。
45只Sprague-Dawley(SD)雄性大鼠(250~300 g)购自空军军医大学动物实验中心。实验方案获得空军军医大学动物伦理委员会批准(许可证号:IACUC-20191008)。
1.2 方法
1.2.1 动物分组及光照 在标准条件下(温度:22~25 ℃,相对湿度:45%~65%,12 h光/12 h暗循环,充足食物和水)饲养大鼠。SD大鼠被随机分为3组:Sham组、SCI组和SCI+PBM组,每组15只。SCI模型采用课题组之前选用的改良双侧脊髓钳夹模型[13]:通过腹腔注射10 g/L戊巴比妥钠麻醉大鼠,后背皮肤行正中线切口,暴露T10棘突,并在T10处进行椎板切除术,显露脊髓,再通过镊子钳夹脊髓40 s造成SCI。Sham组大鼠仅打开椎板不损伤脊髓。SCI+PBM组埋置光纤方法如下:用缝线将光纤前端固定在T8棘突的软组织上,光纤后端与激光照射装置对接,检查光纤的发光特性,确认光线可以直接投射到脊髓表面,然后用缝线将光纤的后端固定在T12棘突的软组织上,依次缝合肌肉和皮肤。在整个实验过程中,将大鼠放在加热垫上保持在约37 ℃的温度。术后5 d内每天通过腹腔注射1 mL的头孢唑林注射液预防感染。每日两次辅助性排尿缓解尿潴留,直至自主排尿恢复。Sham组与SCI组不行激光照射,SCI+PBM组激光照射的参数依据先前的研究设定[14]。有研究表明波长在700~770 nm之间的光对生物的刺激活性较弱,而在1 200 nm以上波长的光会被水分子明显地吸收,大约810 nm波长具有最佳治疗效果[15-17]。meta分析结果提示,时间达14 d的光生物调节可以更好地恢复SCI后运动功能[17]。因此,本实验拟定每日1次照射,每次60 min,连续进行2周的治疗方案。轻微麻醉SCI+PBM组大鼠,并将其放入温暖的笼中,使用 810 nm 半导体激光器(MW-GX-808,中国长春镭仕光电有限公司,810 nm波长,150 mW输出功率)进行照射。
1.2.2 Western blotting 造模14 d后生理盐水灌注大鼠,剥离出以损伤部位为中心的1 cm脊髓节段,研磨器匀浆,RIPA裂解液裂解,13 000 r/min离心10 min取上清,BCA法测定蛋白浓度,蛋白煮沸后上样,电泳,转膜,脱脂奶粉封闭,加入相应一抗SOD-1(1∶1 000),Nrf2(1∶500),HO-1(1∶2 000),β-actin (1∶1 000),4 ℃过夜。TBST洗膜,二抗(1∶2 000)室温孵育1 h,TBST洗膜,发光显影。
1.2.3 酶联免疫吸附测定(enzyme-liked immunosorbent assay, ELISA) 使用生理盐水灌注大鼠,取出以损伤部位为中心的1 cm脊髓节段并匀浆,离心,吸取上清。根据试剂盒说明书进行后续操作,使用酶标仪分析上清液中炎性因子和神经生长因子的含量。
1.2.4 免疫荧光染色 造模14 d后多聚甲醛灌注大鼠,以损伤部位为中心解剖2 cm长的脊髓段,多聚甲醛固定24 h,200 g/L蔗糖沉糖24 h,OCT包埋,使用徕卡冰冻切片机,矢状位切片,厚度7 mm。PBS冲洗3次,每次5 min。在室温下用含有3 mL/L Triton X-100 打孔20 min,PBS冲洗3次,每次5 min。驴血清封闭切片1 h,然后将切片与一抗MAP2(1∶400)在4 ℃下孵育过夜。PBS冲洗,加入二抗(1∶400)37 ℃下孵育1 h,加DAPI封片。TUNEL染色方法如下:PBS洗涤切片2次,每次10 min。5 mL/L Triton X-100室温孵育5 min。配制TUNEL检测液,37 ℃避光孵育1 h, 加DAPI封片。图像在共聚焦显微镜下拍摄。每张切片在损伤区分别采集3张图片,用于统计分析。
1.2.5 HE染色 冰冻切片水洗1 min,苏木精液染色60 s,流水洗去苏木精,浸入10 mL/L盐酸和乙醇的混合液中3 s,水洗1 min,浸入促蓝液中10 s,流水冲洗1 min,5 mL/L伊红液染色1 min,水洗1 min,浸入800 mL/L乙醇2 s,950 mL/L乙醇2 s,无水乙醇1 min,石炭酸二甲苯1 min,二甲苯(Ⅰ)1 min,二甲苯(Ⅱ)1 min,中性树胶封片。
1.2.6 运动功能评估 采用Basso-Beattie-Bresnahan(BBB)评分评定SCI后瘫痪的严重程度[18],由两名熟悉评分标准且与实验无关的实验员独立观察并且评分,0分表示后肢完全瘫痪,21分表示后肢运动完全正常,取两名实验员评分的平均值作为最终得分。足印记法,即将大鼠的后肢足背染上红色墨水,足底染上蓝色墨水,让动物自由穿过铺垫白纸的过道(宽21 cm,长100 cm),观察大鼠脚印情况。测量步宽(两后肢足迹中心之间的垂直距离)[19]。
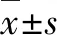
2 结果
2.1 PBM促进SCI大鼠氧化应激指标改善
SCI后线粒体产生过量的活性氧,炎性因子大量分泌从而加重SCI[20]。此外,氧化应激也通过破坏细胞膜和内质网的稳定性而导致细胞死亡[21]。转录因子Nrf2是调节细胞抗炎和抗氧化反应相关基因表达的重要分子[22]。正常生理情况下在细胞质中与结合蛋白Keap1相互作用,并经由泛素-蛋白酶体通路降解。机体受到氧化应激时,Nrf2进入细胞核发挥作用,调节一系列具有抗氧化和抗炎作用的酶的表达[23]。Nrf2敲除的小鼠SCI后IL-6和IL-1水平的升高是后肢运动功能障碍的主要原因[24]。Western blotting结果提示,Nrf2蛋白水平在SCI后明显降低,与Sham组相比差异有统计学意义(P<0.01),而光照治疗后Nrf2蛋白水平与SCI组相比明显上升(P<0.05)。其下游调控的抗氧化酶HO-1在光照后与SCI组相比也明显上升(P<0.05),但是SOD-1蛋白水平在光照后两组间没有明显差异(图1)。
Sham组:假手术组;SCI组:脊髓损伤组;SCI+PBM组:脊髓损伤加光生物调节组。 Nrf2:NF-E2相关因子2;HO-1:血红素氧合酶1;SOD-1:超氧化物歧化酶1。 aP<0.05, bP<0.01。图1 PBM对氧化应激指标表达的影响
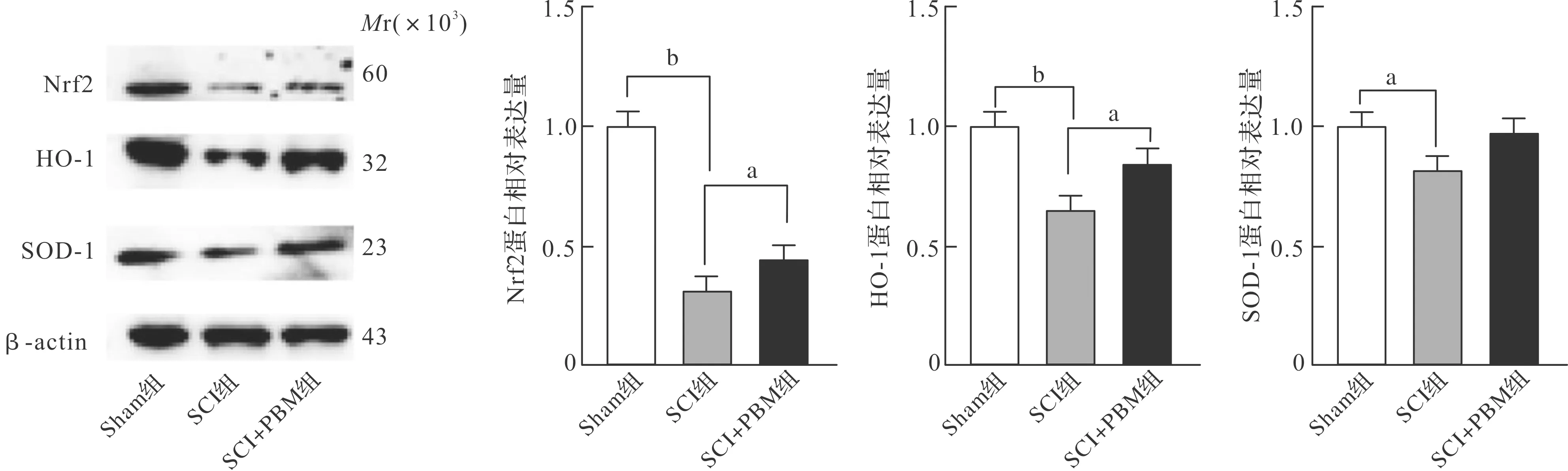
2.2 PBM减轻炎症反应,促进生长因子分泌
ELISA结果提示,造模14 d后,SCI组炎性因子IL-1β、IL-6、TNF-α水平与Sham组相比明显上升(P<0.01),SCI+PBM组炎性因子IL-1β、IL-6、TNF-α水平较SCI组明显降低,差异有统计学意义(P<0.05)。另一方面,SCI组BDNF、GDNF、NGF水平与Sham组相比明显下降(P<0.05),而SCI+PBM组NGF、BDNF水平与SCI组相比明显升高(P<0.05),GDNF水平虽有升高却没有明显改变(图2),可能的原因是GDNF开始表达相对于其他神经生长因子比较滞后[25]。
Sham组:假手术组;SCI组:脊髓损伤组;SCI+PBM组:脊髓损伤加光生物调节组;BDNF:脑源性神经营养因子;GDNF:胶质细胞性神经营养因子;NGF:神经生长因子。 aP<0.05, bP<0.01。图2 PBM对炎性因子及神经生长因子表达的影响
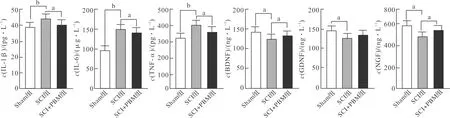
2.3 PBM促进SCI大鼠神经元再生并抑制凋亡
60倍镜下可见14 d后SCI组 MAP2荧光强度较Sham组相比明显下降(P<0.01),而SCI+PBM组MAP2表达与SCI组相比明显升高(P<0.05)。TUNEL染色提示光照干预后TUNEL阳性细胞数较SCI组相比明显降低(P<0.01,图3)。

Sham组:假手术组;SCI组:脊髓损伤组;SCI+PBM组:脊髓损伤加光生物调节组。标尺为20 μm。 aP<0.05, bP<0.01。图3 PBM对神经生长及细胞凋亡的影响
2.4 PBM促进SCI大鼠运动功能恢复
足印记图像显示,损伤后SCI组大鼠双后肢足背触地,后肢呈拖行状态,前后肢协调性差,步宽较Sham组相比明显变大(P<0.01)。光照治疗后,SCI+PBM组足底触地,运动功能明显改善,前后肢协调性提高,步宽与SCI组相比明显下降(P<0.05)。HE染色提示,光照治疗后,SCI+PBM组空洞面积明显小于SCI组(P<0.01)。BBB评分提示,造模后1 dSCI组和SCI+PBM组评分均为0分,表明造模成功,损伤后1~7 d BBB评分提高,表明瘫痪有所恢复,但两组评分无明显差异,至第8日两组评分出现差异(P<0.05),14 d时,SCI组评分为(3.8±0.2)分,SCI+PBM组评分为(8.2±0.57)分,二者差异有明显统计学意义(P<0.01,图4)。
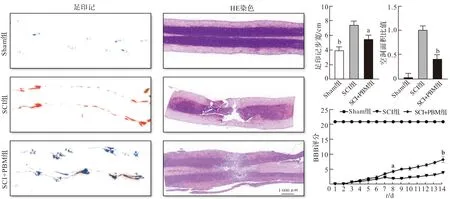
Sham组:假手术组;SCI组:脊髓损伤组;SCI+PBM组:脊髓损伤加光生物调节组。 aP<0.05, bP<0.01 vs SCI组。图4 PBM对损伤后运动功能的影响
3 讨论
利用红光或近红外光进行PBM是一种针对多种神经和心理疾病治疗的创新策略,PBM可以促进神经生长,抗凋亡、抗炎和抗氧化[26],其治疗效果已经在神经系统疾病、周围神经损伤、止痛和伤口愈合等研究中得到证实[27]。
在SCI研究领域,PBM可以通过激活转录因子、增强线粒体呼吸状态、减少炎症因子产生、增加血管生成和神经生长来促进伤口愈合、修复组织,从而恢复运动功能[7,28]。SCI后经过PBM治疗可以通过调节免疫细胞在脊髓中的迁移来减少炎症反应,防止损伤后髓鞘的破坏,从而促进组织修复,减少损伤及并发症的发生[29]。波长不同治疗效果也不同,PBM在630~850 nm范围内表现出较强的抗炎能力,而使用较低波长(589 nm)在抑制炎症方面效果不明显[30]。此外PBM通过平衡化学介质、扩张动脉、增加皮质醇和内啡肽合成来控制神经病理性疼痛[31]。有研究表明,PBM通过降低疼痛标志物IL-6的表达减轻SCI后病理性疼痛,且连续14 d的治疗效果优于7 d的治疗[32-33],可能的机制是通过抑制花生四烯酸的级联反应,减少环氧合酶和前列腺素E2的产生,从而降低IL-6生成[34]。PBM还可以增加BDNF、GDNF和GABA受体的表达[35]。值得注意的是,该研究中GDNF的升高是在4周后测得的,但SCI组与治疗组间GDNF水平没有差异性,这也与本文的实验结果相吻合。GABA通路是脊髓疼痛控制重要的机制,SCI增加后GABA受体的表达可减轻神经性疼痛[36]。
本课题组长期致力于研究PBM治疗SCI的作用机制和临床转化,前期研究表明激光照射可以显著降低炎性因子IL-6、TNF-α表达,提高抗炎因子IL-10水平以减轻炎症反应,促进损伤后运动功能恢复[37]。深入研究发现PBM通过激活巨噬细胞中的PKA-CREB通路,促进多种神经营养因子的分泌,最终促进轴突再生[38]。M1型巨噬细胞促进促炎因子的分泌并具有神经毒性,而M2型巨噬细胞可抑制炎症反应并促进轴突生长,光可以促进M1型巨噬细胞向M2型巨噬细胞转化以促进轴突生长[39]。损伤早期巨噬细胞促进星形胶质细胞极化,促进瘢痕形成[14]。光照后星形胶质细胞标志物GFAP、瘢痕形成的重要因子STAT3以及胶质瘢痕形成的关键因子硫酸软骨素蛋白多糖的表达均明显下降[14]。
既往研究集中于经皮照射而非体内埋置光纤。由于皮肤、肌肉和骨骼的吸收程度不同,它们对光的散射程度也不同,不能保证能量完全到达受伤部位,造成治疗效果不理想,从而限制了PBM疗法在SCI领域的临床应用。有文献报道,光的衰减是与距离有关的函数。使用一种功率为35 mW/cm2的设备将光从毛发完整的皮肤表面透过所有中间组织层打到脊髓表面,最后只有9%的光能量到达脊髓腹侧[40]。而使用一种功率为16 mW/cm2的设备,在同样条件下,只有6.6%的光能量到达脊髓腹侧[41]。因此,距离和功率都会影响最终到达脊髓表面的能量水平。体内埋置光纤相比于经皮照射排除了中间组织吸收能量的影响,提高了能量利用率,从而大大提升了治疗效果,其可行性和有效性均得到了验证[42],且对损伤区周围细胞没有产生毒性作用[43]。但是对于SCI的治疗作用尚未明确,课题组因此以SCI治疗为出发点,探讨其对SCI的修复作用。
氧化应激是SCI的重要病理生理过程,依赖损伤后应激产生的Nrf2显然不能有效减轻氧化应激带来的损伤。PBM可以通过作用于线粒体,诱导抗氧化转录因子表达[6]。在本实验中,光照治疗后Nrf2表达明显上调并带动其下游的抗氧化酶HO-1表达增高。此变化趋势与弱激光的抗氧化功能相吻合。HO-1是一种细胞保护分子,可以抵抗各种形式的细胞死亡,包括坏死、凋亡和铁死亡[44]。 诱导HO-1的表达可通过降低前列腺素水平而减轻SCI后神经病理性疼痛和痛觉过敏[45]。进一步研究发现,体内埋置光纤后,治疗组炎性因子水平相比于损伤组明显降低,证明了体内埋置光纤不仅没有产生炎症排异反应,反而减轻了炎症反应。既往文献表明Nrf2/HO-1通路相关蛋白升高后会下调炎性小体NLRP3表达,后者通过招募IL-1的前体和Caspase-1导致炎症反应和细胞凋亡[46]。使用Nrf2抑制剂能够明显升高炎性小体的水平并且加重细胞损伤[47]。ELISA结果表明,光照后,部分神经营养因子明显升高,可能的原因是损伤区微环境改善,为细胞分泌生长因子提供了一个良好的条件。荧光结果提示,光照促进了神经元生长,抑制了细胞凋亡。光照组HE染色空洞面积明显小于损伤组,BBB评分和后肢运动功能都有明显改善。这些结果都表明经过体内埋置光纤干预后,通过减轻氧化应激及炎症反应,促进了神经生长及运动功能恢复。当然,本实验研究内容有限,未来研究应该聚焦于PBM作用于不同细胞及细胞器的具体作用机制以及更广泛的损伤恢复评价指标,为SCI治疗提供新的思路和作用靶点。
