新型冠状病毒核蛋白抗原含量ELISA 检测方法的建立及验证
2022-08-17王文辉宫立孟林凤杰李伟王凯文杨东升郭靖孟胜利王泽鋆申硕
王文辉 ,宫立孟 ,林凤杰 ,李伟 ,王凯文 ,杨东升 ,郭靖 ,孟胜利 ,王泽鋆 ,申硕
1.武汉生物制品研究所有限责任公司,湖北 武汉 430207;2.国家联合疫苗工程技术研究中心,湖北 武汉 430207;3.武汉药品医疗器械检验所,湖北 武汉 430207
新型冠状病毒肺炎(Coronavirus Disease 2019,COVID-19)是由重症急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARSCoV-2)引起的一种以发热、干咳、乏力等为主要症状,严重者进展为呼吸困难、急性呼吸窘迫综合征、多器官功能衰竭甚至死亡的急性和烈性传染病[1-2]。WHO 公布的数据显示,截至 2022年 3 月 29 日,全球COVID-19 累计确诊病例达481 756 671 例,其中死亡病例6 127 981 例,严重威胁人类生命健康,也给全球经济造成巨大打击[3-5]。
疫苗是COVID-19 疫情防控的重要手段,目前全球已有153个候选疫苗进入临床试验阶段[3]。刺突蛋白(spike protein,S 蛋白)和核衣壳蛋白(nucleocapsid protein,N 蛋白)为 SARS-CoV-2 的主要结构蛋白,目前的研究多集中在存在大量中和表位的S 蛋白上,而 N 蛋白也含有大量 B 细胞、T 细胞抗原表位,在病毒的复制机免疫调节中发挥着重要作用[6-9],但有关N 蛋白的研究,特别是检测方法报道较少[10-12]。
本研究利用灭活SARS-CoV-2 免疫家兔制备了多克隆抗体和N 蛋白单克隆抗体,建立了N 蛋白抗原含量ELISA 检测方法,并对方法准确度、精密度、特异性、耐用性进行验证,确定线性范围及检出限。多克隆抗体作为包被抗体提升了检测方法的灵敏度,N 蛋白单克隆抗体作为检测抗体保证了方法的特异性。本研究建立的方法适用于SARS-CoV-2 灭活疫苗工艺过程阶段样品中N 蛋白抗原含量检测,可进行质量监测。
1 材料与方法
1.1 细胞、参考品及样品 Vero 细胞裂解液、SARSCoV-2 内部参考品、连续3 批SARS-CoV-2 灭活疫苗工艺过程阶段样品[水解病毒浓缩液(S)、凝胶过滤层析液(G)、离子交换层析液(C)、原液(Y)]均由武汉生物制品研究所有限责任公司提供。
1.2 实验动物 SPF 级 BALB / c 小鼠,雌性,6 ~ 8周龄,体重18 ~22 g,由武汉生物制品研究所有限责任公司实验动物室提供,动物合格证号:4200040-0009677;日本大耳白兔,雌性,12 ~ 14 周龄,体重2.2 ~2.5 kg,由武汉生物制品研究所有限责任公司实验动物室提供,动物合格证号:42000400009665。本实验均以科研为目的进行BALB / c 小鼠和日本大耳白兔的养殖和使用,且按照动物伦理相关规定进行(WIBP-A II 382020001)。
1.3 主要试剂及仪器 羊抗小鼠HRP-IgG、羊抗兔HRP-IgG 购自武汉博士德生物工程有限公司;抗体亚类鉴定试剂盒购自洛阳赛尔维实验器材有限公司;弗氏完全佐剂、弗氏不完全佐剂、HRP 购自美国 Sigma 公司;SARS-CoV-2 原型株灭活病毒纯化抗原由武汉生物制品研究所有限责任公司提供;重组N 蛋白、病毒受体结合位点蛋白(receptor-binding domain,RBD)、S 蛋白购自北京义翘神州生物技术有限公司;ELISA 相关试剂为武汉生物制品研究所有限责任公司病毒性疫苗研究一室配制;AKTA蛋白纯化系统、Protein G 亲和层析、Protein A 亲和层析购自美国GE 公司。
1.4 抗原鉴定 采用4% ~20%梯度变性胶,SDSPAGE 鉴定蛋白纯度,透射电镜鉴定颗粒形态和完整性,动态光散射(dynamic light scattering,DLS)分析病毒粒径。
1.5 多克隆抗体和单克隆抗体的制备、纯化及鉴定
1.5.1 抗体制备 将SARS-CoV-2 原型株灭活病毒纯化抗原与弗式完全佐剂混合后,皮下注射免疫日本大耳白兔,初次免疫2 周后,将纯化抗原与弗式不完全佐剂混合后进行加强免疫,随后进行多针次加强免疫,提高抗血清抗体效价和亲和力。免疫剂量均为 200 μg / 剂。于 4 次免疫后 10 d,经兔颈动脉采血,分离血清。
将纯化抗原与弗式佐剂(初次免疫采用弗氏完全佐剂,加强免疫采用弗氏不完全佐剂)混合后,腹腔免疫 BALB / c 小鼠,共免疫 4 次,免疫剂量均为50 μg / 剂,每次间隔 14 d。经眼眶采血,分离血清,间接ELISA 法检测抗体效价[10]。融合前,尾静脉冲击免疫10 μg,冲击免疫后3 d 进行脾脏淋巴细胞与骨髓瘤细胞的融合。融合2 只小鼠脾细胞,用纯化灭活病毒抗原(Virion)(即原液)、RBD 蛋白和 N 蛋白包被微孔板筛选,并用蚀斑减少中和试验(plaque reduction neutralization test,PRNT)[13]检测部分阳性克隆中和效价。
1.5.2 抗体纯化及鉴定 采用AKTA 蛋白纯化系统纯化血清和腹水抗体,Protein G 亲和层析纯化兔多克隆抗体。间接ELISA 法检测抗体效价[10],12%SDS-PAGE 鉴定抗体纯度。
采用Protein A 亲和层析纯化腹水单克隆抗体。间接 ELISA 法检测抗体效价[10],12% SDS-PAGE 鉴定抗体纯度,小鼠抗体亚型检测试剂盒鉴定单克隆抗体亚型。
1.6 SARS-CoV-2 N 蛋白抗原含量检测方法的建立
1.6.1 检测抗体的HRP 标记 用过碘酸钠氧化法对单克隆抗体5E11 进行标记[14],偶联HRP 分子,制备5E11-HRP。
1.6.2 方法的建立 利用方阵滴定法[11]对包被兔多克隆抗体(50 ~ 800 ng / 孔)和酶标抗体 5E11-HRP(1 ∶500 ~ 1 ∶8 000)进行优化,确定最佳工作浓度,建立SARS-CoV-2 N 蛋白抗原含量ELISA 检测方法。
1.7 SARS-CoV-2 N 蛋白抗原含量ELISA 检测方法的验证
1.7.1 线性范围及最低检出限 用含1% BSA 的PBST 将SARS-CoV-2 内部参考品依次稀释至200.0、100.0、50.0、25.0、12.5、6.3、3.1、1.6 WU / mL,用建立的方法进行检测。以抗原浓度的对数值为横坐标,对应的吸光度值的对数值为纵坐标,绘制标准曲线,得出线性方程及线性范围,重复3 次。
1.7.2 特异性 用建立的方法分别检测SARSCoV-2 原型株灭活病毒纯化抗原、N 蛋白、S 蛋白、RBD 蛋白、BSA、Vero 细胞裂解液反应性。
1.7.3 准确度 将SARS-CoV-2 内部参考品稀释至高、中、低(100、50、25 WU / mL)3个浓度,用建立的方法进行检测,重复3 次,计算回收率。
1.7.4 精密度
1.7.4.1 重复性 将SARS-CoV-2 内部参考品稀释至100 WU / mL,用建立的方法进行检测,重复6次,计算抗原含量及重复检测的CV。
1.7.4.2 中间精密度 将SARS-CoV-2 内部参考品稀释至100 WU / mL,用建立的方法进行检测,2个实验员分别重复6 次,计算抗原含量及2个实验员重复检测的CV。
1.7.5 耐用性 对影响检测结果的主要因素,包括孵育时间、孵育温度和加样体积进行耐用性分析。理想操作,即全程孵育温度37 ℃,孵育时间60 min ~60 min ~ 30 min,加样体积 100 μL;设置偏差下限,即全程孵育温度35 ℃,孵育时间55 min ~55 min ~25 min,加样体积95 μL;设置偏差上限,即全程孵育温度 39 ℃,孵育时间 65 min ~ 65 min ~ 35 min,加样体积为105 μL。回收率应在80% ~120%范围内。在以上3 种条件下,用建立的方法检测高、中、低(100、50、25 WU / mL)浓度 SARS-CoV-2 内部参考品。
1.8 SARS-CoV-2 N 蛋白抗原含量ELISA 检测方法的初步应用 用建立的方法检测3 批SARS-CoV-2灭活疫苗工艺过程阶段样品,即水解病毒浓缩液(S)、凝胶过滤层析液(G)、离子交换层析液(C)、原液(Y)的抗原含量。
1.9 统计学分析 应用Statistical Analysis 软件采用双平行线法对抗原含量检测结果进行统计学分析,以P <0.05 为差异有统计学意义。
2 结 果
2.1 SARS-CoV-2 全病毒颗粒抗原鉴定 SDS-PAGE分析显示,在相对分子质量约25 000、55 000 和250 000 处,可见明显条带,大小与 M、N 和 S 蛋白相符,见图1A;电镜和DLS 结果显示,病毒颗粒形态完整,呈典型的冠状病毒形态特征,病毒颗粒外膜上可见明显的S 刺突蛋白,粒径分布均一,颗粒分布峰型对称,直径约120 nm,见图1B 和C。

图1 病毒颗粒的纯化鉴定Fig.1 Identification of purified virus particles
2.2 抗体的制备 共筛选出16 株SARS-CoV-2 单克隆抗体,最终挑选16个克隆株制备腹水。所有单克隆抗体均可与全病毒呈良好的反应特性;所有具中和活性的单克隆抗体均可识别病毒颗粒和RBD,显示RBD 为S 蛋白的优势中和位点,与预期一致;其中1 株克隆株(5E11)识别核衣壳蛋白和病毒颗粒,但不具备中和活性。见图2。

图2 单克隆抗体特异性及中和活性分析Fig.2 Specificity and neutralizing activity of McAbs
2.3 纯化多克隆抗体和单克隆抗体的鉴定 ELISA检测结果显示,抗SARS-CoV-2 兔多克隆抗体及抗SARS-CoV-2 单克隆抗体5E11 腹水的效价分别为106和105,经抗体亚类鉴定其亚型为IgG2b。
SDS-PAGE 分析显示,纯化的抗SARS-CoV-2 兔多克隆抗体及抗SARS-CoV-2 单克隆抗体5E11 腹水相对分子质量在25 000 ~50 000 之间,分别可见与预期重链、轻链相符的条带,其他位置未见明显条带,见图3。

图3 纯化抗体的鉴定Fig.3 Identification of purified antibodies
2.4 SARS-CoV-2 N 蛋白抗原含量ELISA 检测方法的建立
2.4.1 包被抗体和检测抗体 为保证双抗体夹心ELISA 体系最大程度地捕获待测SARS-CoV-2 抗原,选择高效价SARS-CoV-2 兔抗血清纯化后的多克隆抗体作为包被抗体;为保证双抗体夹心ELISA 体系的特异性,选择特异性强的单克隆抗体5E11 作为检测抗体。
2.4.2 方法建立 确定包被抗体最佳工作浓度为100 ng / 孔,酶标抗体最佳工作浓度为 1 ∶1 000。将纯化的SARS-CoV-2 兔多克隆抗体用0.05 mol / L碳酸盐缓冲液(pH 9.6)稀释至 1 ∶1 000,包被微孔板,100 μL / 孔,4 ℃包被过夜;PBST 洗板 3 次后,加入封闭液(含 1% BSA 的 PBST),200 μL / 孔,37 ℃封闭1 h;弃封闭液,37 ℃干燥2 h 制成包被微孔板;加入稀释的待测样品,100 μL / 孔,37 ℃孵育 1 h;洗板 5 次,加入 5E11-HRP(1 ∶1 000 稀释),100 μL / 孔,37 ℃孵育 1 h;TMB 显色 30 min,2 mol / L H2SO4终止反应。
2.5 SARS-CoV-2 N 蛋白抗原含量ELISA 检测方法的验证
2.5.1 线性范围及最低检出限 重复检测3 次的标准曲线方程分别为:y=0.714 7 x-1.212、y=0.688 4 x -1.139 8 和 y = 0.729 8 x - 1.266 8,R2分别为0.994 3、0.991 2 和 0.994 6。抗原含量在 1.6 ~200 WU / mL 范围内,与对应 A 值呈良好的线性关系,R2> 0.99。该方法最低检出限为 1.6 WU / mL。见图4。

图4 方法的线性验证Fig.4 Verification linearity of developed method
2.5.2 特异性 结果显示,该方法可特异性识别SARS-CoV-2 全病毒Virion、重组N 蛋白,而不识别S 蛋白、RBD 蛋白、BSA 及 Vero 细胞裂解液,见图 5。表明建立的方法特异性良好。

图5 方法的特异性验证Fig.5 Verification for specificity of developed method
2.5.3 准确度 高、中、低浓度SARS-CoV-2 内部参考品检测均值回收率分别为104.33%、101.33%和98.67%,CV 分别为 7.06%、7.47%和 12.39%,见表1。表明该方法准确度良好。

表1 方法的准确度验证结果Tab.1 Verification for accuracy of developed method
2.5.4 精密度
2.5.4.1 重复性 100 WU / mL SARS-CoV-2 内部参考品 6 次检测值分别为 109、112、89、95、103、99 WU / mL,均值为 101.17 WU / mL,CV 为 8.54%。表明该方法重复性良好。
2.5.4.2 中间精密度 100 WU / mL SARS-CoV-2内部参考品2 名实验员分别重复检测6 次,合并计算均值为 99.33 WU / mL,CV 为 8.37%,见表 2。表明该方法中间精密度良好。

表2 方法的中间精密度验证结果Tab.2 Verification for intermediate precision of developed method
2.5.5 耐用性 高、中、低浓度SARS-CoV-2 内部参考品不同检测条件的回收率在88% ~112%之间,见图6。表明该方法耐用性良好。

图6 方法的耐用性验证Fig.6 Verification for durability of developed method
2.6 方法的初步应用 结果显示,水解病毒浓缩液(S)、凝胶过滤层析液(G)、离子交换层析液(C)、原液(Y)均可检测到N 蛋白抗原含量及不同过程样品N 蛋白抗原含量变化,见图7。表明该方法适用于SARS-CoV-2 灭活疫苗工艺过程阶段样品中N 蛋白抗原含量检测,可作为S 抗原含量监测的补充,进行质量监测。
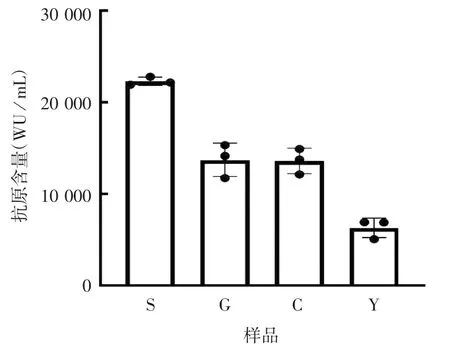
图7 SARS-CoV-2 灭活疫苗工艺过程阶段样品中N 蛋白抗原含量检测Fig.7 Determination of NP antigen content in various steps of inactivation process of SARS-CoV-2 vaccine
3 讨 论
目前虽然已有药物被批准用于治疗SARS-CoV-2 感染,但药物治疗成本高,且SARS-CoV-2 传染性强、治疗后存在后遗症,疫苗仍然是控制SARS-CoV-2 感染和传播最有效的手段[13,15-16]。N 蛋白是 S 蛋白之外的另一个主要结构成分,具有细胞介导免疫应答的抗原位点,可作为先天性和适应性免疫反应的抗原刺激物。对疫苗工艺过程及原液中N 蛋白进行定量,是优化工艺、控制疫苗质量的必要手段[9,12]。N蛋白介导的细胞免疫应答在疫苗预防疾病效力方面值得进一步研究。
本研究利用灭活SARS-CoV-2 免疫家兔制备了抗病毒颗粒多克隆抗体和抗N 蛋白单克隆抗体,建立了一种N 蛋白ELISA 检测方法。经验证,该方法具有良好的特异性、准确度、精密度和耐用性,可用于SARS-CoV-2 灭活疫苗工艺过程阶段样品中N 蛋白抗原含量检测,进行质量监测。
本研究使用的多克隆抗体为灭活病毒抗原免疫家兔制备,N 蛋白单克隆抗体为灭活病毒抗原免疫小鼠,经杂交瘤融合细胞筛选制备,具有比基因工程表达抗原免疫动物制备的抗体对天然病毒有更高的亲和力,能够识别病毒天然构象。因此,该方法还可用于SARS-CoV-2 临床抗原诊断,截至2022年4 月2 日,国家药监局已批准24 种SARS-CoV-2 抗原检测试剂上市,其中17 种为胶体金法,4 种为乳胶法,3 种为荧光免疫层析法。本研究建立的方法与胶体金等方法相比,具有高敏感性、高通量,且可定量,具有一定优势。核酸检测仍是SARS-CoV-2 诊断的金标准,但基于N 蛋抗原的ELISA 检测方法可作为现有检测方法的补充,提高诊断效率并降低检测成本。
综上所述,本研究以SARS-COV-2 多克隆抗体为捕获抗体,单克隆抗体5E11 为检测抗体,初步建立了SARS-CoV-2 N 蛋白抗原含量ELISA 快速检测方法。该方法可用于SARS-CoV-2 灭活疫苗工艺过程阶段样品中N 蛋白抗原含量检测,同时为SARSCOV-2 的临床诊断提供了思路和方法。
