ALPPS 动物模型构建及相关研究的新进展
2022-08-16穴陈
陈 穴陈 耿
(陆军军医大学 大坪医院肝胆外科,重庆 400042)
肝切除术是首选的肝癌根治性治疗手段。 但我国肝癌患者的手术切除率仅有15%~25%。 相当部分患者因切除肿瘤后剩余的功能性肝组织体积(future liver remnant, FLR)过小而被迫放弃手术切除。 对于正常肝,FLR 必须大于25%;而对于硬化肝,FLR 至少要求高于40%。 故FLR 不足是目前制约肝外科发展的“阿喀琉斯之踵”[1]。 传统的促进FLR 增生的手段主要是门静脉栓塞(portal vein embolization, PVE),但其效果非常有限。 近年来,有学者先后报道了联合肝分隔和门静脉结扎的二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS),促进FLR 增生的速度和幅度远优于PVE[2]。 目前对ALPPS 促进余肝快速增生的机制并不十分清楚[3]。 鉴于此,在动物模型上复制ALPPS,有助于深入研究其加速肝再生的分子机制,具有重要的理论和现实意义。
1 ALPPS 动物模型的现状
当前关于ALPPS 动物模型的构建已经取得了诸多进展(表1)。 一般认为,理想的ALPPS 动物模型必须具备如下条件:(1)预留肝叶必须有独立的血液流入道(门静脉和肝动脉)和流出道(肝静脉);(2)预留肝叶和待切除肝叶之间必须充分劈离,以防二者之间出现侧支循环[4]。
1.1 大动物ALPPS 模型
既往研究显示猪与人的肝在解剖学和生理学上有许多相似之处,因此长期被用于实验外科研究[27-30]。 猪肝的结构较为简单,血管铸型研究发现,猪肝是高度分叶的,肝实质能做到完全离断,肝静脉和下腔静脉很近,被尾状叶包裹。 猪行ALPPS 后FLR 增生非常显著[21]。 但由于动物体积大,手术及麻醉操作复杂,成本较高,因而较少使用。 羊也可以用于构建ALPPS 动物模型[4],但羊是一种反刍动物,它的胃肠道在进食后容易产气,不仅会导致胃膨胀,还会让肝门区域的游离变得困难。 羊的血管壁很薄,在离断肝实质的过程中容易出血,因此操作需要非常精细。
1.2 中型动物ALPPS 模型
兔作为中等大小的动物,也被广泛用于肝再生研究,是肝部分切除、门静脉结扎(portal vein ligation, PVL)或PVE 动物模型的理想选择。 有学者对兔的不同门静脉分支进行结扎并结合肝实质分隔,结果均能促进肝再生,但由于兔肝的解剖结构复杂,使得对其行ALPPS 极其困难,实验中动物的死亡率较高[16]。 所以兔作为ALPPS 动物模型的稳定性还有待进一步提高。
1.3 小动物ALPPS 模型
小动物(大/小鼠)是一个很好的选择,因为这些动物很容易饲养和管理,且价格便宜。 从生理上讲,它们生理代谢更快,解剖结构简单,手术操作更容易,并且很容易实现标准化[31];同时对这些动物进行基因改造、诱发急性/慢性疾病、制作肿瘤模型也比较容易,且人类肝再生及肿瘤发生发展的相关基因在大鼠及小鼠中都可以找到对应的同源基因,因此来自大、小鼠的实验结论可能同样适用于大动物或者人类[32]。 另一个好处是,虽然小鼠和大鼠肝的解剖结构与人类有很大不同,但是中叶具有与人类肝相似的门脉结构,加上其强大的再生能力,完全能够满足ALPPS 动物模型的要求。
1.4 特殊类型的ALPPS 动物模型
我国是肝炎大国,每年新发的肝癌病例中,大部分伴有不同程度的肝炎后肝硬化[33]。 考虑到肝硬化对肝再生有明显的影响,建立肝硬化ALPPS 动物模型非常有必要。 目前大多用四氯化碳、硫代乙酰胺制作肝硬化模型。 有研究发现肝硬化时ALPPS 诱导的肝再生效果明显减弱,且具有较高的死亡率,并且再生启动较晚,且持续的时间比正常大鼠要长,可能与肝实质离断后肝内门体分流减少有关[24,34]。
通过高脂饲料喂养SD 大鼠建立非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)大鼠模型,发现与标准实验饲料喂养的大鼠相比,NAFLD大鼠FLR 的增长率、Ki-67(+)肝细胞和CD68(+)肝巨噬细胞(kupffer cell)细胞减少,但术后血清中白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平较对照组明显升高。 提示炎症性脂肪变性延缓了ALPPS 手术诱导的肝再生,但其机制尚不明确,有待进一步研究[22]。
2 大/小鼠ALPPS 模型建立的要点
从解剖学上看,大/小鼠的肝都有明显的分叶,通常由4 个主要的肝叶组成,分别称为右侧叶、中叶、左侧叶和尾状叶。 每个叶都有自己独立的门静脉、肝动脉和胆管系统。 4 个叶都通过单独的肝静脉与下腔静脉相连。 其中肝中叶分别由左、右门脉供血,左右两侧的动脉供应和胆管结构各不相同,该叶的流出道由左、右、中3 条肝静脉组成,人肝的情况也是如此。 因此选择切开肝中叶最能模拟人类肝的劈离。 在制作大/小鼠ALPPS 模型时,通往右、左、尾状叶的门静脉分支必须结扎,只留下中叶门静脉灌注(图1)[13,35]。 由于肝右中叶约占肝总体积的20%,与临床上行ALPPS 前的PVL 相近[23],因此建立模型时通常将肝右中叶作为预留肝。 实验室研究发现在研究门静脉血流和压力变化、肝组织灌注和氧合等生理机制方面,大鼠模型优于小鼠模型,大鼠模型不需要切除左外侧叶和胆囊,从而避免了对相关研究结果的潜在影响。

图1 结扎右侧叶、左中叶、尾状叶及左外侧叶的门静脉分支Figure 1 Ligation of portal vein branches of RL, LML, CL and LLL
大/小鼠ALPPS 一期术中,除了行PVL 外,还需要沿着肝中叶缺血线劈开(图2、3),这也是该模型的重点与难点。 正确估算肝实质劈离的深度相当困难,下腔静脉一旦损伤就难以止血,靠近下腔静脉的肝后部分劈开可减少并发症的发生。 多项研究表明,保持与下腔静脉的最小距离约为5 mm,可以避免左、中肝静脉的损伤,从而避免大出血[4,13,17]。 在离断肝实质时,可以采用4-0 丝线结扎断面血管,也可以压迫止血、电凝止血,也可采用生物止血材料。
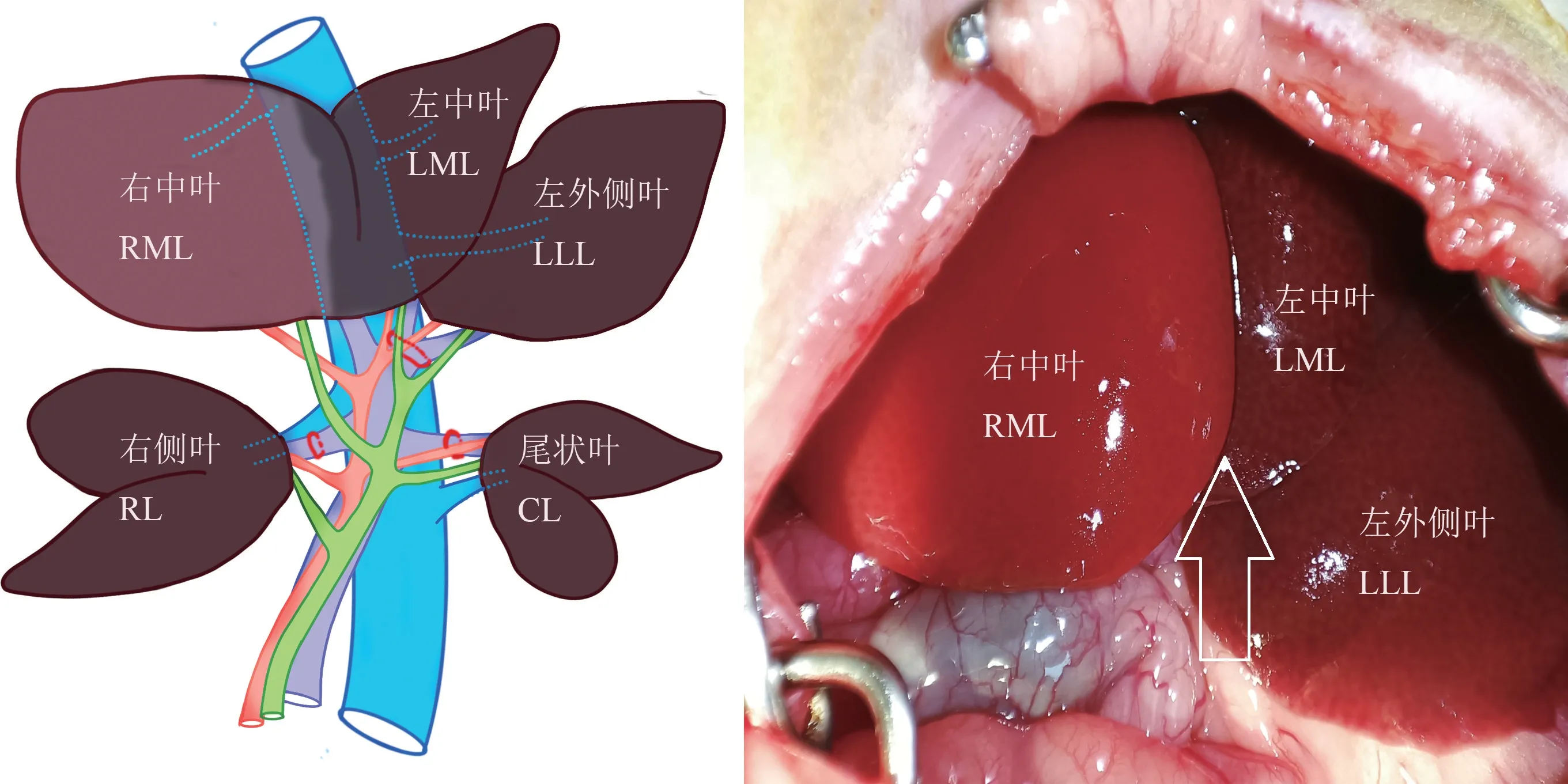
图2 肝中叶缺血线(白色箭头)Figure 2 Middle lobe ischemia line(white arrow)
部分学者在动物模型中进行了二期手术切除的尝 试[5,9,12-13,20-25,36]。 与 人 类 不 同, 大/小 鼠
ALPPS 术后肝的增生更为迅速。 有研究发现大鼠ALPPS 一期术后2 d FLR 即可增加153%,术后4 d可以增加260%[7]。 当然,由于手术方式不同,不同的研究报道的大/小鼠ALPPS 术后FLR 增生幅度差异较大,例如有研究发现ALPPS 一期术后7 d FLR 仅增生了68%[15]。 不过,大部分研究选择的一、二期手术间隔时间一般为2~7 d。 需要指出的是,两次手术间隔时间越长,腹腔粘连情况越明显,第二期手术也难度越大。
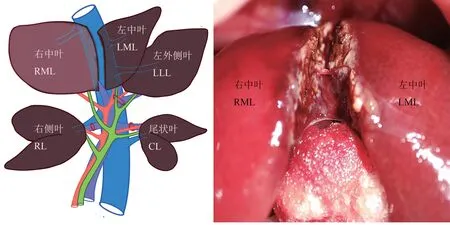
图3 肝左、右中叶横截面Figure 3 Cross section of left and right middle lobe
3 基于ALPPS 动物模型的相关研究
3.1 肝加速再生触发机制的研究
Kawaguchi 等[15]建立了大鼠ALPPS 静脉淤血模型(ALPPS+左肝静脉结扎),发现淤血组FLR 的增生较单纯ALPPS 组更为明显,Ki-67 阳性肝细胞的数量也大于ALPPS 组,提示肝劈开后的肝实质淤血对于ALPPS 术后肝再生有着非常显著的促进作用。 Schadde 等[37]发现由于肝动脉缓冲效应(hepatic arterial buffer response, HABR) 的存在,ALPPS 一期术后预留侧肝的肝动脉血流会显著下降并导致明显的肝组织缺氧;Kron 等[38]发现采用脯氨酰羟化酶抑制剂激活PVL 大鼠的缺氧信号通路可以显著加速肝组织再生,而消除ALPPS 大鼠肝组织缺氧则可以延缓肝再生,强烈提示组织缺氧可能是肝再生的重要加速因子;Dirscherl 等[39]也发现缺氧的肝星状细胞(hepatic stellate cells,HSC)中存在促血管生成因子的激活,能诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)依赖的血管生成,在快速肝再生中可能起着关键作用。
3.2 肝再生相关细胞因子的研究
多项研究发现,ALPPS 术后早期血清及肝组织生长因子(hepatocyte growth factor,HGF)、TNF-α、和IL-6 等的表达水平显著高于PVL 组,其中IL-6 的表达水平大约是PVL 组的6 倍,预留肝组织中TNFα、IL-6 和HGF 水平比对照组高约3 倍[8,10-11]。Schlege 等[5]将ALPPS 组小鼠血浆注射到PVL 组小鼠体内,使后者的预留肝再生速度可以达到前者水平,提示由创伤诱导增加的生长因子是ALPPS 促进FLR 增生的主要因素。 有学者复制该模型,发现射频消融联合PVL 促进FLR 增生的效果与ALPPS 相当,且细胞因子浓度无差异,与细胞增殖相关的基因表达也几乎相同,认为射频消融可以实现与肝实质离断相同的效果;通过基因分析,发现肝实质损伤之后释放的生长因子激活了参与细胞再生的基因,并下调了参与细胞动态平衡的基因[14]。
3.3 肝再生相关信号通路的研究
Langiewicz 等[19]发现c-Jun 氨基末端蛋白激酶1(JNK1)介导的肝星状细胞旁分泌IHH(Indian hedgehog)对于肝实质的加速再生是必需的,JNK1-IHH 轴是ALPPS 促进肝再生所特有的机制。 Shi等[9]发现ALPPS 后信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)和YAP 蛋白(yes associated protein)激活,可能在肝再生中起重要作用。 Otsuka 等[26]在大鼠ALPPS 模型中发现ALPPS 加速肝再生与非受体型酪氨酸激酶2(Janus kinase 2,JAK2)/STAT3 通路的激活有密切关系,而胰岛再生源蛋白(regenerating islet-derived protein,Reg)Reg3ɑ 和Reg3β 的表达可能在JAK2/STAT3 通路的活化中扮演着重要角色,作者还认为炎性细胞因子的升高并不是ALPPS 促进FLR 快速增生的主要原因;Colak 等[40]分别在肝切除、ALPPS 和PVL 术后24 h 和96 h 两个时间点通过转录组学的方法对肝基因表达及再生信号通路的激活进行了检测,发现肝损伤后基因表达的改变是时间依赖性的,大量的细胞周期相关基因、转录因子、DNA 复制调控基因、细胞和生长因子参与了这一过程。
3.4 肿瘤学相关研究
为了探究ALPPS 是否对肿瘤的生长和转移有促进作用,Kikuchi 等[41]分别对小鼠转移性肝癌模型行ALPPS 和PVL 术后的肿瘤增殖活性和相关细胞因子的水平进行了检测,发现预留肝在术后任何时相点都没观察到肿瘤生长加速的迹象,而门脉结扎侧肝在术后晚期(≥9 d)可以观察到肿瘤进展,并且循环中的细胞因子对肿瘤生长的没有明确影响。Kambakamba 等[36]通过体外实验和临床观察均发现ALPPS 没有直接的促肿瘤生长作用。 然而也存在争议。 García-Pérez 等[42]在大鼠ALPPS 模型中发现ALPPS 可以促进肿瘤在门静脉结扎侧肝叶中的进展和转移,肝血管生成因子VEGF 和缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)的表达急剧上升,同时伴有枯否细胞和肿瘤相关巨噬细胞(tumor associated macrophage,TAM)的显著增加以及肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)的下降。 因此,ALPPS 是否促进肿瘤生长和转移,还需要进一步探究。
4 总结
ALPPS 是近十年来肝外科临床最重要的突破之一,其不仅提供了一种新的扩大肝切除方式,更重要的是为进一步研究肝再生机制打开了一扇希望之门。 总结既往研究成果,血流动力学改变(门静脉结扎)和生长因子的释放是促进余肝快速增生不可缺少的两大要素,而在对生长因子的探索中,已经发现缺氧相关信号分子、JAK-Ihh 轴和JAK2/STAT3 等信号通路参与其中。 我们相信,随着ALPPS 动物模型的发展和成熟,有关ALPPS 促进肝再生机制及其病理生理特性的研究可望取得更大的突破。
