大豆皂苷Bb 预处理对脑缺血再灌模型大鼠的神经保护作用
2022-08-16倩王建宇孟伟建李静崔永健魏
高 倩王建宇孟伟建李 静崔永健魏 琰
(衡水市人民医院(哈励逊国际和平医院)神经内二科,河北 衡水 053000)
缺血性脑卒中(ischemic stroke,IS)是一种因脑血管病变引起的脑供血不足而导致的具有严重并发症和高死亡率的亚急性或急性脑血管类疾病,目前其已经成为全球性首位残疾和第三致死的疾病[1-2]。 持续的脑缺血会造成脑神经的持续伤害,造成不良预后甚至死亡,因此,及早的恢复脑血灌流是治疗IS 的主要治疗策略[3]。 而再灌注也会加重最初由缺血引起的脑损伤,其还能引起缺血区神经元继发性损伤,这种由再灌注引起的脑神经二次伤害严重影响患者的病后神经功能恢复[4-5]。 目前没有特异性抑制脑缺血/再灌注( ischemia/reperfusion,I/R)损伤的方法。 如何改善脑I/R 所致的神经损伤已成为目前急需解决的问题。
脑I/R 损伤可导致神经元凋亡、氧化应激和炎症级联反应等一系列复杂的病理变化[6-7]。 大豆皂苷是一类主要从大豆中提取的三萜类齐墩果烷型皂苷,目前已确认了18 种大豆皂苷,根据化学结构分成A 类、B 类、E 类和DDMP 类[8-9]。 其中,大豆皂苷Bb(soyasaponin Bb,SSBb)是大豆皂苷中主要的活性化合物之一,已发现其在不同的疾病模型中具有抗氧化、抗凋亡、抗炎、神经保护和防治心血管等多种药理作用[10-11]。 根据SSBb 的药理作用,推测其可能也会在脑I/R 中发挥神经保护作用,而具体作用并不清楚。 本研究以大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)大鼠模型观察SSBb(灌胃给药)预处理对MCAO 大鼠脑I/R 所致的脑损伤是否具有神经保护作用。
1 材料和方法
1.1 实验动物
60 只SD 大鼠(6 周龄,SPF 级,雄性,体重:220~240 g)由北京维通利华实验动物技术有限公司[SCXK(京)2021-0011]提供,将大鼠饲养在河北医科大学新药安全评价研究中心维持12 h/12 h 循环光照、湿度(60±5)%和温度(22±3)℃的屏障环境动物房[SYXK(冀)2018-0005],大鼠可自由获取食物和水。 本实验使用动物的程序经衡水市人民医院伦理委员会审查批准(2020-107),并符合实验动物护理和使用指南的3R 原则。
1.2 主要试剂与仪器
大豆皂苷Bb(SSBb,纯度:99%;#51330-27-9),购自上海一基实业有限公司,使用时用生理盐水配置成混悬液;2,3,5-三苯基氯化四氮唑(2,3,5-triphenytetrazolium chloride,TTC)染色液(#G3005)购自北京索莱宝生物科技有限公司;兔源微管相关蛋白-2(microtubule-associated protein-2,MAP-2)抗体(#AF4081)购自美国Affinity Biosciences 公司;小鼠源肿瘤坏死因子-α(TNF-α)抗体(#sc-12744)购自美国Santa Cruz Biotechnology 公司;Cy3 标记的羊抗兔IgG(#BS10007)和FITC 标记的羊抗小鼠IgG(#BS50950)购自南京巴傲得生物科技有限公司;HRP 标记的羊抗兔IgG(#CLGRHRP)购自北京达科为生物技术有限公司; 兔源 β-actin 抗体(#WL01372)、RIPA 裂解液(#WLA017)和高敏ECL 化学发光试剂盒(#WLA003)购自万类生物科技有限公司;兔源突触后致密蛋白-95(postsynaptic density-95,PSD-95)(#ab18258)、兔源突触素I(synapsin I)(#ab64581)和兔源突触结合蛋白(synaptotagmin)(#ab131548)购自英国Abcam 公司;OCT 冰冻切片包埋剂(#4583)购自美国Tissue-Tek 公司。 真空干燥箱(型号:LVO-0B6020;上海龙跃仪器设备有限公司);电子天平(型号:BA2204;澳大利亚KEWLAB公司);激光共焦荧光显微镜(型号:LSM 980 with Airyscan;德国Carl Zeiss 公司);数码显微成像系统(型号:Moticam Pro 285C)(麦克奥迪实业集团有限公司);酶标仪(型号:EnVision;美国PerkinElmer 公司);蛋白质免疫转印系统(型号:Tanon V8 ;上海天能科技有限公司)。
1.3 实验方法
1.3.1 实验方案设计
大鼠经1 周的适应性喂养后,将其随机分为假手术组,MCAO 组和低、高剂量SSBb 预处理组,每组15 只大鼠。 参照Zhang 等[12]方法,用线拴法对MCAO 组和低、高剂量SSBb 预处理组的大鼠行左侧MCAO 术处理。 具体操作方式:大鼠麻醉后,仰卧位固定,颈部正中切口,结扎颈外动脉和颈总动脉近心端;用微血管夹夹闭颈总动脉远心端,将线栓沿颈总动脉、颈内动脉,送入大脑中动脉约2 cm 处;并于缺血后2 h 抽出线栓,实现再灌注。 假手术组大鼠除不进行线拴结扎外,其余步骤程序同MCAO术。 为研究SSBb 预处理对脑I/R 的影响,低、高剂量SSBb 预处理组的大鼠在行MCAO 术前1 h,分别用灌胃针胃内注射20 和50 mg/kg SSBb(SSBb 的剂量参考大鼠实验的报道[11]);假手术组和MCAO 组的大鼠行MCAO 术前1 h 给予等体积生理盐水。
1.3.2 神经功能评估
在再灌注24 h 后,由1 名对分组不知情的实验人员按照Zhang 等[12]的改良神经功能缺损评分量表(modified neurological severity score,mNSS)评估大鼠的神经功能缺陷。 NSS 评分在0~18 分之间,0分表示无神经功能缺陷,评分较高表示神经功能缺陷越严重,18 分表示持续性昏迷或死亡。
1.3.3 脑含水量检测
用脑含水量法评估脑水肿[13]。 在神经功能缺损评分结束后,每组任选5 只大鼠,麻醉后,用颈椎脱位法处死。 然后迅速摘除大脑并称重以获得湿重。 在烘箱中60℃干燥24 h 后,直到重量不变,再次称重以获得干重。 脑含水量=(湿重-干重)/湿重×100%。
1.3.4 TTC 染色
每组任选5 只大鼠,麻醉后,用颈椎脱位法处死。 取全脑并快速在-20℃下保存30 min。 用大鼠脑切片器切出连续11 个2 mm 厚的冠状切片,然后侵入2% TTC 染液中在37℃下避光染色15 min。 取出切片,用PBS 清洗3 次,滤纸吸掉液体进行拍照。苍白的未染色区表示梗死区域,红色染色区表示正常组织。 用Image Pro Plus 测量每个切片的梗死面积;每切片梗死体积=各切片梗死面积×层厚(2 mm);总梗死体积为各切片的梗死体积之和。
1.3.5 免疫荧光
剩余大鼠经麻醉处死后,迅速切下大脑,在多聚甲醛中固定24 h,然后转移到30%蔗糖溶液在4℃条件下放置48 h,然后嵌入OCT 冰冻切片包埋剂。 然后用冰冻切片机将大脑组织切割成6 μm 厚度的切片。 用PBS 冲洗3 次,在室温下用5%山羊血清封闭30 min,在4℃下分别用兔抗MAP-2(1 ∶2000)和小鼠抗TNF-α(1 ∶500)在加湿室孵育过夜,用PBS 冲洗3 次,在室温下分别用1 ∶1000 稀释的Cy3 标记的羊抗兔IgG 和FITC 标记的羊抗小鼠IgG 的荧光二抗避光孵育2 h,用PBS 冲洗3 次,用DAPI 染细胞核5 min。 在激光共焦荧光显微镜下观察,并随机采集梗死和非梗死区域交界处的图像并进行定量研究。 用Image Pro Plus 测量荧光强度,阳性表达水平= 积分光密度值(IOD)/视野面积×100%。
1.3.6 苏木素-伊红染色
将脑组织用石蜡包埋,并用石蜡切片机切为6 μm 厚度的切片。 脑切片经脱蜡至水后,按常规程序分别用苏木素和伊红染色液进行染色。 脱水封片后,显微镜下观察脑组织形态表现。
1.3.7 蛋白质免疫印迹
收集缺血半暗带脑组织,用RIPA 裂解法提取蛋白,用BCA 法量化每样本蛋白浓度。 将80 μg 蛋白的样本行SDS/PAGE 电泳分离并转移到PVDF膜上。 然后,在室温下用5%脱脂牛奶封闭膜1 h,并在4℃下与适当稀释比例的初级抗体孵育过夜。抗体稀释浓度为:PSD95(1 ∶3000)、synaptotagmin(1 ∶2000)、synapsin I(1 ∶1000)和β-actin(1 ∶10000)。 TBST 洗膜3 次,室温下与1 ∶1000 稀释的HRP 标记的羊抗兔IgG 孵育2 h。 用TBST 洗膜3次,使用ECL 增强化学发光系统观察蛋白带,并用Image Pro Plus 进行定量光密度值IOD。 阳性表达水平=目的蛋白(IOD)/β-actin(IOD)×100%。
1.4 统计学方法
用SPSS 19.0 分析软件对所有数据进行统计学分析。 所有数据表示为平均数±标准差(±s)。 多组数据比较采用单因素方差分析法,组间均数两两比较采用事后LSD-t检验,P<0.05 表示具有统计学意义。
2 结果
2.1 大豆皂苷Bb 预处理降低脑I/R 所致的神经功能障碍和脑水肿
通过mNSS 评分表和脑含水量来分别评估大豆皂苷Bb 预处理对脑I/R 诱导的神经功能障碍和脑水肿的影响。 如图1A 所示,与假手术组相比,MCAO 组NSS 评分显著升高(P<0.001),提示神经功能障碍;而低、高剂量大豆皂苷Bb 预处理均显著降低MCAO 大鼠的NSS 评分(P< 0.01 和P<0.001),提示大豆皂苷Bb 预处理降低MCAO 大鼠神经功能障碍,其中高剂量效果更为显著(P<0.001)。 脑含水量检测结果(图1B)显示,MCAO组脑含水量显著高于假手术组(P<0.001),而低、高剂量大豆皂苷Bb 预处理的MCAO 大鼠脑含水量均较MCAO 组显著降低(P<0.01 和P<0.001),提示大豆皂苷Bb 预处理降低MCAO 大鼠的脑水肿,其中高剂量效果更为显著(P<0.001)。
2.2 大豆皂苷Bb 预处理减轻脑I/R 后的脑梗死
用TTC 染色和MAP-2 免疫荧光染色评估大豆皂苷Bb 预处理对脑I/R 诱导脑梗死的影响。 TTC染色(图2A、2C)结果显示,与假手术组相比,MCAO组梗死体积显著增加(P<0.001);与MCAO 组相比,低、高剂量大豆皂苷Bb 预处理组梗死体积均显著降低(P<0.01 和P<0.001),且高剂量组效果更显著(P<0.001)。 MAP-2 免疫荧光染色(图2B、2D)结果显示,与假手术组相比,MCAO 组MAP-2 荧光强度显著降低(P<0.001);与MCAO 组相比,低、高剂量大豆皂苷Bb 预处理组MAP-2 荧光强度均显著增加(P<0.01 和P<0.001),且高剂量组效果更显著(P<0.001)。 这些结果提示,大豆皂苷Bb 预处理可改减轻脑I/R 后的脑梗死。
2.3 大豆皂苷Bb 预处理抑制脑I/R 诱导的炎症反应
为明确大豆皂苷Bb 预处理对脑I/R 诱导的炎症的影响,采用HE 染色法观察脑I/R 后24 h 脑组织形态,免疫荧光法检测脑组织中TNF-α 的表达水平,并用MAP-2 显示缺血半暗带。 HE 染色结果(图3A)表明,假手术组脑组织形态和细胞结构基本正常;MCAO 组脑组织显示水肿和炎性细胞浸润现象,组织中的部分细胞可见细胞核碎片、核固缩和凋亡小体;低、高剂量大豆皂苷Bb 预处理组显示脑组织水肿和炎性细胞浸润现象减轻,组织中细胞形态也趋向正常。 免疫荧光染色结果(图3B~3D)表明,与假手术组比较,MCAO 组TNF-α 荧光强度显著增高(P<0.001);与MCAO 组比较,低、高剂量大豆皂苷Bb 预处理组TNF-α 荧光强度均显著降低(P<0.01和P<0.001),且高剂量组效果更显著(P<0.001)。这些结果表明大豆皂苷Bb 可以减轻脑I/R 导致的炎症反应。
2.4 大豆皂苷Bb 预处理抑制脑I/R 诱导的突触相关蛋白的表达
Western blot 结果(图4)显示,与假手术组相比,MCAO 组PSD95、synaptotagmin 和synapsin I 的表达水平均显著降低(P<0.001);与MCAO 组相比,低、高剂量大豆皂苷Bb 预处理组上述蛋白表达水平均显著增加(P<0.01 和P<0.001),且高剂量组效果更显著(P<0.001),这表明大豆皂苷Bb 抑制脑I/R 诱导的神经细胞的轴突损伤。
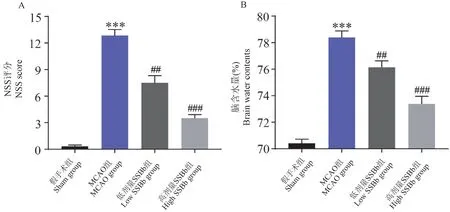
注:A:各组大鼠的NSS 评分;B:各组大鼠的脑含水量。 与假手术组相比,∗∗∗P<0.001;与MCAO 组相比, ##P<0.01, ###P<0.001。图1 大豆皂苷Bb 预处理可以降低脑I/R 所致的神经功能障碍和脑水肿(n=5)Note.A, NSS scores of rats in various groups.B, Brain water contents of rats in various groups.Compared with sham group,∗∗∗P<0.001.Compared with MCAO group, ##P<0.01, ###P<0.001.Figure 1 SSBb pretreatment reduces neurological dysfunction and brain edema caused by brain I/R
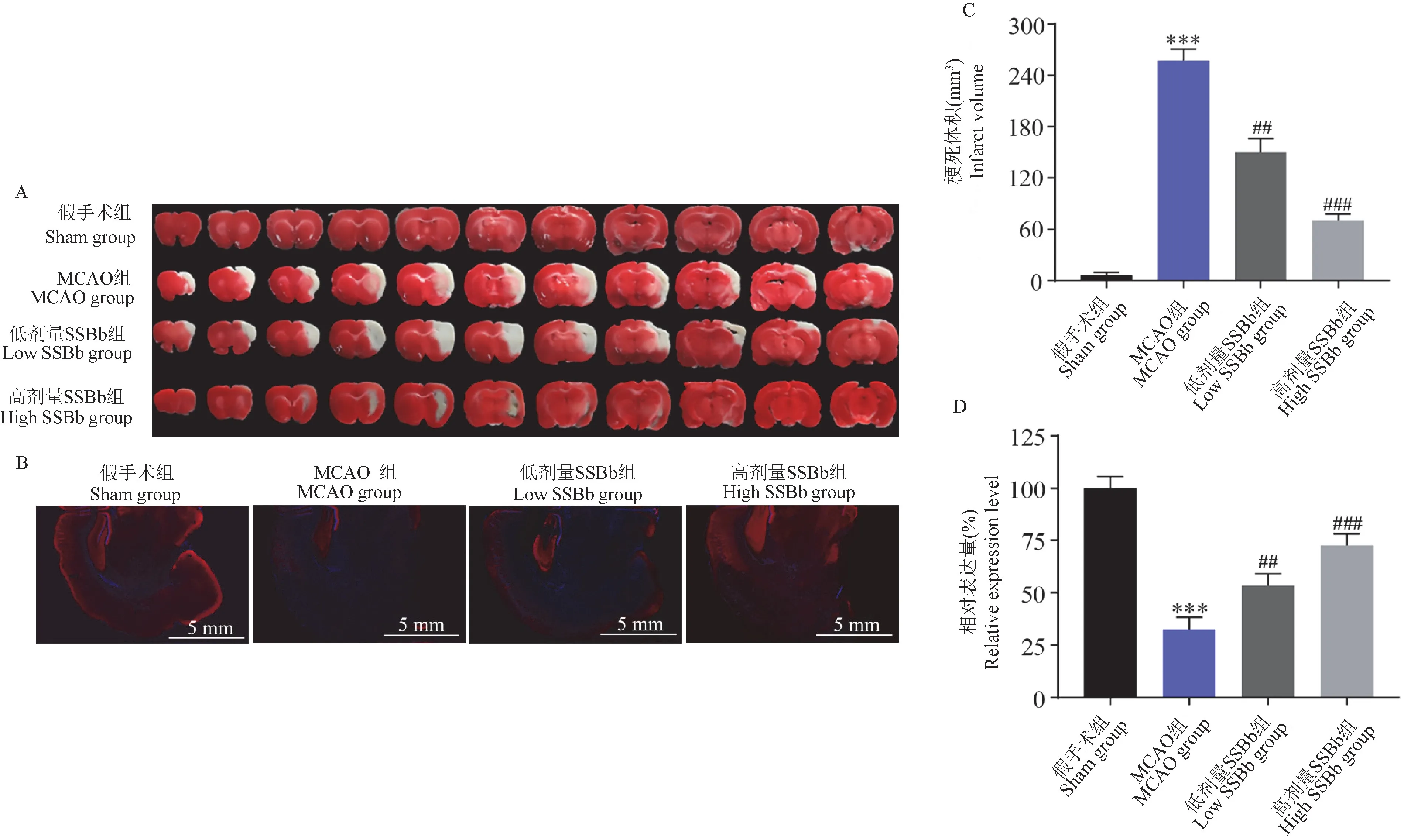
注:A:代表性的TTC 染色图像;B:代表性MAP-2 染色切片的荧光显微图像显示的脑梗死区域(MAP-2 为亮红色点,细胞核为亮蓝色点);C:各组梗死体积;D:各组MAP-2 的相对荧光强度。 与假手术组相比,∗∗∗P<0.001;与MCAO 组相比, ##P<0.01, ###P<0.001。图2 大豆皂苷Bb 预处理减轻大鼠脑I/R 后的脑梗死(n=5)Note.A, Representative images of TTC staining.B, Representative fluorescence microscopy images of MAP-2 stained sections showing the infarction areas in the brain (MAP-2 appears as bright red dots, while the nucleus is represented as bright blue spots).C, Infarct volume in various groups.D, Relative fluorescence intensity of MAP-2 in various groups.Compared with sham group,∗∗∗P<0.001.Compared with MCAO group, ##P<0.01, ###P<0.001.Figure 2 SSBb pretreatment alleviates cerebral infarction after cerebral I/R in rats

注:A:各组脑组织代表性HE 染色图像;B:缺血半暗带中MAP-2 和TNF-α 免疫荧光定位图像;C、D:半暗带中MAP-2 和TNF-α 的相对荧光强度。 与假手术组相比,∗∗∗P<0.001;与MCAO 组相比, ##P<0.01, ###P<0.001。图3 大豆皂苷Bb 预处理抑制脑I/R 诱导的炎症反应(n=5)Note.A, Representative HE staining images of brain tissues in each group.B, Immunofluorescence localization of MAP-2 and TNF-α in ischemic penumbra area.C, D, Relative fluorescence intensity of MAP-2 and TNF-α in the penumbra region.Compared with sham group,∗∗∗P<0.001.Compared with MCAO group, ##P<0.01, ###P<0.001.Figure 3 SSBb pretreatment inhibits inflammatory response induced by cerebral I/R
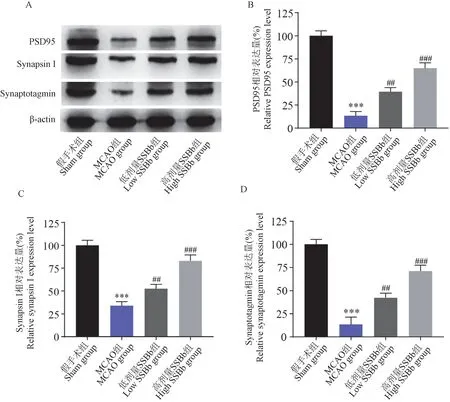
注:A:各组代表性PSD95、synapsin I 和synaptotagmin 的Western blot;B~D:各组PSD95、synapsin I 和synaptotagmin 的蛋白表达的定量分析。 与假手术组相比,∗∗∗P<0.001;与MCAO 组相比, ##P<0.01, ###P<0.001。图4 大豆皂苷Bb 预处理对脑I/R 后突触相关蛋白表达的影响(n=5)Note.A, Representative Western blot electrophoregrams of PSD95, synapsin I and synaptotagmin in each group.B~D, Quantification analysis of the expression levels of PSD95, synapsin I and synaptotagmin proteins in various groups.Compared with sham group,∗∗∗P<0.001.Compared with MCAO group, ##P<0.01, ###P<0.001.Figure 4 Effect of SSBb pretreatment on the expression of synaptic-associated proteins after cerebral I/R
3 讨论
脑卒中是导致死亡和神经功能障碍的主要原因[1-2],而IS 在所有类型的脑卒中病例中约占80%~85%[14]。 先前的研究已经证实,脑I/R 会导致脑血管损伤和血脑屏障的破坏,以及神经元损伤的级联效应[6-7,15]。 目前还没有阻断脑I/R 的有效策略,因此,关于如何减少脑I/R 损伤的不良影响,仍需要做大量的工作。 本研究显示SSBb 预处理能减轻脑I/R 后神经功能损伤、脑水肿和脑梗死,提示其可能是潜在的用于IS 的神经保护剂。
脑I/R 损伤会加重脑缺血引发促炎介质的释放、细胞死亡、轴突损伤和再生抑制[4-5]。 抗炎、抗凋亡和维持损伤神经元的存活是神经系统保护和再生的重要过程。 各种促炎细胞因子的释放引起的炎症级联反应是脑I/R 炎症损伤的主要机制[16]。TNF-α 是一种强促炎细胞因子,在缺血性脑损伤中发挥多效性功能[17]。 在先前不同疾病类型的研究中显示SSBb 具有抑制炎症作用[10-11]。 在本研究中,也证明了SSBb 预处理能减少缺血半暗带中TNF-α 的表达,提示其在脑I/R 模型大鼠中也具有抗炎作用。
突触是中枢神经系统神经元之间的接触位点,有助于信息的处理、传递和存储。 树突棘是一种分散在许多类型神经元的树突上的微小突起,是兴奋性突触的主要靶点[18]。 大脑中血流减少90%,10~20 min 内就会导致树突棘丢失和不可逆的树突损伤[19]。 在急性MCAO 模型中,缺血性卒中不仅会导致梗死缺血区的神经元死亡,还会损害缺血半暗带区域的神经元结构[20]。 中枢神经元的棘和树突是突触信号传导的重要位点,其也是缺血后最易损伤的结构,其结构破坏会中断神经元回路和损害大脑突触发生的功能。 为增加突触发生,神经元会增加树突分枝的形态学改变,使大脑能够重组神经元回路,增加与突触调节相关的神经递质释放。synaptotagmin 是突触囊泡的对接和与神经元膜的融合的关键蛋白[21]。 Synapsin I 是一种促进突触囊泡形成、突触发生和调节神经递质释放的蛋白[22]。PSD-95 是树突棘突触后密度中的一种主要支架蛋白[23]。 本研究结果表明,SSBb 预处理可以明显增加脑I/R 损伤后synaptotagmin、synapsin I 和PSD-95的表达,表明SSBb 预处理在突触发生中的潜在作用。
本研究结果表明,SSBb 预处理能够减轻大鼠脑I/R 损伤引起的神经功能缺陷、脑水肿及脑梗死,并且能够促进突触相关蛋白的表达,具有神经保护作用。
