鸡肠炎沙门氏菌噬菌体的分离与生物学特性研究
2022-08-16曹祁峰周铁忠
高 瑶,曹祁峰,周铁忠,李 冰*
(1.锦州医科大学畜牧兽医学院,辽宁 锦州 121001;2.辽宁益康生物股份公司,辽宁 辽阳 111000)
沙门氏菌(Salmonella)是一种常见的人畜共患病病原菌,尤其是肠炎沙门氏菌(Salmonellaenteritidis)对蛋类、肉类、奶类等食品污染率极高[1]。我国由细菌引起的食源性疾病中,沙门氏菌疾病占70%以上[2]。抗生素药品广泛应用导致出现多重耐药菌,使抗生素的治疗效果逐渐降低。因此,如何应对多重耐药菌感染成为新的研究重点。
噬菌体是一种以细菌作为宿主的病毒,通过吸附并感染细菌,在其内部增殖并通过释放酶类物质裂解细菌。噬菌体只针对特定的病原菌,并且在特定部位进行裂解作用,对其他种、型不发挥作用[3],噬菌体随着致病菌的死亡而减少直至消失。因此,特异性的噬菌体一般不会影响正常菌群。此外,细菌耐药性无法影响噬菌体;根据相关数据分析,抗菌药物使细菌产生耐药性的突变频率为10-5,而噬菌体使细菌产生抗性的突变频率为10-7。虽然细菌也会对噬菌体产生抗性,但噬菌体可以随着细菌的生长而进化,以此抵抗细菌产生的抗性[4-5]。据统计,全球目前约有28家生产噬菌体相关产品的公司,除李斯特菌噬菌体产品外,沙门氏菌噬菌体产品数量占据第一[6]。噬菌体疗法作为一种新兴的治疗方式,具有杀菌效果强、利用率高、特异性高、杀灭细菌的阈值低等优点,临床应用更具优势[7]。本试验从锦州某鸡场粪便中分离到的1株鸡肠炎沙门氏菌噬菌体,并对其进行生物学特性研究,为噬菌体制剂防治鸡肠炎沙门氏菌感染的研究与应用提供参考。
1 材料与方法
1.1 试验材料
试验所采用鸡肠炎沙门氏菌锦州医科大学畜产品质量与安全重点实验室保存和提供。粪便样品采集于锦州市某规模化蛋鸡场。
1.2 试剂与仪器
主要试剂:LB培养基(液体)、营养肉汤(NB)、LB培养基(固体)、伊红美蓝培养基、双层琼脂培养基(上层为液体LB培养基加0.7%的琼脂粉,下层为固体LB培养基)按常规说明方法配制。微孔滤膜(0.22μm)、无菌PBS缓冲液、病毒基因组DNA/RNA快速提取试剂盒,均购自索莱宝生物技术(北京)有限公司;Taq 2×Mix购自生工生物工程技术服务(上海)有限公司。
主要仪器:电热恒温培养箱(上海精宏实验设备有限公司)、高速离心机(Sigma公司)、恒温震荡培养箱(上海捷呈实验仪器有限公司)、琼脂糖电泳仪(南京昕仪生物科技有限公司)、凝胶成像分析系统(上海速科实业有限公司)。
1.3 试验方法
1.3.1 菌悬液的制备
取-80℃保存的鸡沙门氏菌,加入等体积生理盐水稀释,接种于LB培养基,37℃培养6 h。接种于伊红美蓝培养基,37℃培养18 h。取单个菌落重新接种于LB培养基,37℃,200 r/min振荡培养6 h,制成菌悬液。
1.3.2 裂解液的制备
取粪便样品30 g,加入100 mL生理盐水与氯仿的混合液,充分搅拌混匀,纱布将样品粗滤后,自然沉降4 h,12 000 r/min离心10 min,取上清液经微孔滤膜(0.22μm)过滤,重复离心处理3次获得初滤液。
取5 mL初滤液加入10 mL LB培养液中充分混匀,加入100μL宿主菌,37℃的恒温环境下振荡培养14 h,采集增殖后的培养液,12 000 r/min离心5 min,取上清液经微孔滤膜(0.22μm)过滤,获得裂解液,做无菌检测[8]。
1.3.3 确证试验
通过斑点法对裂解液进行确证试验。取150μL菌悬液均匀涂布于LB琼脂平板上,滴加20μL裂解液于平板上。观察是否有无色透明的噬菌斑生成,若有则证明裂解液中含有沙门氏菌噬菌体。
1.3.4 噬菌体的纯化
对噬菌体进行纯化主要方式为双层平板法。加入无菌PBS缓冲液对噬菌体裂解液进行10倍稀释,取100μL稀释后的裂解液与100μL菌悬液混合均匀,加入50℃恒温的7 mL LB半固体琼脂培养基中再次混合均匀,快速倒入预先制备好的LB固体琼脂平板上,无菌环境下静置20 min等待凝固,37℃恒温培养18 h,观察噬菌斑情况。
选取直径较大、清澈透亮的噬菌斑,碾碎后置于含有1 mL无菌PBS缓冲液的无菌EP管中,4℃恒温静置2 h,进行离心过滤处理,适当稀释后重复上述操作。采用双层平板法纯化噬菌体,直至噬菌斑形状和大小一致,即得纯化的噬菌体。
1.3.5 噬菌体效价的测定
取纯化后的噬菌体溶液100μL,加入900μL无菌PBS缓冲溶液,分别稀释至10-1~10-10,采用双层平板法测定噬菌体的滴度,试验重复3次,取平均值。

1.3.6 PCR鉴定与产物测序
参照GenBank中公布的肠炎沙门氏菌噬菌体epsilon15(NC_004775)的衣壳蛋白设计特异性引物[9]:上游引物5'-CAAACCCAGACCGTACCAGT-3',下游引物5'-AACGATCTTCTTGCCGCCGTA-3'。
根据病毒基因组DNA/RNA提取试剂盒说明书提取噬菌体基因组,按常规说明方法进行反转录,通过PCR方法对基因序列进行扩增,退火温度条件为57℃,获得大小为784 bp的产物片段。
根据胶回收试剂盒操作说明方法进行将目的条带进行回收,将目的基因与pMD18-T载体相连,连接产物转化DH5α感受态细胞。挑取单个菌落,接种于含青氨苄霉素(100 mg/L)的LB液体培养基中,37℃恒温振荡培养过夜。利用质粒小提试剂盒对质粒进行提取,经过PCR检验,阳性重组质粒送生工生物工程股份公司测序,每个阳性质粒测序3次以确保基因序列的准确性[10]。
1.3.7 基因序列遗传进化分析
本研究选择GenBank数据库中的29株沙门氏菌噬菌体作为参考噬菌体,为进行序列比对及核苷酸序列同源性分析,采用了DNAStar7.1软件中MegAlign程序的ClustalW方法,利用MEGA7.0软件中Neighbor-Joining方法生成了目的基因序列的系统发育进化树[11]。
1.3.8 热稳定性的测定
取100μL噬菌体纯培养液转移至无菌EP管,分别置于不同温度下(30、40、50、60、70、80℃)水浴,作用30、60 min。结束后立即取出EP管,置于冰浴中冷却,通过双层平板法对噬菌体效价进行测定,进行3次重复试验[12]。
1.3.9 pH值敏感性的测定
取100μL噬菌体纯培养液分别接种于pH值为2、3、4、5、6、7、8、9、10、11、12、13、14的LB培养基中,37℃恒温培养12 h,通过双层平板法对噬菌体效价进行测定,进行3次重复试验[13]。
2 结果与分析
2.1 噬菌体的分离与纯化与效价测定
从锦州地区某鸡场粪便样品中分离纯化得到1株沙门氏菌噬菌体,并命名为SP-1。
采用双层平板法纯化该噬菌体,噬菌斑呈透亮的空斑,大而清晰,直径为4~7 mm,见图1。根据公式计算,噬菌体SP-1效价为8.25×108PFU/mL。
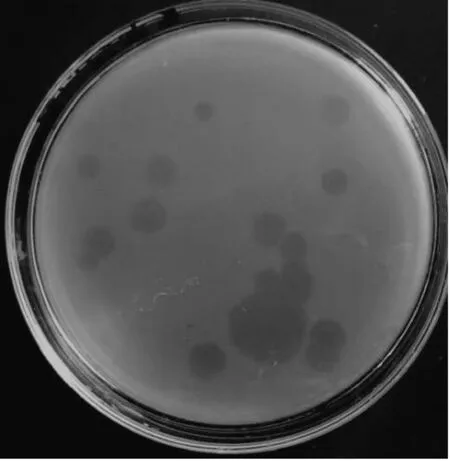
图1 噬菌体SP-1的噬菌斑Fig.1 Plaquesof bacteriophage SP-1
2.2 RT-PCR扩增与测序(见图2、图3)
由图2可知,应用本试验设计的特异性引物对噬菌体基因组进行PCR扩增,PCR扩增产物大小约784 bp,与预期片段大小一致。

图2 噬菌体SP-1扩增结果Fig.2 Result of bacteriophage SP-1 amplification
PCR扩增产物测序,获得784 bp,5'端与3'端均有完整的引物序列(条框部分),见图3。

图3 PCR产物测序结果Fig.3 PCRproduct sequencing result
2.3 基因序列遗传进化分析(见图4、图5)

图4 目的基因遗传进化树Fig.4 Genetic evolution treeof target genes

图5 同源性对比分析Fig.5 Comparativeanalysis of homology
由图4可知,噬菌体SP-1与参考的肠炎沙门噬菌体为同一分支。
由图5可知,噬菌体SP-1与肠炎沙门氏菌噬菌体同源性均在89.5%~99.5%之间。综上所述,可判定噬菌体SP-1属于肠炎沙门氏菌噬菌体。
2.4 噬菌体SP-1热稳定性与pH值敏感性的测定(见图6、图7)
由图6可知,噬菌体效价在各温度下分别作用30和60 min时差异水平不显著(P>0.05),作用30 min效价略高。在30~50℃的温度下,效价下降趋势缓慢;60℃时下降迅速;70℃之后效价下降至0。
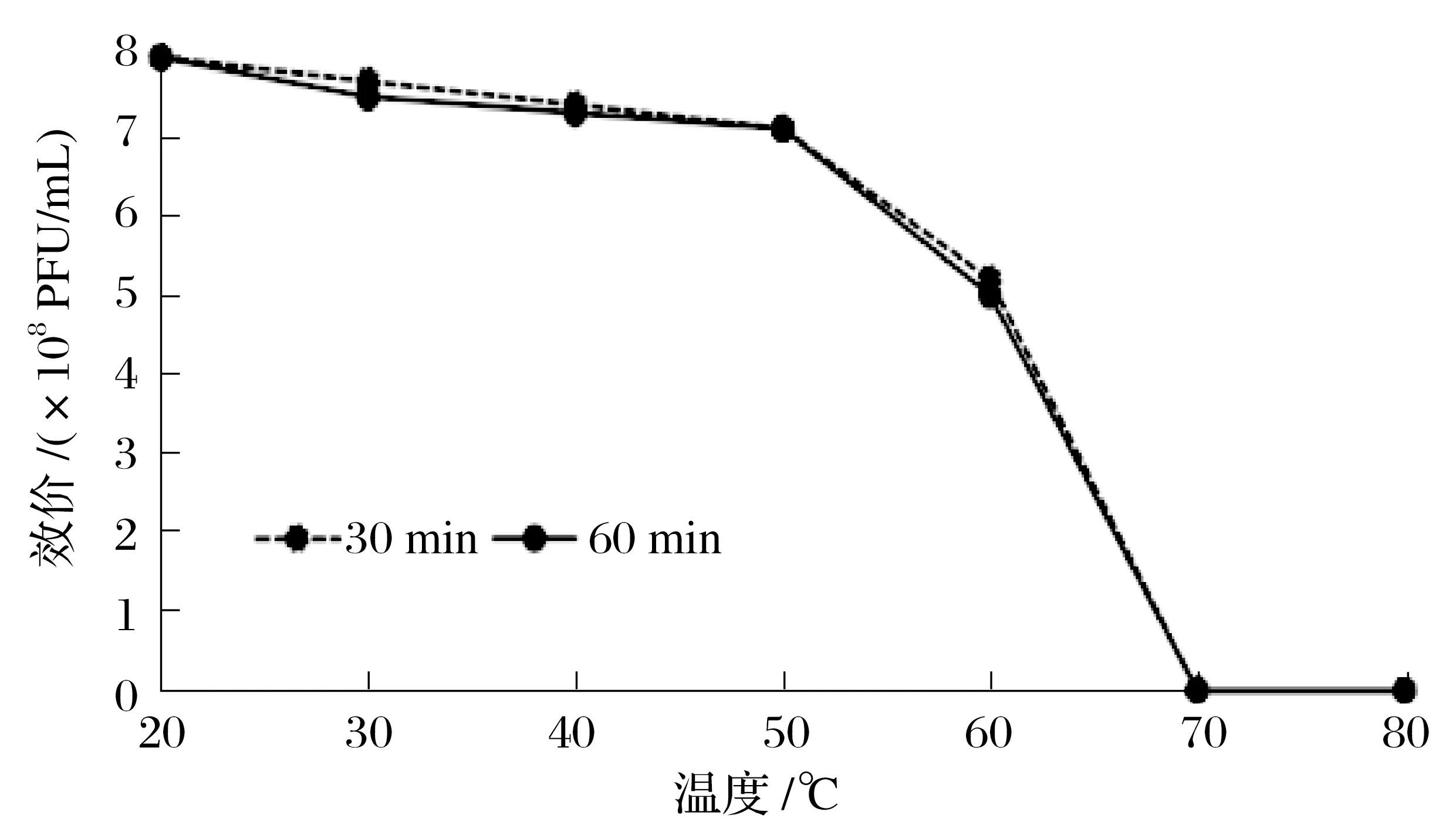
图6 噬菌体SP-1对温度的耐受力Fig.6 Temperaturetolerance of phage SP-1
由图7可知,噬菌体效价在pH值5~11之间较为稳定。当pH值低于5或大于11时效价水平明显降低;当pH值低于2或高于13时效价为0,表明噬菌体无法存活。

图7 噬菌体SP-1对pH值的耐受力Fig.7 pH valuetoleranceof phage SP-1
3 讨论
噬菌体于1915年首次被发现并应用于细菌疾病的治疗,然而随着抗生素的发现与应用,噬菌体的研究停滞不前[14]。因抗生素的肆意滥用导致细菌耐药性问题日益凸显,噬菌体制剂成了一个新的研究方向。噬菌体是自然界中种类最多的病毒,各类细菌均能够找到与之对应的裂解性噬菌体。噬菌体具有高度特异性,只感染特定种属的病原菌,在细菌内部快速增殖并使之裂解,不会破坏正常菌群,更不会对周围环境产生影响,故可将噬菌体应用于环境消毒。肠炎沙门氏菌是目前养殖场普遍存在且污染最严重的细菌之一,对肠炎沙门氏菌噬菌体的发现及研究非常重要。
噬菌体的专一性、高度特异性、无耐药性等优点在临床应用上前景广阔[15-16]。江艳华等[17]分离得到1株沙门菌噬菌体,并对其进行生物学特性分析;结果发现,该噬菌体具有较好的温度耐受性并且能够逐渐降低宿主菌数目。噬菌体感染细菌的首要过程是吸附细菌,噬菌体的吸附率受到温度及pH值的影响。在最适温度下,噬菌体吸附率能够达到峰值,温度过高或过低均可导致吸附率下降。pH值的高低直接影响噬菌体吸附器官及其宿主菌表面受体的分子结构和互补性[18]。因此,筛选出最适温度及pH值是噬菌体能否高效灭菌的直接因素。
临床应用上,可考虑将噬菌体作为生物抑菌剂进行沙门氏菌的防控,或采用与其他抗菌制剂联合应用的方式提高抑菌效果,为噬菌体应用于活体动物细菌疾病的治疗以及食源性沙门氏菌疾病的生物防控提供了前提条件[19]。
根据目前形势需要,噬菌体制剂还可应用于治疗细菌疾病以及细菌的检测。噬菌体不受耐药性限制、副作用小、无残留,安全性已得到验证,比抗生素更适合应用于临床治疗。目前利用抗体检测细菌准确性高但速度慢,噬菌体具有严格的特异性,能够快速且高效地选择对应的细菌。裂解菌体通过释放胞内酶类进行安培计测量,从而确定病原菌[20]。噬菌体制剂发展前景可观,虽然目前噬菌体制剂临床应用较少,但噬菌体的潜在优势仍是杀灭细菌最好的方式。随着生物技术不断成熟,噬菌体的研究将逐步完善,克服弊端,扩大优势,噬菌体制剂将会成为一种理想的新型抗菌制剂。
4 结论
本试验从锦州地区某鸡场粪便样品中分离纯化得到1株肠炎沙门氏菌噬菌体SP-1,该噬菌体效价为8.25×108PFU/mL,对肠炎沙门氏菌具有良好的裂解性能。生物学特性测定结果显示,噬菌体SP-1对温度以及pH值具有较宽泛的耐受力,表明其具备作为治疗鸡肠炎沙门氏菌噬菌体制剂候选毒株的潜在应用价值。
