甘草甜素对膝关节骨性关节炎大鼠软骨细胞凋亡及PTEN/AKT/COX-2信号通路的影响*
2022-08-16任天琦刘泽霖胡海刘宏鹏李小冬
任天琦,刘泽霖,胡海,刘宏鹏,李小冬
(黑龙江中医药大学附属第二医院 骨外科,黑龙江 哈尔滨 150001)
膝关节骨性关节炎(knee osteoarthritis,KOA)是一种慢性退行性骨关节病,以膝关节软骨变性、损坏及继发骨质增生为主要病理特征,好发于中老年女性群体,可引起患者关节疼痛、活动受限、功能丧失甚至残疾,给患者的日常生活带来不便和痛苦[1-2]。软骨细胞是关节软骨组织中唯一的细胞成分,其增殖与凋亡在关节软骨组织的维持、塑形、更新中发挥重要作用[3]。大多数研究认为,软骨细胞的过度凋亡是引起关节软骨变性、损坏并导致KOA发生、病情恶化的主要原因,阻止或延缓其凋亡是防治KOA的关键[4]。甘草甜素,又名甘草酸,是药用植物甘草的有效活性成分之一,具有抗炎、抗氧化、抗肿瘤、保肝等多种药理作用[5]。近年来研究发现,甘草甜素可通过调控炎症和氧化应激等途径,对胶原诱导的大鼠类风湿性关节炎起治疗作用,但对KOA的影响及作用机制尚不明确[6]。第10号染色体同源丢失性磷酸酶张力蛋白基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)是具有双磷酸化酶活性的抑癌基因,可抑制下游蛋白激酶B(protein kinase B,AKT)通路活化,进而阻断环氧合酶2(cyclooxygenase 2,COX-2)介导的炎症途径[7-8]。研究表明,COX-2介导的炎症途径在KOA的发展进程中发挥重要作用[9]。因此,本研究将从PTEN/AKT/COX-2信号通路的角度探讨甘草甜素对KOA大鼠软骨细胞凋亡的影响,以期为防治KOA提供新思路。
1 材料与方法
1.1 实验材料
1.1.1实验动物 80只雄性10周龄Sprague-Dawley(SD)大鼠,体质量320 g左右,购自肇庆市瑞思元生物科技有限公司[SCXK(粤)2020-0053]。大鼠在无菌环境中分笼饲养,饮水、进食自由,12 h/12 h明暗光照,温度22~25 ℃,相对湿度50%左右。
1.1.2主要试剂和仪器 双氯芬酸钠缓释片(南京易亨),甘草甜素(美国 Selleck),大鼠血清白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)试剂盒及苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色试剂盒(北京索莱宝),原位末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)试剂盒(上海吉至),一抗PTEN、p-AKT、AKT、COX-2、Bax、cleaved caspase-3、GAPDH及二抗(英国 Abcam),CKX41SF显微镜(日本 Olympus),电子游标卡尺(日本 Mitutoyo)。
1.2 造模和分组
将80只雄性SD大鼠适应性喂养1 周后,随机分为假手术组、KOA组、阳性药物组及低、高剂量甘草甜素组,每组16只。除假手术组外,其余组大鼠根据Hulth法制备大鼠KOA模型[10]:大鼠禁食12 h,在无菌实验室内腹腔注射50 mg/kg戊巴比妥钠麻醉,以仰卧位固定,右膝关节常规备皮、消毒,于膝关节内侧纵行切1 cm,打开关节腔,切除1/3的内侧半月板,切断前交叉韧带及内侧副韧带,止血并逐层缝合切口,术后连续3 d肌肉注射抗生素预防感染;假手术组仅打开关节腔,不进行其他处理,缝合切口,防感染处理。术后2 周开始灌胃给药,阳性药物组大鼠灌胃6.75 mg/kg双氯芬酸钠,低、高剂量甘草甜素组大鼠分别灌胃50、100 mg/kg甘草甜素[11],其余组灌胃等量生理盐水,1次/d,连续给药4 周。
1.3 观察指标
1.3.1膝关节肿胀情况 电子游标卡尺测量各组大鼠术前、术后2 周、给药2 周、给药4 周的膝关节直径,测量3次,取均值。
1.3.2IL-1β、IL-6、TNF-α含量 末次给药24 h后,大鼠腹主动脉取血3 mL于EP管中,3 000 r/min低温离心5 min收集血清,采用大鼠 ELISA试剂盒分别检测IL-1β、IL-6、TNF-α含量,按试剂盒说明书方法操作。
1.3.3软骨组织形态 1.3.2项操作后,每组取8只大鼠断颈处死,剥离右膝关节软骨,生理盐水冲洗,用4%多聚甲醛固定24 h,置于20%脱钙液(EDTA)中4 ℃脱钙4 周,1次/3 d换液,石蜡包埋,切片(4 μm);取部分切片脱蜡脱水后行HE染色,显微镜观察膝关节软骨组织学形态。
1.3.4关节软骨细胞凋亡情况 取1.3.3项下右膝关节软骨组织切片,室温下加蛋白酶K处理30 min,放入0.01 mol/L柠檬酸缓冲液中用微波炉修复抗原,加TUNEL反应混合液处理,用DAB溶液显色,苏木精复染,显微镜下观察膝关节软骨组织细胞凋亡情况。
1.3.5PTEN、p-AKT、AKT、COX-2、Bax、cleaved caspase-3蛋白表达 1.3.2项操作后,每组剩余8只大鼠断颈处死,剥离右膝关节软骨,加RIPA裂解液冰上研磨裂解,12 000 r/min低温离心15 min收集上清,BCA法测定蛋白浓度;配制SDS-PAGE凝胶,取20 μg蛋白与4 μL SDS-PAGE(2×)上样缓冲液混匀,沸水浴变性,上样进行电泳,转膜,室温5%脱脂牛奶封闭,一抗(PTEN、p-AKT、AKT、COX-2、Bax、cleaved caspase-3、GAPDH,均1∶1 000)4 ℃孵育过夜,二抗(HRP标记,1∶1 500)室温孵育30 min,ECL化学发光显色,曝光,拍照,以GAPDH为内参蛋白,进行灰度比分析。
1.3 统计学分析
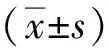
2 结果
2.1 膝关节肿胀情况
KOA造模术后2 周,KOA组、阳性药物组及低、高剂量甘草甜素组大鼠膝关节直径均大于假手术组(P<0.05)。给药2 周、4 周后,阳性药物组及低、高剂量甘草甜素组大鼠膝关节直径均小于KOA组(P<0.05);低剂量甘草甜素组大鼠膝关节直径大于阳性药物组(P<0.05);高剂量甘草甜素组大鼠膝关节直径小于阳性药物组、低剂量甘草甜素组(P<0.05)。见图1。
注:(1)与假手术组相比,P<0.05;(2)与KOA组相比,P<0.05;(3)与阳性药物组相比,P<0.05;(4)与低剂量甘草甜素组相比,P<0.05。
2.2 血清中IL-1β、IL-6、TNF-α水平
KOA组大鼠血清中IL-1β、IL-6、TNF-α水平较假手术组高(P<0.05);阳性药物组及低、高剂量甘草甜素组大鼠血清中IL-1β、IL-6、TNF-α水平均低于KOA组(P<0.05);低剂量甘草甜素组大鼠血清中IL-1β、IL-6、TNF-α含量较阳性药物组高(P<0.05);高剂量甘草甜素组大鼠血清中IL-1β、IL-6、TNF-α水平均低于阳性药物组、低剂量甘草甜素组(P<0.05)。见图2。
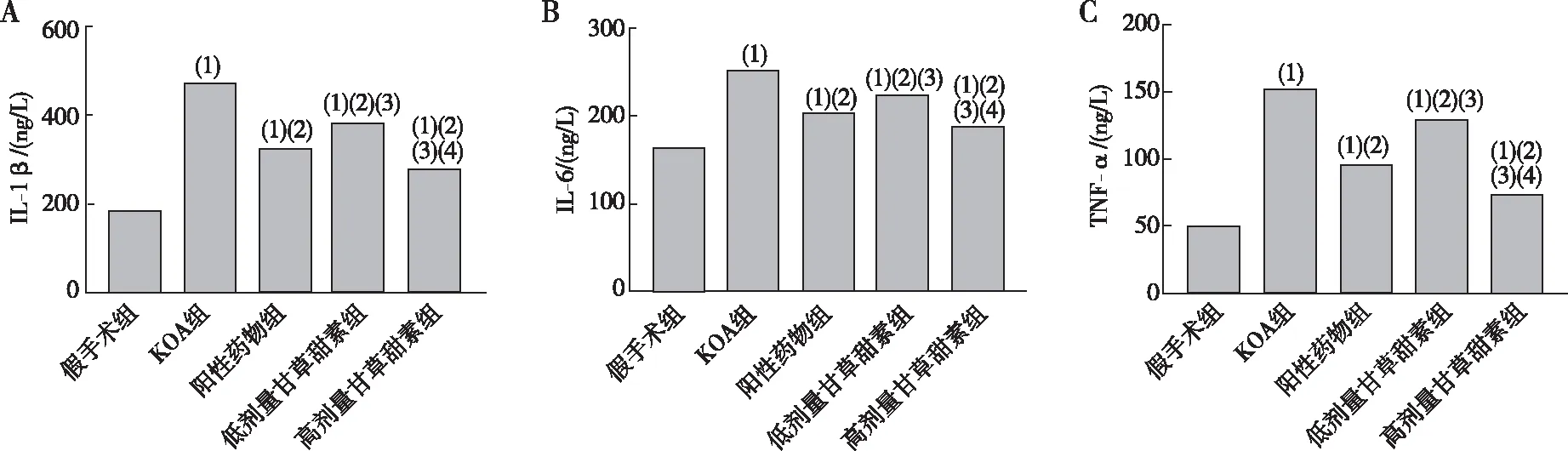
注:A、B、C分别为大鼠血清中IL-1β、IL-6和TNF-α水平;(1)与假手术组相比,P<0.05;(2)与KOA组相比,P<0.05;(3)与阳性药物组相比,P<0.05;(4)与低剂量甘草甜素组相比,P<0.05。
2.3 膝关节软骨组织学形态
假手术组大鼠膝关节软骨组织结构清晰,细胞排列规整;KOA组软骨组织结构层次模糊,细胞数量少、排列散乱,有明显炎性细胞浸润;高剂量甘草甜素组软骨组织结构清晰可见,细胞增多,炎性细胞浸润较少;而阳性药物组、低剂量甘草甜素组细胞数量、形态、排列及炎细胞浸润较高剂量甘草甜素组略差。见图3。
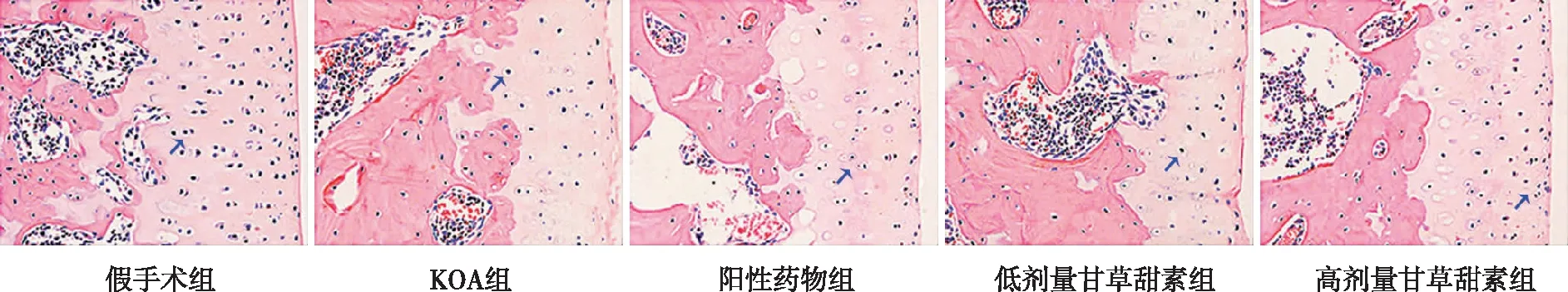
注:蓝色箭头所指为软骨细胞。
2.4 膝关节软骨组织细胞凋亡
KOA组大鼠膝关节软骨组织细胞凋亡率较假手术组升高(P<0.05);阳性药物组及低、高剂量甘草甜素组大鼠膝关节软骨组织细胞凋亡率较KOA组均降低(P<0.05);低剂量甘草甜素组大鼠膝关节软骨组织细胞凋亡率较阳性药物组升高(P<0.05);高剂量甘草甜素组大鼠膝关节软骨组织细胞凋亡率较阳性药物组、低剂量甘草甜素组均降低(P<0.05)。见图4。
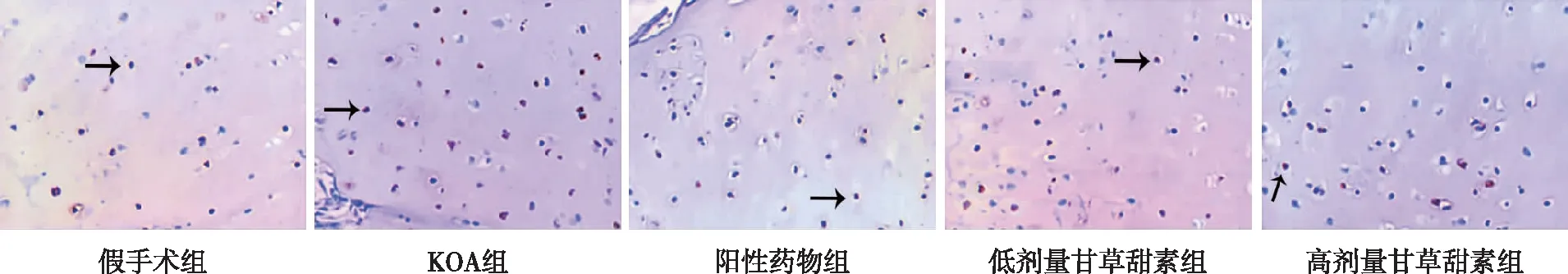
注:黑色箭头所指为凋亡阳性细胞。
2.5 软骨组织中PTEN/AKT/COX-2通路相关蛋白及凋亡相关蛋白表达
KOA组大鼠膝关节软骨组织中PTEN蛋白表达水平较假手术组显著降低(P<0.05),p-AKT/AKT、COX-2、Bax、cleaved caspase-3蛋白表达水平升高(P<0.05);阳性药物组及低、高剂量甘草甜素组大鼠膝关节软骨组织中PTEN蛋白表达水平较KOA组均升高(P<0.05),p-AKT/AKT、COX-2、Bax、cleaved caspase-3蛋白表达水平较KOA组均降低(P<0.05);低剂量甘草甜素组大鼠膝关节软骨组织中PTEN蛋白表达水平较阳性药物组降低(P<0.05),p-AKT/AKT、COX-2、Bax、cleaved caspase-3蛋白表达水平较阳性药物组升高(P<0.05);高剂量甘草甜素组大鼠膝关节软骨组织中PTEN蛋白表达水平较阳性药物组、低剂量甘草甜素组均升高(P<0.05),p-AKT/AKT、COX-2、Bax、cleaved caspase-3蛋白表达水平较阳性药物组、低剂量甘草甜素组均降低(P<0.05),见图5。
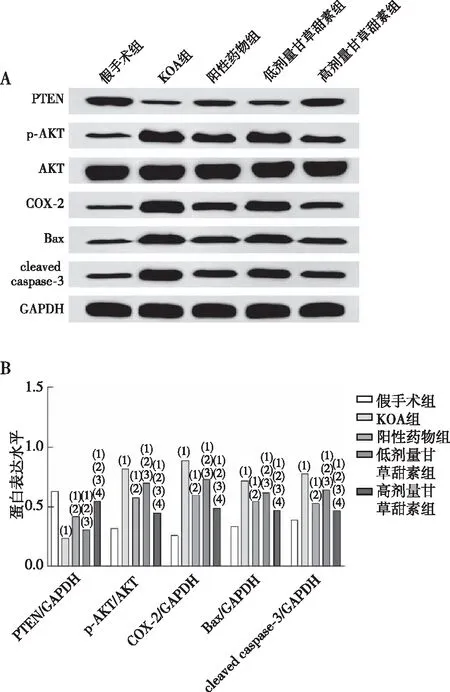
注:A为各组大鼠膝关节软骨组织的蛋白表达(Western blot),B为各组大鼠膝关节软骨组织的蛋白表达;(1)与假手术组同蛋白相比,P<0.05;(2)与KOA组同蛋白相比,P<0.05;(3)与阳性药物组同蛋白相比,P<0.05;(4)与低剂量甘草甜素组同蛋白相比,P<0.05。
3 讨论
KOA是一种临床发病率较高的慢性退行性骨关节病,在我国中老年人群体中的发病率约12%~15%,是目前临床治疗研究及预防保健的重点[12]。目前临床治疗KOA的原则为缓解疼痛,延缓病情,避免膝关节畸形改变,改善膝关节功能,从而提升生存质量[13]。而已有治疗方法如手术治疗、药物治疗、运动康复及关节内注射透明质酸、糖皮质激素等,疗效参差不齐,且可能出现并发症或不良反应,所以,寻求更好的治疗方法显得尤为重要[14]。本研究根据Hulth法建立KOA大鼠模型,发现大鼠膝关节直径、血清IL-1β、IL-6、TNF-α含量及软骨组织细胞凋亡率、凋亡蛋白Bax、cleaved caspase-3水平显著升高,软骨组织中出现软骨细胞数量大量减少、排列紊乱、炎性细胞浸润等病理学改变,提示KOA造模成功。
我国传统中药及其有效单体成分在治疗疾病时具有多靶点、用药安全等优点,在关节炎治疗方面日益受到重视[15]。甘草甜素是中药药用植物甘草中的有效活性成分,具有多种药理作用,在减轻炎症反应方面有较好疗效。胡志平等[16]研究表明,甘草甜素可有效控制类风湿关节炎大鼠关节炎症,减轻足跖关节的炎性肿胀情况。Jiang等[17]研究发现,甘草甜素在体外可抑制人骨关节炎软骨细胞中IL-1β刺激的PI3K/AKT通路激活,在体内可防止小鼠骨关节炎模型中软骨被破坏。Luo等[18]研究显示,甘草甜素治疗可降低骨关节炎大鼠血清和软骨中炎症因子水平,改善机械痛觉过敏及双侧关节水肿。本研究结果显示,低、高剂量的甘草甜素均降低了KOA大鼠血清中的IL-1β、IL-6、TNF-α水平,减小了膝关节直径,且高剂量甘草甜素的效果优于治疗关节炎症疾病的常用药双氯芬酸钠,表明甘草甜素在改善KOA大鼠体内炎症状态及关节水肿情况方面可能更有效。软骨细胞是关节软骨组织中唯一的细胞成分,与软骨形成、状态维护、修复过程关系密切,其凋亡是骨关节退行性改变的主要特征。本研究发现,低、高剂量的甘草甜素均可显著降低软骨组织中细胞凋亡率及Bax、cleaved caspase-3蛋白表达水平,改善软骨组织的病变状态,表明甘草甜素可能减少了软骨细胞凋亡,具有延缓骨关节退行性改变的潜力。
PTEN/AKT/COX-2通路是一条调控炎症反应的通路。Xie等[19]研究认为,维持关节软骨需要PTEN抑制AKT信号通路,关节软骨细胞中持续的AKT信号通过氧化应激诱导小鼠衰老引起骨关节炎。Guan等[20]研究发现,COX-2可通过其代谢产物前列腺素调控炎症因子、基质降解酶表达,逐渐侵蚀软骨,参与骨关节炎发生。本研究发现,KOA大鼠膝关节软骨组织中PTEN蛋白水平下调,p-AKT/AKT、COX-2蛋白水平上调,表明PTEN/AKT/COX-2炎症通路参与KOA发生。而低、高剂量的甘草甜素均可提高KOA大鼠膝关节软骨组织中PTEN蛋白水平,降低p-AKT/AKT、COX-2蛋白水平,表明甘草甜素可上调PTEN表达,抑制AKT/COX-2通路激活,从而改善KOA病情。
综上所述,甘草甜素可能通过上调PTEN表达并抑制AKT磷酸化、COX-2蛋白表达从而调控PTEN/AKT/COX-2炎症通路,降低血清炎症水平,抑制软骨细胞凋亡,改善软骨组织病变状态及膝关节水肿情况,延缓KOA病情。
