基于TNF-α/IKKβ/NF-κB信号通路研究消积丸治疗ApoE−/−小鼠动脉粥样硬化的机制
2022-08-16涂宛晴梁秋儿谢鹏程林丽群陈利国
涂宛晴,梁秋儿,谢鹏程,谢 婷,林丽群,陈利国
基于TNF-α/IKKβ/NF-κB信号通路研究消积丸治疗−/−小鼠动脉粥样硬化的机制
涂宛晴,梁秋儿,谢鹏程,谢 婷,林丽群,陈利国*
暨南大学中医学院,广东 广州 510632
采用网络药理学和动物实验相结合的方法探讨消积丸治疗动脉粥样硬化(atherosclerosis,AS)的作用机制。通过网络药理学进行活性成分-靶点网络构建、蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络分析、基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。50只雄性−∕−小鼠随机分为对照组、模型组、阿托伐他汀(1.3 mg/kg)组和消积丸低、高剂量(8.125、32.500 g/kg)组,模型组和各给药组以高脂饮食喂养,给予相应药物干预4周后,采用全自动生化仪分析小鼠血清脂质水平;采用ELISA法检测小鼠血清中白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)水平;采用苏木素-伊红(HE)、Masson和油红O染色观察小鼠主动脉窦病理变化;采用Western blotting法检测小鼠主动脉组织中TNF-α/κB抑制因子激酶β(inhibitor κB kinase β,IKKβ)/核因子-κB(nuclear factor-κB,NF-κB)信号通路相关蛋白及CD36蛋白表达。共筛选出消积丸136个活性成分及277个作用靶点,4481个AS疾病相关靶点,消积丸和AS的共同靶点有205个,核心靶点主要包括TNF、IL-6、NF-κB、IL-1β等。GO功能和KEGG通路富集分析发现,消积丸治疗AS主要涉及炎症反应、一氧化氮生物合成等过程,调控癌症通路、乙肝通路、TNF信号通路等;在TNF信号通路中进一步筛选得到TNF-α/IKKβ/NF-κB信号通路。动物实验结果显示,与对照组相比,模型组小鼠血清中三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、IL-1β、IL-6、TNF-α、ox-LDL水平均显著升高(<0.01);主动脉中TNF-α蛋白表达以及IKKβ、NF-κB p65磷酸化水平均显著升高(<0.01);主动脉窦内膜不光滑,出现大量胶原纤维和脂质沉积(<0.01),形成明显的AS斑块。与模型组相比,消积丸组小鼠血清中TC、TG、LDL-C、TNF-α、IL-6、ox-LDL水平均显著降低(<0.05、0.01),血清中HDL-C水平显著升高(<0.01);主动脉中TNF-α、CD36蛋白表达以及IKKβ、NF-κB p65磷酸化水平均显著降低(<0.05、0.01);主动脉窦AS斑块减少,胶原蛋白和脂质沉积等情况均得到改善(<0.05、0.01)。消积丸能够通过下调TNF-α/IKKβ/NF-κB信号通路相关蛋白表达,减轻炎症反应,调节脂质代谢,从而发挥治疗AS的作用。
消积丸;网络药理学;动脉粥样硬化;肿瘤坏死因子-α/κB抑制因子激酶β/核因子-κB信号通路;炎症反应;脂质代谢;大黄素;大黄酚;熊果酸
动脉粥样硬化(atherosclerosis,AS)是一种严重危害人体,引发心肌缺血、心肌梗死和脑卒中等多种心血管疾病的慢性炎症性疾病[1-2]。AS多发生于大、中血管内膜,其早期病变为脂质在血管内过多沉积,继而形成斑块,严重时斑块破裂,形成血栓[3]。AS发病率高,每年约2000万人死于此病,因此寻求有效手段防治AS具有重要意义[4]。AS属中医学“脉积”病证范畴,是气血凝聚、息积于脉所致,见于多种血管病变。其基本病机为气滞血瘀、痰瘀凝滞、毒邪侵蚀等,常以活血祛瘀、化痰导滞、清热解毒等方药进行辨证治疗,抑制斑块形成,减轻炎症反应[5]。消积丸是临床上消积导滞的常用中成药,由大黄、牵牛子、山楂、六神曲、麦芽、五灵脂、青皮、陈皮、三棱、莪术、香附共11味中药组成。其中大黄、牵牛子为清热药,合用攻下泻热,破积行瘀;三棱、莪术、五灵脂为活血药,具有破血行气、消积化瘀之功效;山楂、六神曲、麦芽为消积药,具有消食化滞、健脾开胃的功效;青皮、陈皮、香附为理气药,具有理气消积、疏肝健脾之功效。诸药合用共奏消积导滞、行气活血、化痰祛湿、疏肝健脾之功效,从中医理论上可以治疗脉积病证,但其具体的作用机制尚未明确。网络药理学是在系统生物学的基础上结合现代的计算机技术构建“药物-靶点-疾病”相互作用网络,系统地进行观察分析,揭示药物对疾病的影响和作用的一种研究方法[6-7]。中药复方通过多种有效活性成分、多个作用靶点和多种作用途径对疾病进行治疗。运用网络药理学研究中药复方,可以系统地揭示中药复方对疾病网络的作用和机制,体现中医药治疗疾病的整体性[8]。本研究首先基于网络药理学技术探讨消积丸防治AS的潜在作用机制,筛选出关键信号通路,然后进行动物实验验证,为消积丸防治AS提供科学依据。
1 材料
1.1 动物
SPF级雄性−∕−小鼠50只,6~8周龄,体质量18~22 g,购自江苏集萃药康生物科技有限公司,许可证号SCXK(苏)2018-0008,所有小鼠均在暨南大学SPF级实验动物中心饲养,自由进食饮水,光照时间8: 00~20: 00。本动物实验方案获得暨南大学实验动物伦理委员会批准(伦理号20201019-03)。
1.2 药材
大黄(批号20200319)、牵牛子(批号20180630)、山楂(批号20090702)、六神曲(批号19082610)、麦芽(批号19072102)、五灵脂(批号20191120)、青皮(批号200703)、陈皮(批号20081101)、三棱(批号20190710)、莪术(批号20190731)、香附(批号20072507)均购自北京同仁堂广州药业连锁有限公司,经暨南大学刘红杰副教授鉴定分别为蓼科植物掌叶大黄L.的干燥根和根茎、旋花科植物裂叶牵牛(L.) Choisy的干燥成熟种子、蔷薇科植物山楂Bge.的干燥成熟果实、辣蓼、青蒿、杏仁等药加入面粉或麸皮混和后,经发酵而成的曲剂、禾本科植物大麦L.的成熟果实经发芽干燥的炮制加工品、鼯鼠科动物复齿鼯鼠的干燥粪便、芸香科植物橘Blanco及其栽培变种的干燥幼果或未成熟果实的果皮、芸香科植物橘Blanco及其栽培变种的干燥成熟果皮、黑三棱科植物黑三棱Buch.-Ham.的干燥块茎、姜科植物蓬莪术Val.的干燥根茎、莎草科植物莎草L.的干燥根茎。
1.3 药品与试剂
阿托伐他汀钙片(批号DD6317)购自辉瑞制药有限公司;白细胞介素-6(interleukin-6,IL-6)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)ELISA试剂盒(批号20210318)购自江苏酶免实业有限公司;苏木素-伊红(HE)染液、Masson染液、油红O染液购自Servicebio公司;CD36抗体、核因子-κB(nuclear factor-κB,NF-κB)p65抗体、磷酸化NF-κB p65(S536)抗体、κ抑制因子激酶β(inhibitor κB kinase β,IKKβ)抗体、磷酸化IKKβ(Y188)抗体、TNF-α抗体购自英国Abcam公司,批号分别为ab133625、ab32536、ab76302、ab124957、ab194519、ab183218;总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒购自深圳雷杜生命科学股份有限公司,批号分别为20210118、20210420、20210421、20210123。
1.4 仪器
酶标仪(美国伯腾仪器有限公司);Chemray 800型全自动生化分析仪(深圳雷杜生命科学股份有限公司);VE180型垂直电泳槽、VE186型转移电泳槽(上海天能科技有限公司);BG-Power 600i型电泳仪(北京百晶生物技术有限公司);5427R型小型台式高速冷冻离心机(德国Eppendorf公司);Cryostar NX50型切片机(美国Thermo Fisher Scientific公司);Eclipse E100型正置光学显微镜(日本尼康公司)。
2 方法
2.1 网络药理学
2.1.1 消积丸靶点的获取 运用中药系统药理学数据库与分析平台(TCMSP,https://tcmspw.com/ tcmsp.php/)获得消积丸活性成分和作用靶点;利用Uniprot数据库将靶点蛋白名称转换为相对应的基因Symbol。
2.1.2 AS相关靶点获取 通过人类基因数据库(GeneCards,https://www.genecards.org/)检索AS相关基因,将获得的靶点基因与消积丸对应的基因比较分析。
2.1.3 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建 利用Cytoscape软件对消积丸-靶点网络和AS基因PPI网络进行映射,将消积丸与疾病的相交靶点可视化。利用String软件制作蛋白互作图。对消积丸治疗AS的药理作用进行深入探讨。
2.1.4 关键靶点通路富集 使用DAVID数据库对获得的消积丸和AS的共同靶点进行基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
2.2 动物实验
2.2.1 消积丸的制备 按组方取大黄10 g、牵牛子3 g、山楂30 g、六神曲15 g、麦芽15 g、五灵脂6 g、青皮10 g、陈皮10 g、三棱10 g、莪术10 g、香附6 g,将药材浸入蒸馏水30 min,武火煮沸,文火煎30 min,将药液滤过,残渣中加入蒸馏水,再煎1次,合并2次滤液,水浴浓缩为质量浓度为5 g/mL(以生药量计)的溶液,经高效液相色谱仪测定其主要含大黄素112.47 μg/g、大黄酚361.40 μg/g、熊果酸333.93 μg/g[9-10],于4 ℃保存备用。
2.2.2 动物分组、造模和给药 将50只−∕−小鼠,按体质量随机分为对照组、模型组、阿托伐他汀(1.3 mg/kg,临床等效剂量)组和消积丸低、高剂量(8.125、32.500 g/kg,分别相当于临床剂量的0.5、2倍)组,每组10只。对照组以普通饮食喂养,模型组和各给药组以高脂饮食喂养12周。自第8周开始,各给药组ig相应药物,对照组和模型组ig等体积生理盐水,1次/d,连续4周。
2.2.3 血脂水平检测 第12周末,小鼠称定质量后麻醉,眼球取血,室温静置2 h后,4 ℃、4000 r/min离心15 min,吸取上层血清,采用全自动生化仪检测TC、TG、LDL-C和HDL-C水平。
2.2.4 血清炎症因子和ox-LDL水平检测 按照试剂盒说明书测定血清中IL-1β、IL-6、TNF-α和ox-LDL水平。
2.2.5 主动脉组织HE、Masson和油红O染色 取各组小鼠心脏组织,清洗后,于4%多聚甲醛溶液中固定,包埋后对主动脉窦区域进行连续切片,厚度5 μm,分别进行HE、Masson和油红O染色,于光学显微镜下观察并拍照。
2.2.6 Western blotting检测主动脉TNF-α/IKKβ/NF-κB信号通路相关蛋白及CD36蛋白表达 分离各组小鼠主动脉,加入裂解液提取蛋白。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,分别加入一抗和二抗,加入化学发光试剂后,显影并固定在X线胶片上。
3 结果
3.1 消积丸治疗AS的靶点
如图1所示,通过TCMSP数据库共获得了消积丸136个活性成分和482个作用靶点。从GeneCards获得了AS相关靶点4686个,与消积丸靶点取交集,得到205个共有靶点。利用Cytoscape软件将消积丸与AS的共有靶点进行可视化(图2)。通过String数据库,获得PPI图,图中的圆形节点代表蛋白,用直线连接的2个蛋白之间具有一定的相互作用关系,以节点的多少和颜色的深浅代表互作关系的强弱,排名前30的靶点作为核心靶点,包括TNF-α、IL-6、NF-κB、IL-1β等(图3)。
3.2 GO功能和KEGG通路富集分析
使用DAVID对消积丸与AS的共同靶点进行GO功能富集分析见图4,发现主要涉及的生物过程包括调节炎症反应、一氧化氮生物合成等,在细胞外间隙、胞质溶胶等细胞组分中起作用,激活了酶结合、蛋白质结合等分子功能。进一步通过KEGG通路富集分析(图5)筛选出癌症通路、乙肝通路、TNF信号通路等富集基因数较多的通路,可能是消积丸参与防治AS的重要作用途径。基于富集到的TNF信号通路,进一步筛选得到TNF-α/IKKβ/NF-κB信号通路(图6),开展动物实验进行验证。
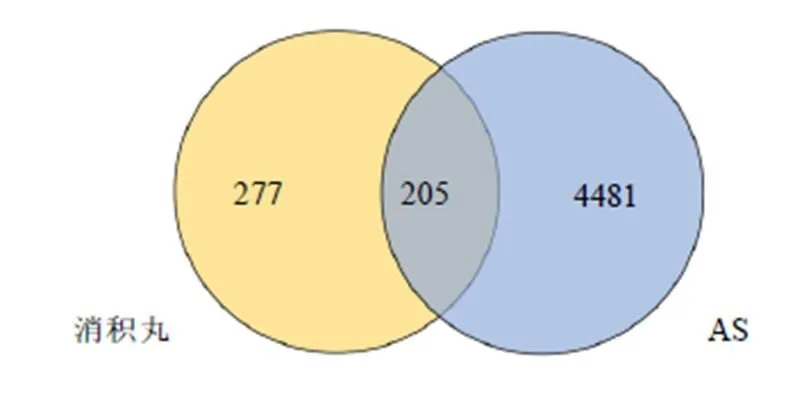
图1 消积丸-AS靶点的Venn图
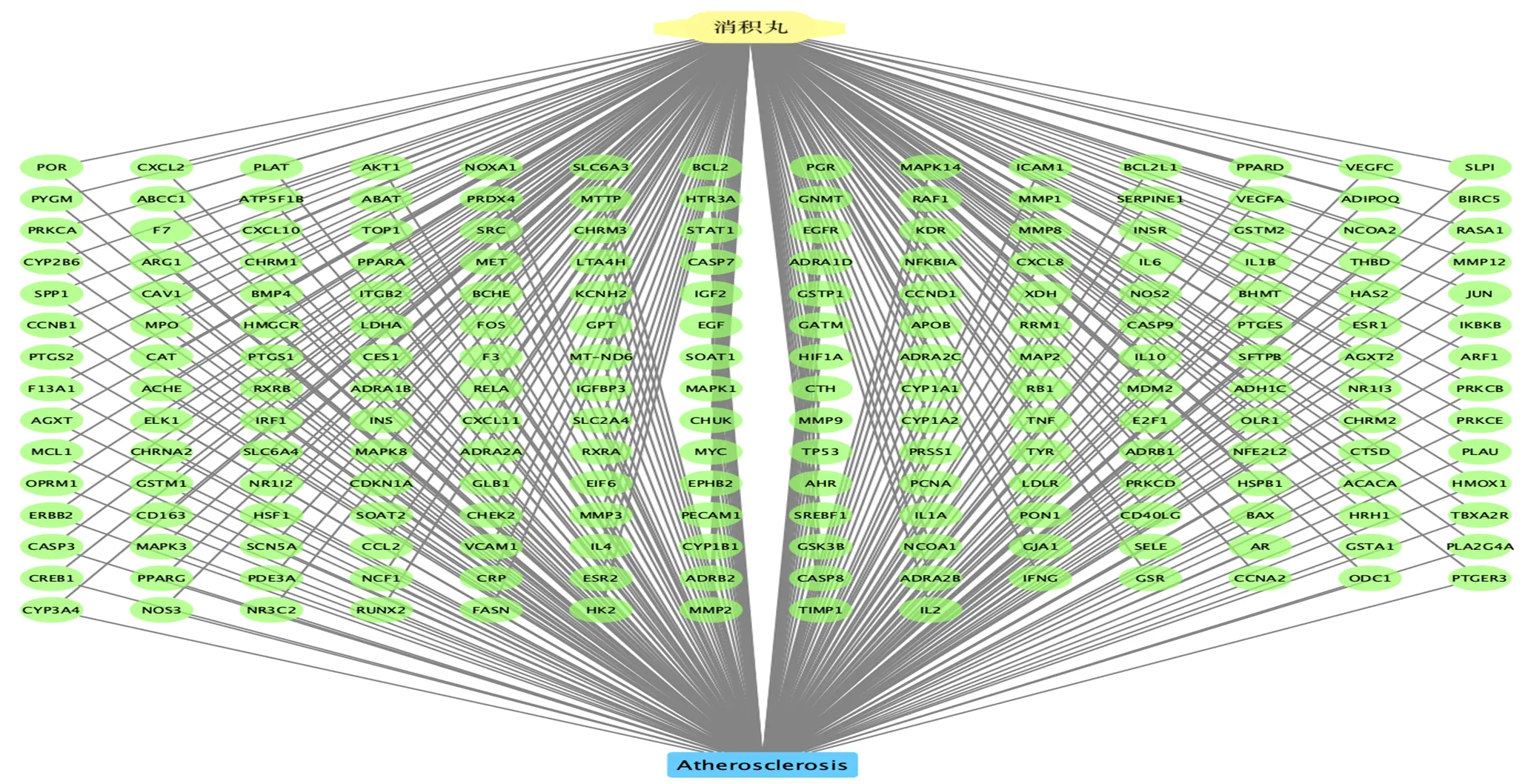
图2 消积丸-靶点-AS网络

图3 PPI网络

图4 GO功能富集分析
3.3 消积丸对ApoE−∕−小鼠血清脂质水平的影响
如图7所示,与对照组相比,模型组小鼠血清中TG、TC、HDL-C、LDL-C水平均显著升高(<0.01);与模型组相比,各给药组小鼠血清中TG、TC水平均显著降低<0.05、0.01),阿托伐他汀组和消积丸低剂量组小鼠血清中HDL-C水平显著升高(<0.05、0.01),LDL-C水平显著降低(<0.01)。提示消积丸对−∕−小鼠血清脂质水平具有调节作用。
3.4 消积丸对ApoE−∕−小鼠血清中IL-1β、IL-6、TNF-α和ox-LDL水平的影响
如图8所示,与对照组比较,模型组小鼠血清中IL-1β、IL-6、TNF-α和ox-LDL水平均显著升高(<0.01);与模型组比较,各给药组血清中IL-6和ox-LDL水平降低(<0.01),阿托伐他汀组和消积丸高剂量组TNF-α水平明显降低(<0.05)。提示消积丸对−∕−小鼠血清炎症水平具有调节作用。
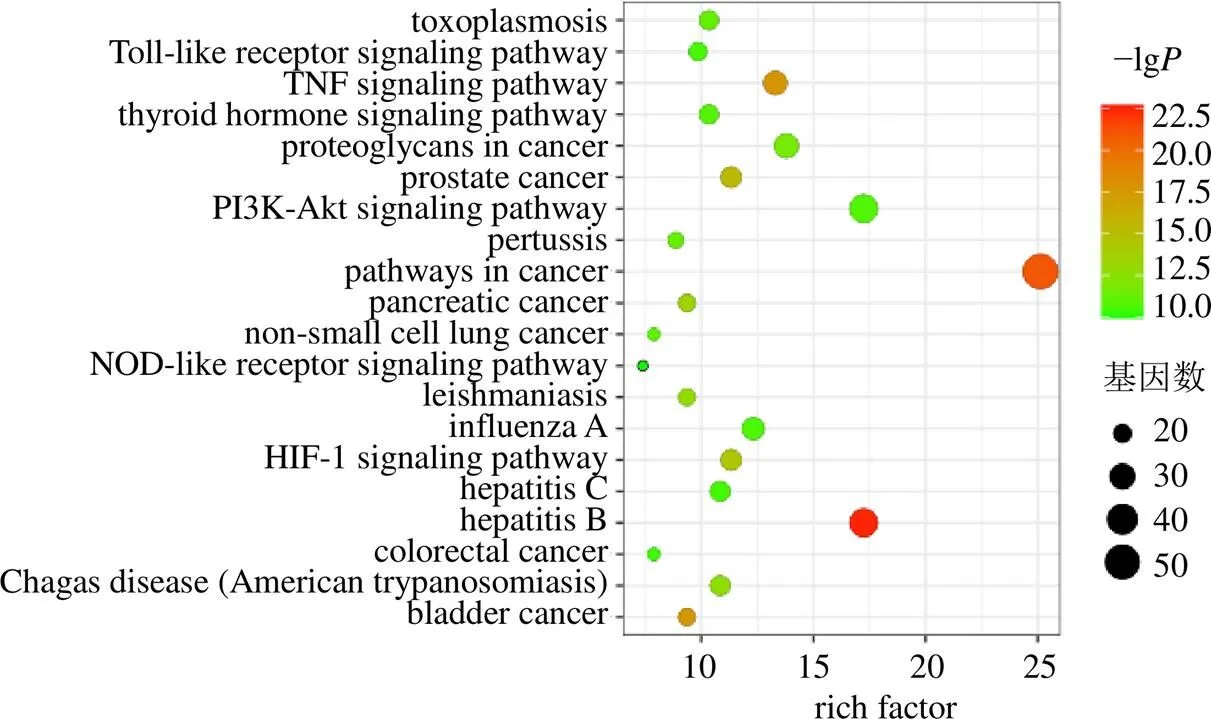
图5 KEGG通路富集分析
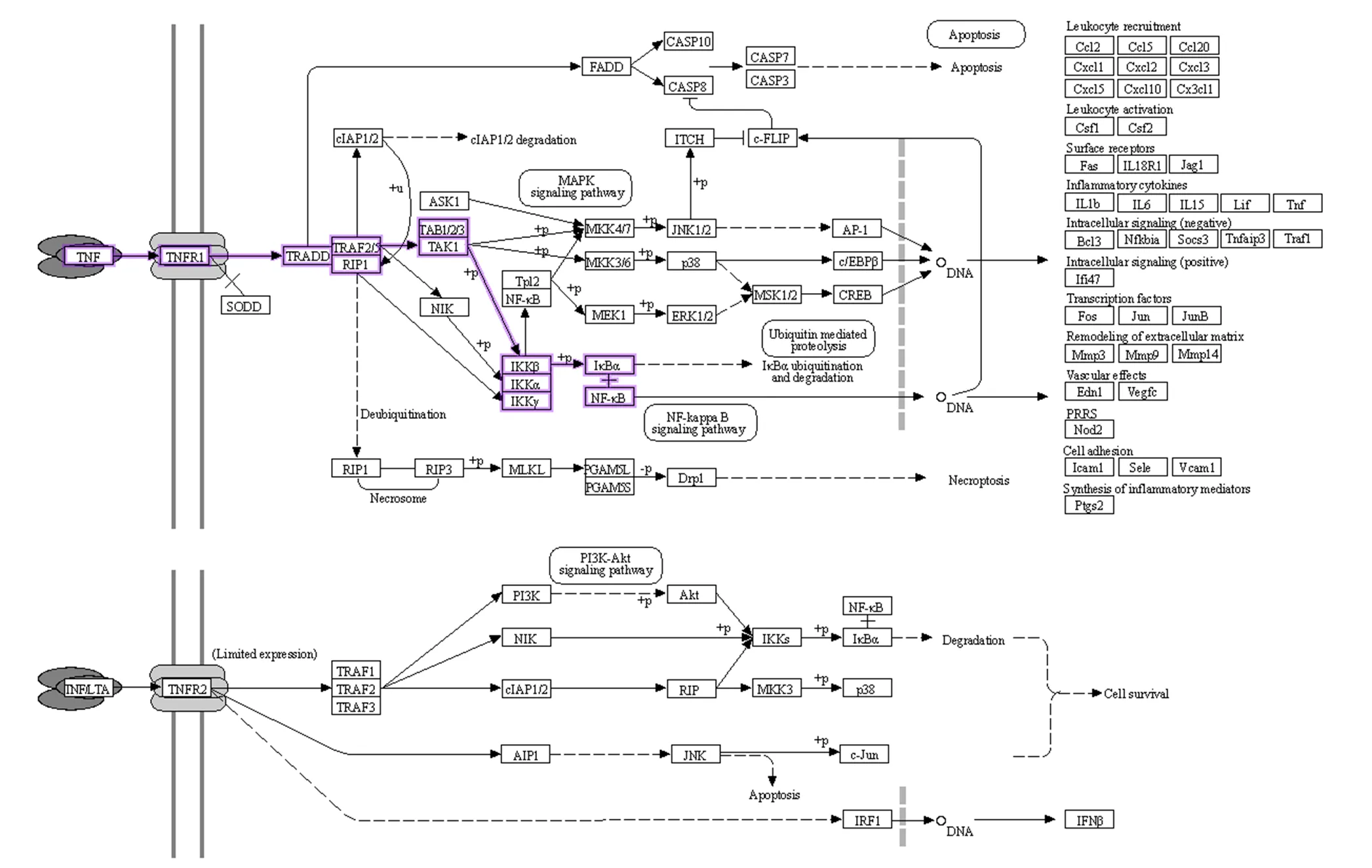
图6 TNF-α/IKKβ/NF-κB信号通路
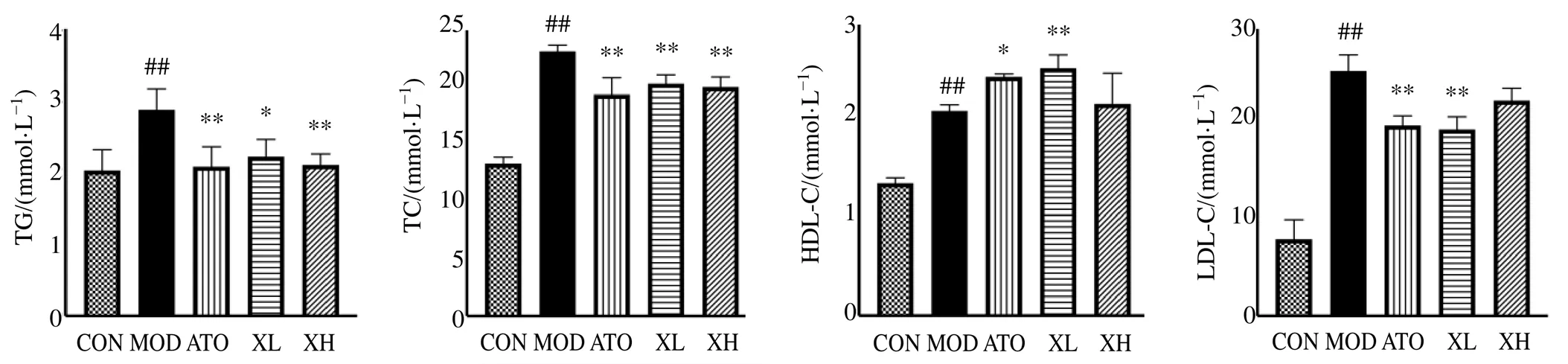
CON-对照组;MOD-模型组;ATO-阿托伐他汀组;XL-消积丸低剂量组;XH-消积丸高剂量组 与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01,下同
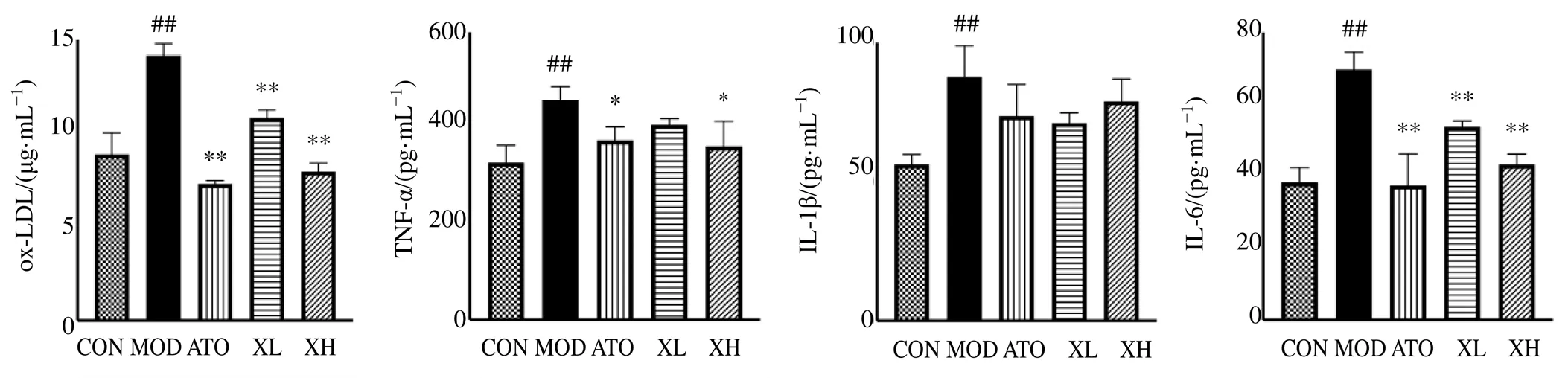
图8 消积丸对ApoE−∕−小鼠血清炎症因子水平的影响(, n = 4)
3.5 消积丸对ApoE−∕−小鼠主动脉窦AS病变的影响
如图9所示,对照组小鼠主动脉窦内皮完整,分界较清晰,未见明显病理征象。模型组小鼠主动脉窦内膜不光滑,出现大量胶原纤维和脂质沉积(<0.01),可见大量炎性细胞和泡沫细胞堆积,形成明显的AS斑块,表示AS模型建立成功。与模型组相比,各给药组小鼠主动脉窦AS斑块均不同程度地减少,脂质沉积及纤维化等情况均得到改善(<0.05、0.01)。
3.6 消积丸对ApoE−∕−小鼠主动脉TNF-α/IKKβ/NF-κB信号通路相关蛋白及CD36蛋白表达的影响
为了进一步研究消积丸调节脂质和炎症的机制,检测了TNF-α/IKKβ/NF-κB信号通路中的关键蛋白TNF-α、IKKβ、p-IKKβ、NF-κB p65、p-NF-κB p65。如图10所示,与对照组相比,模型组小鼠主动脉中TNF-α蛋白表达和IKKβ、NF-κB p65磷酸化水平均显著升高(<0.01);与模型组相比,各给药组小鼠主动脉中TNF-α蛋白表达和IKKβ、NF-κB p65磷酸化水平均显著降低(<0.05、0.01),消积丸高剂量组和阿托伐他汀组CD36蛋白表达水平明显降低(<0.05)。
4 讨论
AS是一种以脂质代谢异常、炎症反应和氧化应激等为主要病理基础的慢性血管性疾病[11]。其主要病理改变为脂质在血管内皮沉积、纤维组织逐渐增生、动脉壁变厚变硬、管腔狭窄,属中医学“脉积”范畴。脉积,因气血凝积、稽留日久而成,有留著于孙脉、络脉、经脉、输脉、伏冲脉之不同,但其病变部位皆在于脉。临床所见,痰浊、瘀血、毒邪,以及脏腑功能失调等因素常导致AS斑块的形成[12],因于痰浊瘀血、痹阻脉络、痰瘀搏结等病机变化而致AS[13-14]。因此,临床上常综合运用理气祛痰、化浊逐瘀、清热解毒、健脾益肾等方法进行施治[15]。消积丸由大黄、牵牛子、山楂、六神曲、麦芽、五灵脂、青皮、陈皮、三棱、莪术、香附11味中药组成,具有消积活血、行气导滞、化痰祛湿、疏肝健脾之功效,从中医理论上可以治疗脉积病证,然而其作用机制尚未完全明确。
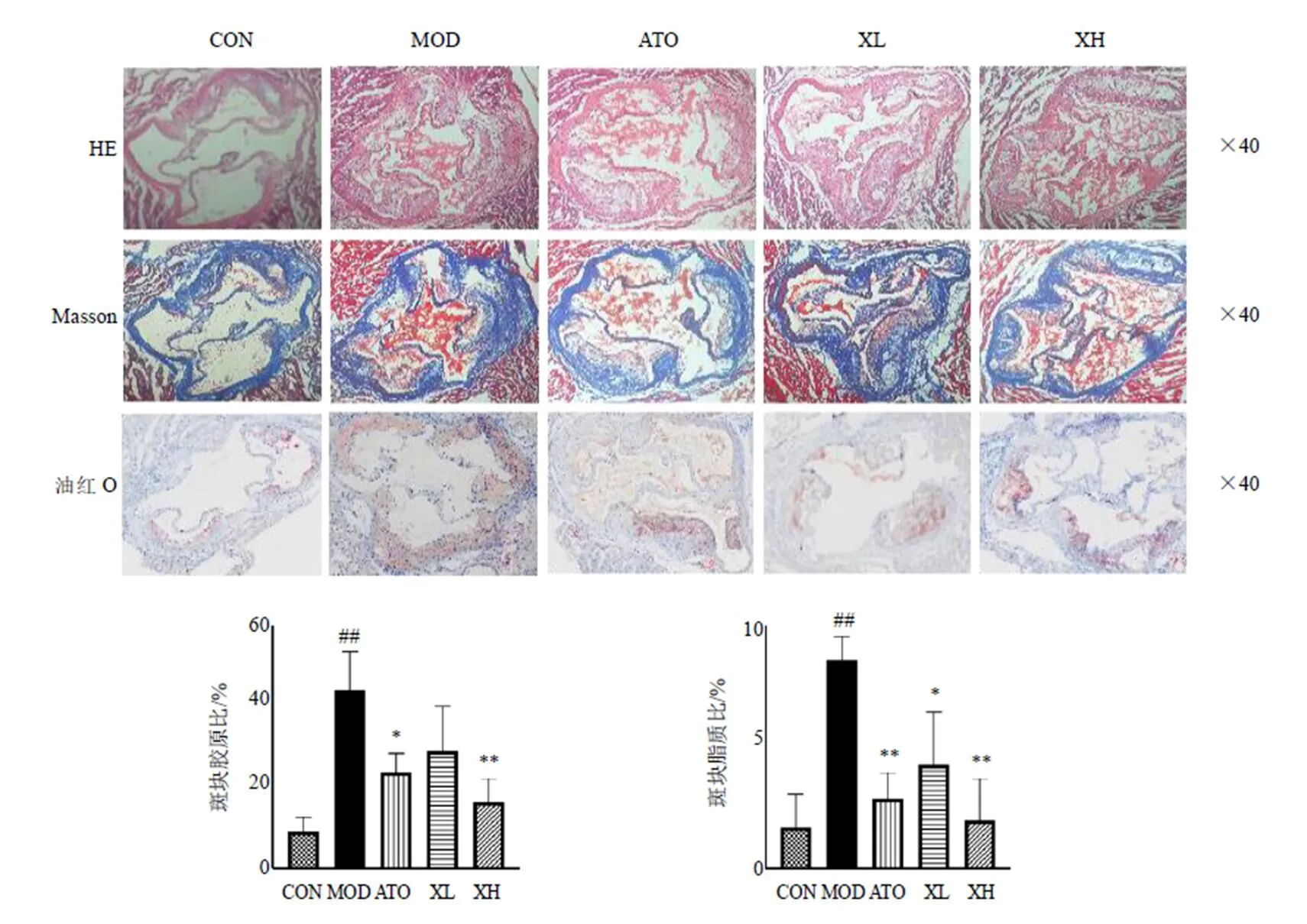
图9 消积丸对ApoE−∕−小鼠主动脉窦AS病变的影响(, n = 3)

图10 消积丸对ApoE−∕−小鼠主动脉中TNF-α/IKKβ/NF-κB信号通路相关蛋白及CD36蛋白表达的影响(, n = 3)
本研究首先借助网络药理学从多靶点、多角度、多途径揭示了消积丸治疗AS的作用机制,探讨了消积丸治疗AS的潜在靶点和机制。网络药理学在构建“消积丸-靶点-AS”交互网络的基础上,分析消积丸通过复杂网络对AS的干预和影响,使用可视化大规模数据直观清晰地观察网络各个节点之间的交互,为消积丸治疗AS的靶点及机制研究提供新平台。网络药理学结果显示,共筛选出消积丸136个活性成分及277个作用靶点,4481个AS疾病相关靶点,消积丸和AS的共同靶点有205个,核心靶点主要包括TNF、IL-6、NF-κB、IL-1β等,这些靶点均与炎症反应密切相关。GO功能和KEGG通路富集分析结果表明,消积丸治疗AS主要涉及的生物过程为调节炎症反应和一氧化氮生物合成等,主要作用途径包括癌症通路、乙肝通路、TNF信号通路等。结合富集分析,在TNF信号通路中进一步筛选得到炎症信号通路——TNF-α/IKKβ/NF-κB信号通路。网络药理学研究表明,消积丸可能通过调节TNF-α/IKKβ/NF-κB信号通路,改善炎症反应,缓解AS,为后续实验研究提供了参考和方向。
1992年,−∕−小鼠成为用于AS领域的首个转基因动物模型。Plump等[16]首次利用胚胎干细胞同源重组和基因敲除技术培育出−∕−小鼠,发现该小鼠易诱导形成AS,具有典型的AS病理形态特征,且斑块形成的继发病变与AS患者非常相似。−∕−小鼠已成为目前研究AS应用最为广泛的转基因小鼠[17]。Rosenfeld等[18]研究发现,−∕−小鼠动脉内膜中的斑块随着时间推移而不断发展变化,年龄越大的小鼠主动脉内越易观察到AS病变,表现出典型的纤维斑块。Knouf等[19]发现,−∕−小鼠本身无法完全摄取肝脏中的TG,导致体循环中TG大量滞留,脂质代谢失常,形成了高脂血症和AS,并且发现其斑块受损部位和斑块的病变进程均与人类的AS极其相似。Nakashima等[20]将−∕−小鼠进行分组,分别给予西方膳食和普通饲料进行喂养,并对不同饮食下小鼠的AS病变进行系统分析,发现小鼠的AS病变主要发生在主动脉及其分支、肺动脉、头臂动脉以及颈动脉,普通饮食的小鼠8~10周开始出现泡沫细胞,15周时大量平滑肌细胞迁移,20周后纤维帽、细胞外基质和平滑肌细胞大量聚集形成明显可见的纤维斑块;而给予西方膳食喂养会加速这一过程并形成胆固醇结晶、坏死和钙化等更进一步的AS病变。−∕−小鼠模型具有体型小、实验操作简便易行、实验周期较短、繁殖速度快、成本低廉等优点,其在正常饮食下也可能发生AS病变,并且其病变过程和表现与人类的AS病变十分相似。如果给予−∕−小鼠高脂高胆固醇饲料进行喂养,则其形成AS的可能性会显著增加,疾病的进程也会显著加快[21]。因此,本研究采用雄性−∕−小鼠给予高脂饲料喂养12周的方式建立AS动物模型。
AS的发生发展与脂质代谢异常和炎症反应密切相关[11]。大量研究表明,AS的发病率随着血清中LDL-C水平的增加而升高,随着HDL-C水平的减少而下降[22]。高脂血症是AS的危险因素,血清中TG水平过高易导致AS的发生和发展[23]。因此,调节脂质分布对于减缓AS进展非常重要。此外,各种炎症因子对AS的发生发展也具有不同程度的作用[24-25]。TNF-α是一种广泛分布于内皮细胞表面的重要炎症介质,是AS的炎性标志物之一,代表AS炎症活跃程度[24]。IL-6作为强效促炎性细胞因子,可以诱导如IL-1β和TNF-α等炎症因子的表达,增强炎症反应[26]。IL-1β是一种重要炎性标志物,可以诱导其下游如IL-6等炎症因子大量产生,引起炎症级联反应[27]。本研究结果显示,消积丸能够降低−∕−小鼠血清中IL-1β、IL-6、TNF-α水平。ox-LDL作为心脑血管疾病生物标志物,通过促进炎症反应和血管内膜脂质沉积从而影响AS的发生发展[28]。CD36与ox-LDL结合,参与AS的不同病理过程,具有强烈的致AS作用[29]。高脂饮食的−∕−小鼠是研究AS发病机制的理想动物模型[30]。在本研究中,与正常饮食的小鼠相比,高脂饮食12周的−∕−小鼠血清中TG、TC、HDL-C、LDL-C、ox-LDL、IL-1β、IL-6、TNF-α水平均显著升高;主动脉窦HE、Masson和油红O染色结果显示动脉内膜粥样斑块形成,脂质和胶原蛋白明显沉积。提示本研究中的AS小鼠模型构建成功,脂质代谢紊乱和炎症反应可能是−∕−小鼠形成AS病变的重要途径。阿托伐他汀是一种强效的降胆固醇药物,具有抑制炎症细胞和炎症介质释放、抑制血栓形成、保持斑块稳定等作用,因此在动物实验中选用阿托伐他汀作为阳性对照药物[31]。结果表明,与模型组相比,消积丸和阿托伐他汀均能够降低小鼠血清中IL-1β、IL-6、TNF-α、TG、TC、LDL-C、ox-LDL水平,升高HDL-C水平,降低主动脉中CD36蛋白表达水平,表明消积丸和阿托伐他汀可以调节血脂水平,缓解炎症反应,其中高剂量的消积丸的疗效与阿托伐他汀接近,且优于低剂量的消积丸。此外,消积丸和阿托伐他汀治疗组小鼠主动脉窦AS斑块均有不同程度减少,脂质沉积和纤维化等情况均得到改善。提示消积丸能够调节脂质代谢,减轻炎症反应,减缓AS进展,且呈剂量相关性。
TNF-α/IKKβ/NF-κB信号通路是介导炎症反应的关键信号通路,影响AS的发生与发展[30]。TNF-α可以与细胞膜表面的TNF受体相关因子结合,介导IKKβ/NF-κB信号通路等多种下游信号通路传导,从而促进炎症反应和AS进程。抑制TNF-α的表达可能会抑制AS晚期病变的形成[31]。NF-κB作为炎症反应中重要的核转录因子,通过激活磷酸化κB抑制因子(inhibitor κB,IκB)的p65/p50二聚体,迁移到细胞核中发挥活性,介导炎症因子的转录,诱发AS发病或加重病情[31]。IKKβ是一种常见的转录因子,通过磷酸化激活后发挥其效应,对NF-κB的活化起着关键作用[32]。基于网络药理学结果筛选出TNF-α/IKKβ/NF-κB信号通路进行体内实验研究,结果显示,与对照组相比,模型组小鼠主动脉中TNF-α蛋白表达以及IKKβ和NF-κB p65磷酸化水平均显著升高,表明TNF-α/IKKβ/NF-κB信号通路的激活与AS密切相关,与文献报道一致[30],提示TNF-α/IKKβ/NF-κB信号通路在AS的整个疾病过程中发挥重要作用。与模型组相比,消积丸组和阿托伐他汀组小鼠主动脉中TNF-α蛋白表达以及IKKβ和NF-κB p65磷酸化水平均显著降低,其中高剂量消积丸的下调作用与阿托伐他汀接近,较低剂量消积丸作用更加明显。提示消积丸治疗AS的作用可能是通过下调TNF-α/IKKβ/NF-κB信号通路来实现的。
综上所述,本研究通过网络药理学方法预测了消积丸治疗AS的潜在靶点和作用机制,并进一步通过动物实验进行验证。结果表明,消积丸能够通过下调TNF-α/IKKβ/NF-κB信号通路,发挥减轻炎症反应、调节脂质代谢等作用从而治疗AS。
利益冲突 所有作者均声明不存在利益冲突
[1] Hu C X, Li L J. The application of resveratrol to mesenchymal stromal cell-based regenerative medicine [J]., 2019, 10(1): 307.
[2] Members W G, Mozaffarian D, Benjamin E J,. Executive summary: Heart disease and stroke statistics: 2016 update: A report from the American Heart Association [J]., 2016, 133(4): 447-454.
[3] Rayner K J, Esau C C, Hussain F N,. Inhibition of miR-33a/b in non-human primates raises plasma HDL and lowers VLDL triglycerides [J]., 2011, 478(7369): 404-407.
[4] Herrington W, Lacey B, Sherliker P,. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease [J]., 2016, 118(4): 535-546.
[5] 吕奕. 中西医治疗动脉粥样硬化的研究综述 [J]. 内蒙古中医药, 2020, 39(4): 165-166.
[6] 庄延双, 蔡宝昌, 张自力. 网络药理学在中药研究中的应用进展 [J]. 南京中医药大学学报, 2021, 37(1): 156-160.
[7] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[8] Westerhoff H V. Network-based pharmacology through systems biology [J]., 2015, 15: 15-16.
[9] 吉莹洁, 赵建颖. HPLC法测定消积丸中大黄素和大黄酚的含量 [J]. 海峡药学, 2016, 28(02): 65-67.
[10] 裴美艳, 侯建平, 杨瑞瑞. HPLC-ELSD法测定消积丸中熊果酸的含量 [J]. 陕西中医学院学报, 2008(2): 51-52.
[11] Lu Y D, Sun Y C, Jiang Z L,. Guanxinshutong alleviates atherosclerosis by suppressing oxidative stress and proinflammation in−∕−mice [J]., 2020, 2020: 1219371.
[12] 陶修龙, 姚淮芳, 宋媛媛. 中医从“瘀”论治动脉粥样硬化 [J]. 中医药临床杂志, 2017, 29(3): 366-368.
[13] 陈果然, 顾锡镇. 顾锡镇教授治疗颈动脉粥样硬化经验 [J]. 浙江中医药大学学报, 2019, 43(3): 260-262.
[14] 麻莉, 杨迎飞, 童晓云. 《金匮要略》“阳微阴弦”病机在动脉粥样硬化治疗中的应用探讨 [J]. 浙江中医药大学学报, 2017, 41(11): 855-859.
[15] 康骏, 叶良策, 胡悫, 等. 动脉粥样硬化中医研究进展 [J]. 实用中西医结合临床, 2020, 20(6): 181-183.
[16] Plump A S, Smith J D, Hayek T,. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells [J]., 1992, 71(2): 343-353.
[17] 翟永志, 晏沐阳. 载脂蛋白E基因敲除小鼠用于动脉粥样硬化研究的进展 [J]. 中国比较医学杂志, 2008, 18(2): 55-58.
[18] Rosenfeld M E, Polinsky P, Virmani R,. Advanced atherosclerotic lesions in the innominate artery of the ApoE knockout mouse [J]., 2000, 20(12): 2587-2592.
[19] Knouf C, Hinsdale M E, Mezdour H,. ApoE structure determines VLDL clearance and atherosclerosis risk in mice [J]., 1999, 103(11): 1579-1586.
[20] Nakashima Y, Plump A S, Raines E W,. ApoE-deficient mice develop lesions of all phases of atherosclerosis throughout the arterial tree [J]., 1994, 14(1): 133-140.
[21] 王迪, 王毅. 动脉粥样硬化动物模型及其进展 [J]. 心脏杂志, 2018, 30(4): 490-493.
[22] Ahotupa M. Oxidized lipoprotein lipids and atherosclerosis [J]., 2017, 51(4): 439-447.
[23] Peng J, Luo F, Ruan G Y,. Hypertriglyceridemia and atherosclerosis [J]., 2017, 16(1): 233.
[24] 董亚兰, 胡德胜. 动脉粥样硬化的炎症应答特征及运用 [J]. 中国动脉硬化杂志, 2022, 30(4): 304-312.
[25] Libby P, Ridker P M, Hansson G K,. Inflammation in atherosclerosis: From pathophysiology to practice [J]., 2009, 54(23): 2129-2138.
[26] Funayama H, Ishikawa S E, Kubo N,. Increases in interleukin-6 and matrix metalloproteinase-9 in the infarct-related coronary artery of acute myocardial infarction [J]., 2004, 68(5): 451-454.
[27] Libby P. Interleukin-1 beta as a target for atherosclerosis therapy: Biological basis of CANTOS and beyond [J]., 2017, 70(18): 2278-2289.
[28] Trpkovic A, Resanovic I, Stanimirovic J,. Oxidized low-density lipoprotein as a biomarker of cardiovascular diseases [J]., 2015, 52(2): 70-85.
[29] 彭利君, 张葵, 魏红霞, 等. CD36的结构、功能调节及其在动脉粥样硬化中的作用 [J]. 中国动脉硬化杂志, 2018, 26(7): 749-756.
[30] 冯伟, 魏海燕, 师艳艳. 基于TLR4/NF-κB途径探究左西孟旦调控巨噬细胞极化减轻动脉粥样硬化的作用 [J]. 药物评价研究, 2021, 44(12): 2578-2586.
[31] Boesten L S, Zadelaar A S, van Nieuwkoop A,. Tumor necrosis factor-alpha promotes atherosclerotic lesion progression in APOE*3-Leiden transgenic mice [J]., 2005, 66(1): 179-185.
[32] Sui Y P, Park S H, Xu J X,. IKKβ links vascular inflammation to obesity and atherosclerosis [J]., 2014, 211(5): 869-886.
Mechanism of Xiaoji Pills in treatment of atherosclerosis in−∕−mice based on TNF-α/IKKβ/NF-κB signaling pathway
TU Wan-qing, LIANG Qiu-er, XIE Peng-cheng, XIE Ting, Lam Lai Kwan, CHEN Li-guo
School of Traditional Chinese Medicine, Jinan University, Guangzhou 510632, China
To explore the mechanism of Xiaoji Pills (消积丸, XJP) in the treatment of atherosclerosis (AS) by combining network pharmacology and animal experiments.Through network pharmacology, active ingredient-target network construction, protein-protein interaction (PPI) network analysis, gene ontology (GO) function and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis were performed. Fifty male−∕−mice were randomly divided into control group, model group, atorvastatin (1.3 mg/kg) group and XJP low-, high-dose (8.125, 32.500 g/kg) groups, model group and each administration group were fed with high-fat diet, and after 4 weeks of corresponding drug intervention, lipid levels in serum were analyzed by automatic biochemical analyzer; ELISA method was used to detect the levels of interleukin-1β (IL-1β), IL-6, tumor necrosis factor-α (TNF-α) and oxidized low density lipoprotein (ox-LDL) in serum. Hematoxylin-eosin (HE), Masson and oil red O staining were used to observe the pathological changes of aortic tissues. Western blotting method was used to detect the expressions of TNF-α/inhibitor κB kinase β (IKKβ)/nuclear factor-κB (NF-κB) signaling pathway related proteins and CD36 protein in aortic tissue.A total of 136 active ingredients and 277 targets of XJP, 4481 disease-related targets of AS, and 205 common targets of XJP and AS were screened out, core targets mainly involving TNF, IL-6, NF-κB and IL-1β. GO function and KEGG pathway enrichment analysis showed that the treatment of AS by XJP mainly involved inflammatory reaction, nitric oxide biosynthesis and other processes, regulating cancer pathway, hepatitis B pathway and TNF signaling pathway. TNF-α/IKKβ/NF-κB signaling pathway was further screened in TNF signaling pathway. The results of animal experiments showed that compared with control group, levels of triglyceride (TG), total cholesterol (TC), high density lipoprotein cholesterol (HDL-C), low density lipoprotein cholesterol (LDL-C), IL-1β, IL-6, TNF-α, ox-LDL in serum of mice in model group were significantly increased (< 0.01), TNF-α protein expression, IKKβ and NF-κB p65 phosphorylation levels in aorta were significantly increased (< 0.01), intima of aortic sinus was not smooth with a large number of collagen fibers and lipid deposition (< 0.01), and obvious AS plaques were formed. Compared with model group, levels of TC, TG, LDL-C, TNF-α, IL-6 and ox-LDL in serum of mice in XJP groups were significantly decreased (< 0.05, 0.01). TNF-α, CD36 protein expressions and IKKβ, NF-κB p65 phosphorylation levels in aorta were significantly decreased (< 0.05, 0.01); aortic sinus AS plaques were decreased, collagen protein and lipid deposition were improved (< 0.05, 0.01).XJP can treat AS by downregulating related proteins expression in TNF-α/IKKβ/NF-κB signaling pathway, reducing inflammation and regulating lipid metabolism.
Xiaoji Pills; network pharmacology; atherosclerosis; tumor necrosis factor-α/inhibitor κB kinase β/nuclear factor-κB signaling pathway; inflammation; lipid metabolism;emodin; chrysophanol; ursolic acid
R285.5
A
0253 - 2670(2022)16 - 5074 - 11
10.7501/j.issn.0253-2670.2022.16.017
2022-04-15
国家自然科学基金资助项目(81673848)
涂宛晴(1995—),女,硕士研究生,主要从事动脉粥样硬化相关研究。E-mail: tuwanqing@126.com
陈利国(1960—),男,主任医师,教授,博士生导师,主要从事老年病心脑血管疾病相关研究。E-mail: tchenly@jnu.edu.cn
[责任编辑 李亚楠]
