把握本质,探寻规律
——离子反应新题型赏析
2022-08-15刘刚
刘 刚
(安徽省宿城第一中学)
离子共存问题是高中化学知识的重点及难点之一,涉及复分解反应、氧化还原反应、水解与电离等核心知识点,体现“宏观辨识与微观探析”“变化观念与平衡思想”等化学学科核心素养,因此在历年各地高考中备受青睐.
1 指定的溶液中粒子能否共存的判断和分析
例1对下列粒子组在指定溶液中能否大量共存的判断和分析均正确的是( ).



由常见的离子共存延伸到指定溶液中粒子能否共存的判断和分析,立足于化学学科核心素养中的“证据推理”构建“模型认知”.指定溶液中的离子与分子、分子与分子间的共存判断和分析,考查角度主要涉及分子与离子间的氧化还原反应等重要知识点,是离子共存的有效拓展,是试题传承创新的重要体现.它强调分析过程,注重“有理有据”,把握粒子间反应的本质,探析反应规律是解决问题的根本.
变式下列离子组中加(或通)入相应试剂后,判断和分析均正确的是( ).



2 工业流程中涉及的离子反应
例2一种利用废旧镀锌铁皮制备磁性Fe3O4纳米粒子的工艺流程如图1所示.

图1
下列有关说法不正确的是( ).
A.“碱洗”是为了去除废旧镀锌铁皮表面的油污
B.“氧化”时发生反应的离子方程式为
2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
C.“氧化”后的溶液中,金属阳离子主要有Fe2+、Fe3+、Na+
D.用激光笔照射“加热沉铁”后所得分散系,产生丁达尔效应

向废旧镀锌铁皮中加入NaOH 溶液除去锌,过滤,再向固体中加入稀硫酸,铁与稀硫酸反应生成FeSO4,向FeSO4溶液中加入NaClO 溶液,将部分Fe2+氧化为Fe3+,发生反应:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,先通入N2排尽空气(防止后续生成的Fe(OH)2被氧化),加入NaOH 溶液产生Fe(OH)2和Fe(OH)3胶体,分离得到Fe(OH)2和Fe(OH)3,灼烧得到Fe3O4.由分析可知,“碱洗”是为了除去锌,生成Na2ZnO2,过滤得到铁单质,选项A错误.“氧化”时,Fe2+与ClO-发生氧化还原反应,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,溶液中金属阳离子主要有Fe2+、Fe3+、Na+,故选项B、C 正确.“加热沉铁”后所得分散系为胶体,胶体可产生丁达尔效应,选项D 正确.答案为A.
该类试题契合知识问题化、问题情境化的要求,问题设置既可围绕真实的工业生产情境并存发散,涉及知识的方方面面,也可以层层递进,将生产中对实际问题的探究逐步引向深入.这类立足于离子反应知识考查新情境的工业流程题,考查角度多变,是高考命题的重要特征和发展趋势.
变式镀锌铁皮可用于制备七水合硫酸锌(ZnSO4·7H2O),其流程如图2所示.

图2
下列有关说法正确的是( ).
A.镀锌铁皮的镀层被破坏后,铁的腐蚀比生铁快
B.“氧化”过程发生反应的离子方程式为
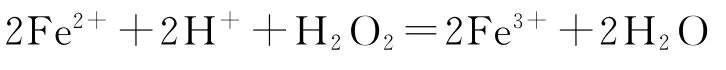
C.“调pH”后所得溶液中大量存在的离子有Zn2+、、Fe3+、H+
D.从“过滤2”所得滤液中获取晶体的操作为:蒸发滤液至有大量晶体出现时停止加热,利用余热将液体蒸干

镀锌铁皮加入稀硫酸溶解,Zn、Fe分别与稀硫酸反应生成ZnSO4、FeSO4,过滤除去不溶于硫酸的杂质,滤液中加入H2O2,将Fe2+氧化为Fe3+,再加入ZnO 调节pH,除去Fe3+,使其转化为Fe(OH)3沉淀,过滤除去,得到含有ZnSO4的滤液,再经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到ZnSO4·7H2O.经以上分析可知,镀锌铁皮的镀层被破坏后,形成原电池,锌作负极,铁被保护,则铁的腐蚀比生铁慢,选项A 错误.由分析知,“氧化”时,H2O2将Fe2+氧化为Fe3+,发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,选项B 正确.“调pH”时将Fe3+转化为Fe(OH)3沉淀,故“调pH”后所得溶液中不能大量存在的离子有Fe3+,选项C错误.从“过滤2”所得滤液中获取晶体的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,选项D 错误.答案为B.
相比于传统的题型,离子反应新题型综合性更强,分析判断更深入.纵观近几年高考试题可以发现问题情境化、注重化学学科素养在高考试题中的体现是未来命题发展的必然趋势.因此在备考过程中应注重知识点间的渗透融合,注重对知识点的发散和延伸,只有把握知识的本质,探寻解题的规律,培养关键的能力,才能提高解题的准确率.
(完)
