厘清实验探究逻辑,构建可逆氧化还原反应探究思路
2022-08-15袁廷新彭莉华
杨 梅 袁廷新 彭莉华
(中国人民大学附属中学朝阳学校)
«普通高中化学课程标准(2017 年版2020 年修订)»指出高中化学学业水平考试命题必须坚持“以核心素养为测试宗旨”,强调以化学知识为工具解决真实问题情境中的实际问题,发展和评价学生的核心素养.实验探究在高中化学学业水平考试中占有举足轻重的地位,是对学生在中学化学实验学习中所获得的基本实验知识、化学实验思维和探究能力的综合考查,充分体现了化学核心素养对实验探究与创新意识的要求.本文旨在立足可逆氧化还原反应的特点,结合高考中的实验探究题,帮助学生厘清实验探究的逻辑,构建解决可逆氧化还原反应探究的基本思路.
1 基于反应特点,定性认识化学平衡移动原理与物质氧化性、还原性的联系
对于可逆氧化还原反应,物质浓度的改变致使Qc≠K,化学平衡状态将发生改变.其本质原因是浓度改变导致了物质的氧化性或还原性相对强弱发生改变,从而有可能使化学反应方向发生变化.
例1(2015年北京卷)为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I-⇌2Fe2++I2”反应中Fe3+和Fe2+的相互转化.实验如图1所示.
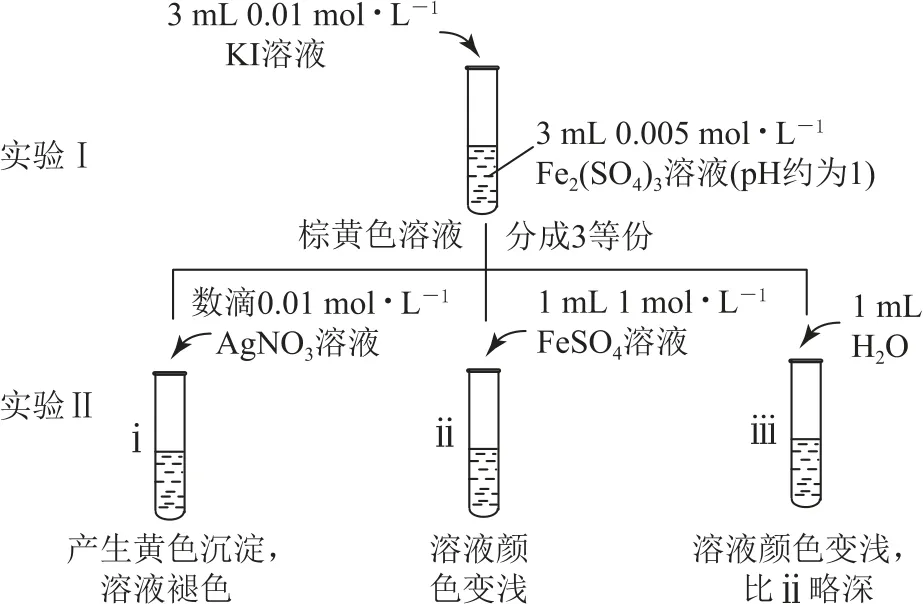
图1
(1)待实验Ⅰ溶液颜色不再改变时,再进行实验Ⅱ,目的是使实验Ⅰ的反应达到_________.
(2)ⅲ是ⅱ的对比实验,目的是排除ⅱ中_________造成的影响.
(3)ⅰ和ⅱ的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化.用化学平衡移动原理解释原因_________.
(4)根据氧化还原反应的规律,该同学推测ⅰ中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+.用图2装置(a、b均为石墨电极)进行实验验证.

图2
①K 闭合时,指针向右偏转.b作_________极.
②当指针归零(反应达到平衡)后,向U 形管左管中滴加0.01mol·L-1AgNO3溶液.产生的现象证实了其推测.该现象是________.
(5)按照(4)的原理,该同学用图2 装置进行实验,证实了ⅱ中Fe2+向Fe3+转化的原因.
①转化原因是_________.
②与(4)实验对比,不同的操作是________.
(6)实验Ⅰ中,还原性:I->Fe2+;而实验Ⅱ中,还原性:Fe2+>I-.将(3)和(4)(5)作对比,得出的结论是_________.

解答此题首先要厘清实验之间的相互联系,实验Ⅰ为建立“2Fe3++2I-⇌2Fe2++I2”的化学平衡状态,实验Ⅱ为探究c(I-)、c(Fe2+)改变对化学平衡移动的影响,双液原电池实验则是从氧化还原反应原理的视角分别探究实验Ⅱ中反应ⅰ、ⅱ化学平衡移动的本质原因.(1)实验Ⅰ中溶液颜色不再改变,说明溶液中的有色物质I2和Fe3+浓度不再发生变化,因此说明反应“2Fe3++2I-⇌2Fe2++I2”达到了化学平衡状态.(2)由于ⅲ是ⅱ的对照实验,实验ⅱ为向实验Ⅰ中的平衡体系加入了1 mL1 mol·L-1FeSO4溶液,其实验目的为增大c(Fe2+),通过观察发现溶液颜色变浅,证明化学平衡发生逆向移动.但由于溶剂水会稀释溶液,既可能使化学平衡发生移动,也会使有色微粒浓度变小,导致颜色变浅,因此需要加入相同体积的蒸馏水进行对照实验排除干扰.(3)结合化学平衡移动原理解释c(I-)和c(Fe2+)浓度改变对化学平衡移动的影响.(4)利用双液原电池,从氧化还原反应的视角,验证“外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+”的理论推理,通过进行与实验Ⅰ及实验Ⅱ中的ⅰ相同的操作,利用原电池指针偏转方向的改变,指示化学平衡的逆向移动,探究c(I-)降低使化学平衡逆向移动的本质原因.(5)利用与(4)类似的原理和操作,探究增大c(Fe2+)使化学平衡逆向移动的本质原因,因此,需要采取与实验Ⅰ及实验Ⅱ中的ⅱ相同的操作.(6)是对整个实验过程的总结提升,通过对实验Ⅰ、Ⅱ中I-与Fe2+还原性强弱变化原因的深入分析,得出浓度改变时,化学平衡移动原理与氧化还原反应规律的联系.
答案(1)化学平衡状态.
(2)溶液稀释对颜色变化.
(3)加入Ag+发生反应:Ag++I-=AgI↓,降低c(I-)或增大c(Fe2+),平衡均逆向移动.
(4)①正;②左管产生黄色沉淀,指针向左偏转.
(5)①Fe2+随浓度增大,还原性增强,使Fe2+还原性强于I-;②向右管中加入1 mol·L-1FeSO4溶液.
(6)该反应为可逆氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动的方向.

此实验探究的目的为“探讨化学平衡移动原理与氧化还原反应规律的联系”,所选取的实验素材为“2Fe3++2I-⇌2Fe2++I2”这一可逆的氧化还原反应.基本实验逻辑为:基于化学平衡移动的实验事实解释,从氧化还原视角提出合理的理论逻辑分析,通过进一步的电化学实验设计与实验验证,获得关于化学平衡移动原理的微观本质原因与氧化还原反应规律之间的相互联系,最终建立物质浓度改变对其氧化性、还原性强弱的影响及对化学平衡移动的影响之间的联系.
变式为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验.
已知:相关物质的溶解度(20 ℃)为
AgCl:1.5×10-4g,Ag2SO4:0.796g.
(1)甲同学的实验如下.

注:经检验黑色固体为Ag.
①白色沉淀的化学式是_________.
②甲同学得出Ag+氧化了Fe2+的依据是________.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按图3连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
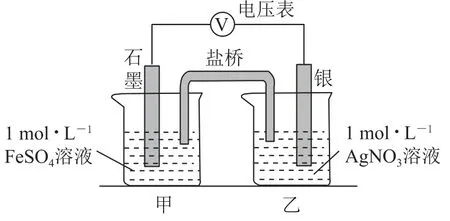
图3
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是________.
②b中电压表指针逆向偏移后,银为_________极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是_________.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验.

①实验Ⅲ_________(填“能”或“不能”)证明Fe3+氧化了Ag,理由是________.
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:_________.

此题包括3个探究实验,实验Ⅰ通过Ag+与Fe2+反应产物的检验,比较Ag+与Fe3+氧化性的强弱;实验Ⅱ利用双液原电池原理,验证“Fe2++Ag+→Fe3++Ag”可以发生,同时通过增大c(Fe3+),使电压表指针发生反向偏转,进而得出该反应为可逆的氧化还原反应;实验Ⅲ通过探究不同铁盐清洗银镜的效果及原因,验证“Fe3++Ag→Fe2++Ag+”可以发生,得出改变生成物Ag+浓度,可以使可逆氧化还原反应的化学平衡发生移动.实验Ⅰ将AgNO3溶液加入FeSO4溶液中,既可以发生复分解反应,生成Ag2SO4沉淀,也可以发生氧化还原反应生成Fe3+和Ag,因此Ag+氧化了Fe2+的依据就是能够证明Fe3+及Ag 产生的实验现象.实验Ⅱ中当AgNO3溶液与FeSO4溶液作为双液原电池的两极反应物时,可以发生氧化还原反应,电压表指针发生偏转,负极反应为Fe2+-e-=Fe3+,正极反应为Ag++e-=Ag,当向甲烧杯中逐渐加入浓Fe2(SO4)3溶液使电压表发生反向偏转时,原电池的正、负极发生反转,负极为Ag-e-=Ag+,通过两步操作可得出Fe2+与Ag+的反应为可逆反应.实验Ⅲ、Ⅳ、Ⅴ中使用不同的铁盐溶液与Ag反应时反应的程度不同,由此可知阴离子对“Fe3++Ag→Fe2++Ag+”的反应有影响,在Fe(NO3)3溶液中,由于Fe3+水解显酸性,在酸性条件下具有氧化性,可能氧化Ag,而、Cl-则可以与生成的Ag+生成沉淀,降低生成物Ag+浓度,使化学平衡发生正向移动,且Ag+浓度降低越明显,平衡正向进行的程度越大.
答案(1)①Ag2SO4;②有黑色固体(Ag)生成,加入KSCN 溶液后变红.
(2)①Fe2+-e-=Fe3+;②负;
③Fe2++Ag+⇌Fe3++Ag.
(3)①不能;因为Fe(NO3)3溶液呈酸性,酸性条件下也可能氧化Ag;②溶液中存在平衡:Fe3++Ag⇌Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大(或促使平衡正向移动,银镜溶解).

该实验的目的是“探究Ag+与Fe3+氧化性的相关问题”,所选取的实验素材为“Fe2++Ag+⇌Fe3++Ag”这一可逆的氧化还原反应.基本实验逻辑及操作为:通过探究Ag+与Fe2+可以发生氧化还原反应生成Fe3+和Ag,得出该条件下Ag+的氧化性强于Fe3+;利用双液原电池,通过增大Fe3+浓度,指针发生偏转,证实该反应是一个可逆反应,此时Fe3+的氧化性强于Ag+,可以发生反应“Fe3++Ag→Fe2++Ag+”;最后通过不同铁盐溶液洗涤银镜的效果不同的分析,认识通过生成溶解度不同的Ag2SO4、AgCl,降低c(Ag+)对“Fe3++Ag⇌Fe2++Ag+”平衡移动的影响.
2 由定性到定量,深入理解可逆氧化还原反应
例2(2021年北京卷)某小组验证反应“Fe2++Ag+⇌Fe3++Ag↓”为可逆反应并测定其平衡常数.
(1)实验验证.
实验Ⅰ.将0.0100 mol·L-1Ag2SO4溶液和0.0400mol·L-1FeSO4溶液(pH=1)等体积混合,产生灰黑色的沉淀,溶液呈黄色.
实验Ⅱ.向少量Ag粉中加入0.0100 mol·L-1Fe2(SO4)3溶液(pH=1),固体完全溶解.
①取Ⅰ中沉淀,加入浓硝酸,证实沉淀为Ag.现象是________.
②Ⅱ中溶液选用Fe2(SO4)3,不选用Fe(NO3)3溶液的原因是________.
综上所述实验,证实“Fe2++Ag+⇌Ag↓+Fe3+”为可逆反应.
③小组同学采用电化学装置从平衡移动角度进行验证.补全电化学装置示意图(如图4),写出操作及现象____.
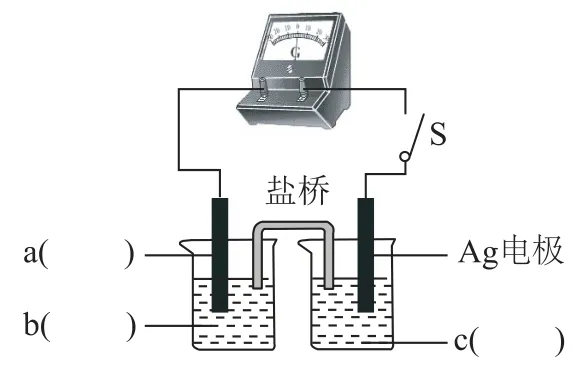
图4
(2)测定平衡常数.
实验Ⅲ.一定温度下,待实验Ⅰ中反应达到平衡状态时,取VmL 上层清液.用c1mol·L-1KSCN 标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液V1mL.
资料:Ag++SCN-⇌AgSCN↓(白色),K=1012.
Fe3++SCN-⇌FeSCN2+(红色),K=102.3.
①滴定过程中Fe3+的作用是________.
②测得平衡常数K=________.
(3)思考问题.
①取实验Ⅰ的浊液测定c(Ag+),会使所测K值________(填“偏高”“偏低”“不受影响”).
②不用实验Ⅱ中清液测定K的原因是_______.

此题包括3个层次:1)实验验证——定性分析.2)化学平衡常数测定——定量分析.3)思考问题——实验反思.验证可逆反应的常见方法有3种:①根据可逆反应的概念可知,验证正反应、逆反应在相同条件下发生.②结合可逆反应不能进行到底的特点,验证反应物与生成物共存于体系中.③结合可逆反应的特点,先建立化学平衡状态,再改变条件使化学平衡发生移动,此外还可以利用双液原电池原理,通过指针的偏转指示化学反应的方向.
实验Ⅰ和实验Ⅱ从正反应和逆反应两个角度验证了“Fe2++Ag+⇌Fe3++Ag↓”为可逆反应,当Ag2SO4溶液与FeSO4溶液混合时,可以生成Ag和Fe3+.检验生成Ag的实验方法为:将Ⅰ中所得沉淀加入浓硝酸,观察到固体溶解,产生红棕色气体的现象.在验证Fe3+也可以氧化Ag时,需要排除阴离子对该反应的影响,由于Fe3+水解显酸性,在酸性条件下具有氧化性,也可能氧化Ag,故不选择硝酸铁.在利用双液原电池原理验证“Fe2++Ag+⇌Fe3++Ag↓”为可逆反应时,需先构建原电池,建立化学反应平衡,化学平衡既可以正向建立也可以逆向建立,因此原电池的总反应可以为①“Fe2++Ag+→Fe3++Ag↓”或②“Fe3++Ag →Fe2++Ag+”,所给装置中已有Ag电极,若以①反应建立平衡,则需要提供FeSO4和AgNO3,因此可将Ag电极置于AgNO3溶液中作正极材料及反应物,负极材料可选择不参与反应的石墨电极或Pt电极,负极反应物选择FeSO4溶液.同理,也可以根据②反应来建立平衡,反应物变为Fe2(SO4)3和Ag即可.化学平衡建立(指针归零)之后,通过改变Fe3+浓度或Ag+浓度,让指针发生偏转,验证该化学平衡可以发生移动,进而确定该反应为可逆反应.实验Ⅲ为通过沉淀滴定,定量测定实验Ⅰ中平衡时溶液中相关微粒的浓度,从而计算该化学平衡的平衡常数.在进行Ag+含量的沉淀滴定时,需选择合适的指示剂指示滴定的终点,实验Ⅰ所得溶液中含有Fe3+能与沉淀滴定的试剂SCN-生成红色物质,且沉淀反应与络合反应的K相差较大,可以作为该沉淀滴定的指示剂.在计算化学平衡常数时,先根据滴定数据,计算出反应后溶液中的c(Ag+)=再计算出平衡时的Fe2+、Fe3+、Ag+的浓度,进而求出化学平衡常数.第三问是对化学平衡常数测定实验的反思,若选用Ⅰ中浊液,则浊液中由于存在Ag,在用SCN-沉淀Ag+时,Ag+浓度减小,化学平衡发生逆向移动,则测得的c(Ag+)比原平衡时大,c(Fe2+)也偏大,c(Fe3+)则偏小,计算所得的K则偏小.由于实验Ⅱ中固体完全溶解,无法确定该反应是否达到化学平衡状态,因此不可以使用该清液测定K.
答案(1)①固体溶解,产生红棕色气体.②酸性条件下有氧化性;③a:石墨电极/Pt电极;b:酸 性FeSO4溶 液/酸 性Fe2(SO4)3溶 液/酸 性FeSO4与Fe2(SO4)3溶液;c:AgNO3溶液.组装好装置后,闭合K,当灵敏电流计指针不动时,向左池加入较浓Fe2(SO4)3溶液,指针偏转,向右池加入较浓AgNO3溶液,指针反向偏转.
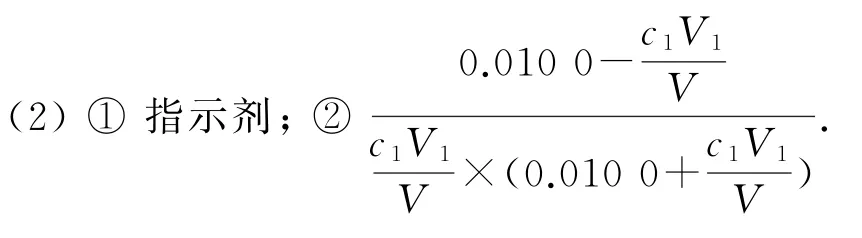
(3)①偏低;②Ag 完全反应,无法确定反应是否达到平衡状态.

本题是对化学实验思维与探究能力的综合考查.该实验探究主要包括2个任务:1)从定性角度验证“Fe2++Ag+⇌Fe3++Ag↓”为可逆反应.2)定量测定该反应的化学平衡常数.实验从熟悉的可逆氧化还原反应的定性验证出发,到化学平衡常数的定量测定,培养定性与定量相结合的意识,发展变化观念与平衡思想,形成证据推理与模型认知的学科能力,深入理解化学平衡建立和移动的本质.通过化学平衡移动原理与电化学实验设计的融合,深刻理解平衡原理并迁移应用于实验设计与现象判断.其中补全电化学装置,能进一步深化对电化学本质及原理的认识,体现了试题的开放性.
可逆氧化还原反应的实验探究是对化学平衡移动原理和氧化还原反应原理的综合应用.在解决此类实验探究问题时,首先要明确实验目的和可逆氧化还原反应的特点,然后结合化学平衡移动的原理及氧化还原的原理(影响微粒氧化性、还原性的因素、电化学原理等),梳理清楚每个实验的实验目的和各个实验之间的内在逻辑,最后依据实验现象和实验数据分析得出合理的结论.
(完)
